痛風性關節炎血管內皮功能及其與血尿酸水平的相關性
沈雪嬌,李 燕,王 挺,王 媛
(蘭州大學第二醫院 超聲醫學中心,甘肅 蘭州 730030)
痛風性關節炎( gouty arthritis,GA)是由于嘌呤生物合成代謝增加,血尿酸(serum urate,SUA)升高,尿酸鹽結晶沉積在關節滑膜、滑囊、軟骨及其他組織中,引起炎癥反復發作,是一種常見的慢性炎癥性、代謝性疾病,其發病率正逐年升高。流行病學表明[1],GA患者發生動脈粥樣硬化的概率較高,由于SUA水平升高是動脈粥樣硬化的常見重要因素,而血管內皮功能紊亂是動脈粥樣硬化的觸發機制,因此,我們推測GA患者可能出現血管內皮功能受損,且與SUA水平具有相關性,但相關國內研究較少。本研究旨在利用超聲評估GA患者血管內皮功能是否受損,探討其與SUA的相關性,同時也對比分析了血管內皮功能受損與C反應蛋白(C-reactive protein, CRP)、頸動脈內中膜厚度(carotid intima media thickness,CIMT)及病程的相關性。
1 資料與方法
1.1病例選擇 選擇2020年2月至2021年12月在蘭州大學第二醫院風濕科確診的GA患者120例,所有患者均符合2015年美國風濕病學會/歐洲抗風濕病聯盟制定的痛風分類標準,檢查前1個月未接受降尿酸(別嘌呤醇、非布司他或丙磺胺)或秋水仙堿治療,納入GA組(正在服用糖皮質激素或非甾體類抗炎藥的患者被排除在外),同時排除合并高血壓、心臟病、冠狀動脈粥樣硬化、慢性腎病等,最終符合條件患者45例,其中男性36例,女性9例,平均年齡(38±11)歲。選取對照組35例,其中男22例,女13例,平均年齡(35±10)歲,均健康狀況良好,近1個月無藥物服用史。本研究經倫理審查會研究通過,所有受試者均簽署知情同意。
1.2儀器與方法 使用Mindary Resona 7彩色多普勒超聲診斷儀,5~14 MHz線陣探頭。于安靜環境中,患者平躺于檢查床,雙上肢平置于身體兩側,輕度外旋、外展,靜息15 min。記錄患者身高(cm),體重(kg),身體質量指數(body mass index,BMI)、收縮壓(systolic blood pressure, SBP)(mmHg)。超聲數據采集由2名高年資超聲科醫師進行。于右肘關節上方3 cm處掃查患者右側肱動脈,清晰顯示管壁及內膜后,測量前后內膜之間的距離,為基礎內徑(D0)并進行標記。血壓計袖帶縛于上臂(下緣平肘關節皮膚橫紋處),充氣加壓至300 mmHg(1 mmHg=0.133 kPa),持續5 min,迅速放氣,測量標記位置處肱動脈內徑(D1),D0、D1均測量3次,取平均值,計算內皮依賴性舒張功能(flow-mediated dilation,FMD)=(D1-D0)/D0×100%。繼續掃查右側頸動脈,于球部近端10~20 mm處,清晰顯示頸動脈內中膜,手動測量CIMT值。記錄實驗室數據,于FMD測量當天采血化驗,記錄SUA,高密度脂蛋白膽固醇(high density lipoprotein,HDL),低密度脂蛋白膽固醇(low-density lipoprotein,LDL),總膽固醇(total cholesterol,TC),三酰甘油(triglycerides,TG),CRP,血沉(erythrocyte sedimentation rate,ESR)等。

2 結 果
2.1兩組臨床和實驗室數值 GA組BMI、SUA、ESR、CRP、TC、TG、LDL均較對照組高,差異有統計學意義(P<0.05)。GA組FMD值低于對照組,差異具有統計學意義(P<0.01),GA組SBP、CIMT值較對照組略高,差異無統計學意義(P>0.05)。見表1。
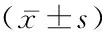
表1 兩組臨床和實驗室數值比較Tab.1 Comparison of clinical and laboratory values between the two groups
2.2GA組FMD與其他變量相關性分析 GA組FMD與SUA、CRP、CIMT及病程均呈負相關(P<0.05),見表2。

表2 FMD與其他變量相關性分析Tab.2 Correlation analysis between FMD and other variables
2.3FMD與SUA單因素回歸性分析 FMD與SUA負相關,SUA每增加1個單位,FMD平均減少0.010個單位,調整R2為0.1352,SUA能解釋回歸總變異的13.52%。見表3、圖1。

表3 FMD與SUA回歸分析結果Tab.3 Regression analysis of FMD and SUA

圖1 FMD與SUA單因素回歸性分析Fig.1 Univariate regression analysis of FMD and SUA
3 討 論
GA是一種單鈉尿酸鹽沉積所導致的晶體相關性關節疾病,臨床特征為急性關節炎反復發作、痛風石沉積和關節畸形,常伴發肥胖、高血壓、高脂血癥、動脈硬化等,其本質是一種慢性炎癥,而幾乎任何形式的慢性全身炎癥都是動脈功能障礙的危險因素;GA的主要特征是高尿酸,尿酸可能阻礙內皮細胞產生一氧化氮的能力,從而限制動脈反應性[2],因此,GA患者血管內皮功能可能受損。目前血管內皮功能可靠的無創性評價方法是通過超聲測量肱動脈血流介導的FMD[3],且超聲檢查可無創、多次重復監測FMD值的變化,指導臨床早期、有效的預防和干預血管疾病的進展。
本研究發現,GA組BMI、TC、TG、LDL均較對照組高,差異具有統計學意義,GA患者常合并肥胖及高脂血癥,這是由于炎性因子的釋放可導致脂質代謝的改變,促進游離脂肪酸釋放,TC合成量增加,脂蛋白脂酶活性減低,導致血脂異常[4]。CIMT已被用作觀察和臨床試驗中研究冠狀動脈硬化的標志性參數[5-6]。本研究發現,GA組CIMT值較對照組略升高,二者差異無統計學意義,均在正常范圍內,與既往文獻報道不一致[7-9],這可能是由于影響CIMT的因素較多,與年齡、血脂、血壓、肥胖等因素均有關[10-11],本研究納入患者年齡多為中-青年人,兩組收縮壓差異亦無統計學意義,同時也說明我們納入的GA組血管壁形態及血流動力學尚未改變。
GA組SUA較對照組明顯增高,FMD較對照組減低,差異均具有統計學意義,同時對GA組FMD與SUA進行單因素回歸分析顯示,FMD與SUA呈現負相關,SUA每增加1個單位,FMD平均減少0.010個單位,調整R2為0.1352,SUA能解釋回歸總變異的13.52%,即SUA值可以用來預測GA患者的血管內皮功能障礙,與Krasnokutsky等[12]研究結果一致。血管內皮細胞可調控白細胞和血小板的黏附,產生血管活性物質,作用于血管平滑肌細胞,促進動脈血管的舒張,內皮細胞功能受損,對動脈粥樣硬化的發生、發展起重要作用。尿酸鹽如何介導血管內皮功能仍不確定,但有證據表明[13-16],內皮細胞轉運體可能會對細胞反應產生不利影響,尿酸鹽水平的增加會降低內皮細胞表面外排轉運體的表達,協同促進細胞內尿酸含量升高;或者,黃嘌呤氧化酶活性被認為是活性氧的主要來源,尿酸通過發揮促氧化作用和降低一氧化氮的生物利用度而影響血管反應性。SUA水平也與GA患者臨床評分呈正相關,高SUA水平會加重GA患者的臨床癥狀[17]。Krasnokutsky等[12]亦發現,GA患者FMD減低與超敏CRP呈負相關,與本文研究結果一致,CRP被認為是一種急性期反應物,在許多炎癥性疾病中升高,CRP存在于動脈粥樣硬化斑塊中,但不存在于正常的血管壁中,早期動脈粥樣硬化病變中的CRP沉積可能先于單核細胞的出現,在GA患者中,尿酸鹽結晶沉積于血管壁, 損傷內膜[18],同時會引起炎癥反復發作,損傷血管內皮細胞的舒張功能。國內外研究均發現[19-20],藥物治療降低SUA水平及全身炎癥標志物后,能改善患者的血管內皮功能,從而也進一步印證了高SUA水平,及患者處于較重的炎癥狀態時候,會引起血管內皮功能損傷。
本研究表明,GA患者病程越長,FMD越低,與文獻報道一致,Abhishek等[21]研究發現,較長的疾病持續時間是頻繁的痛風發作的獨立影響因素,且當病程持續時間≥5.1年時,GA頻繁發作的檢測率達80%。同時,Zou等[22]研究發現,超聲觀察到的尿酸鹽沉積、高尿酸水平及較長的病程是痛風頻繁發作的獨立影響因素。頻繁的痛風發作,會導致CRP的反復升高,引起SUA值的波動,從而影響血管內皮功能。
但本研究的不足之處,首先是樣本量較少,部分患者依從性差,于檢查前自行服用降尿酸及非甾體類抗炎藥,影響檢查結果,故有待將來增大樣本量進一步分析研究;其次,我們沒有對觀察指標進行綜合分析,目前仍不能排除是多種因素累計作用影響血管內皮功能的可能性。
超聲可無創性評價血管內皮依賴性舒張功能,GA患者與健康成人相比血管內皮功能受損,與較高的SUA、CRP水平,較長的病程有關,其中,SUA與血管內皮功能受損呈中等負相關,可以用來預測血管內皮受損,對臨床早期預防心血管疾病具有重要價值。同時,本研究后期發現,降尿酸結合抗血脂等臨床藥物治療后部分患者的FMD值出現了有效逆轉,但樣本量較少,后期將持續收集病例,進一步完善該研究。

