基因組分析對豬乳頭數相關數量性狀基因座鑒定
尹彥鎮,侯黎明,劉航,陶偉,石傳宗,劉鍇月,張萍,牛培培,李強,李平華,黃瑞華
基因組分析對豬乳頭數相關數量性狀基因座鑒定

1南京農業大學養豬研究所,南京 210095;2南京農業大學淮安研究院,江蘇淮安 223001;3淮安市淮陰新淮種豬場,江蘇淮安 223322
【目的】分析乳頭數的變異,挖掘與乳頭數相關的數量性狀基因座(quantitative trait locus,QTL)和候選基因,為豬乳頭數的選育研究提供重要分子標記。【方法】準確測定了709頭蘇淮豬(335頭育肥豬和374頭種豬)的左、右和總乳頭數。對蘇淮育肥豬進行80K芯片分型,并使用芯片數據計算左、右、總乳頭數的遺傳力和基因組估計育種值(genomic estimated breeding value, GEBV)。基于乳頭數GEBV和表型排名,選擇前10%的個體以及后10%的個體進行群體分化指數分析(fixation Index,F)檢測高度分化的位點。接著,通過全基因組關聯分析(genome wide association analysis, GWAS)鑒定與乳頭數關聯的位點,選擇高度分化且與乳頭數顯著關聯的位點作為候選位點,選擇位于候選位點附近且功能注釋后與乳頭數相關的基因作為候選基因。最后,選擇每個染色體上最顯著的候選位點對709頭蘇淮豬進行乳頭數關聯分析,以驗證上述位點的顯著性。【結果】蘇淮育肥豬左、右、總乳頭數的變異系數分別為10.20%、9.26%、8.50%,遺傳力分別為0.212、0.257、0.312。基于F和GWAS分析,總共在7、13、16、18號染色體(Chromosome, SSC)上鑒定到20個乳頭數的候選位點,這些候選位點可解釋5.49%—8.03%的表型方差。其中,SSC7上與總乳頭數關聯的位點rs80894106與文獻中報道的影響大白和杜洛克豬總乳頭數的候選位點一致,但左乳頭的候選位點rs81444134(26.51 Mb, SSC13)和rs81233299(8.13 Mb, SSC18)均為新發現的與乳頭數相關的位點。左、右、總乳頭的候選位點主要集中在SSC16上的6.36—10.66 Mb區間;連鎖不平衡(linkage disequilibrium, LD)分析發現,區間內7.47—8.27 Mb的候選位點擬合成了一個795 kb的單倍型塊,且該單倍型塊是新發現的影響乳頭數的候選區域;單倍型塊內的rs337606862(7.47 Mb)與右乳頭和總乳頭最顯著關聯,單倍型塊內的3個位點均位于cadherin 18()基因的內含子上,編碼Ⅱ型鈣黏附素,且鈣黏附素與發育中組織細胞的識別、分選、增殖、凋亡以及乳腺癌的發生有關。因此,可能是新的影響豬乳頭數的候選基因。再者,本研究對4個染色體上最顯著的位點:rs81444134、rs80894106、rs337606862、rs81233299在709頭蘇淮豬中基因分型,經關聯分析后發現,這些位點均與乳頭數顯著相關,可以作為潛在分子標記用于乳頭數的選育。【結論】本研究通過基因組分析在蘇淮豬群體中鑒定到20個與乳頭數顯著相關的位點。其中SSC13上的26.51 Mb和SSC18上的8.13 Mb是新的乳頭數的候選QTLs,SSC16上的7.47—8.27 Mb也是新發現的乳頭數的候選QTL,且區間內可能是新的影響豬乳頭形成的候選基因。
F;GWAS;數量性狀基因座(quantitative trait locus,QTL);蘇淮豬;乳頭數;候選基因
0 引言
【研究意義】豬的乳頭一般呈圓柱狀,分布在腹部中線的兩側。根據分布位置的差異,豬的乳頭劃分為左乳頭和右乳頭。發育正常的乳頭具備泌乳的功能,能夠為仔豬提供生長發育所必須的營養物質。因此,擁有更多功能正常乳頭的母豬能夠哺乳更多的初生仔豬。研究表明,仔豬利用的母豬功能乳頭的數目與仔豬的成活率密切相關[1]。同時,KIM等[2]研究了商業豬種乳頭數與產仔數的關系,發現乳頭數多的母豬產仔數和斷奶仔豬數也更多。因此,乳頭數是生豬生產中非常重要的繁殖性狀。此外,隨著育種技術的應用,以丹麥大白、長白為代表的多豬種的產仔數性狀得到了有效的選育提升,但其乳頭數未經系統選育提升,導致仔豬數多于乳頭數,會使得一部分仔豬需要通過寄養或人工哺乳的方式存活,增加生產成本和管理難度。因此,乳頭數的性狀改良是當下育種研究的重點之一。【前人研究進展】乳頭數性狀由多基因控制,遺傳機理復雜。僅基于表型對乳頭數性狀進行選育的遺傳進展較慢。結合分子標記選育能有效加快性狀改良的進程[3]。SNP芯片分型技術能夠高效、準確地獲得大量SNPs的基因型,推動了F[4]分析和GWAS分析在鑒定復雜性狀候選QTLs和基因上的應用。HE等[5]按照產仔數EBV排名選擇前10%和后10%的二花臉豬進行F分析,鑒定到、和等3個潛在影響產仔數的候選基因。李開軍等[6]采取相同的選擇策略針對蘇淮豬的中性洗滌纖維表觀消化率進行F分析,鑒定到多個與纖維表觀消化率性狀相關的基因和SNPs。在商業豬種乳頭數的GWAS分析中,MOSCATELLI等[7]使用60K芯片分型了821頭意大利大白豬,在6、7號染色體上分別鑒定到顯著影響前后乳頭對稱性以及乳頭數的QTLs,并將和作為兩種性狀對應的候選基因。LI等[8]在杜洛克豬的GWAS分析中新發現了影響乳頭數的和影響左右乳頭對稱性的。在國內地方豬種的GWAS分析中,TANG等[9]在白杜洛克和二花臉的雜交群體中定位到影響乳頭數的和。ZHOU等[10]基于GWAS分析在1、13和X染色體上鑒定到多個與蘇山豬乳頭數顯著關聯的SNPs。目前,豬QTLdb數據庫中總共收錄了624個與乳頭數關聯的QTLs,每條染色體上均有分布(https://www. animalgenome.org/cgi-bin/QTLdb/index/)。【本研究切入點】盡管已有多數關于乳頭數的研究報道,但是影響乳頭數的主效基因和因果突變仍未知。已有研究主要集中在國外商業豬種,其研究結果通常存在群體異質性,而國內地方豬種或含有地方豬種血緣的培育豬種的研究有待系統開展。蘇淮豬是以本研究團隊作為技術支撐單位,歷經12年時間,于2010年培育而成的國家級瘦肉型豬新品種,含75%的大白豬和25%的淮豬血統[11]。該群體在包括乳頭數在內的性狀上存在一定的變異,是鑒別影響豬乳頭數QTL、候選基因以及解析乳頭數變異遺傳機制的良好素材。【擬解決的關鍵問題】本研究以蘇淮豬為試驗動物,統計了群體內乳頭數的分布狀況,并使用SNP芯片進行個體基因分型。基于SNP芯片數據估計了乳頭數的遺傳力,選取多乳頭數個體和少乳頭數個體進行F分析,并在整個群體進行了表型和基因型間的GWAS分析,結合F分析和GWAS分析挖掘顯著影響乳頭數的候選QTLs和基因,并對候選基因進行功能注釋。本研究的結果旨在為研究豬乳頭數的遺傳基礎提供理論參考,同時為蘇淮豬乳頭數的分子育種提供關鍵分子標記。
1 材料與方法
1.1 試驗動物
試驗選用335頭蘇淮育肥豬、374頭蘇淮種豬(25頭公和349頭母豬)共709頭蘇淮豬均在江蘇省淮安市淮陰新淮種豬場內飼養。在2019年內,準確記錄其左、右乳頭數及總乳頭數。蘇淮育肥豬作為試驗群體用于鑒定與乳頭數顯著關聯的SNPs,全部群體用于驗證部分顯著的SNPs的顯著性。
1.2 試驗方法
1.2.1 DNA提取與基因分型 采集709頭蘇淮豬的耳組織并貯存于2 mL離心管中。離心管內裝有2/3體積的75%酒精且外側管壁貼有膠帶以記錄耳號。取小部分耳組織用于提取DNA,剩余樣品保存至-20 ℃冰箱。DNA提取的試劑及步驟參見天根DNA提取試劑盒說明。試驗群體中,濃度和質量符合要求的DNA進一步使用Geneseek GGP 80K芯片進行SNP分型。分型后,使用PLINK[12]軟件基于以下標準進行質量控制:SNP在個體的檢出率及個體的SNP檢出率均大于0.9,次等位基因頻率大于0.05。總共有334個個體(其中有一個個體因未達到質控標準被去掉)及50 504個SNPs通過了質控并用于后續的分析。
1.2.2 主成分分析 群體內分層可能會導致不同的亞群內部個體之間的關系比實際更緊密,進而影響總體的關聯性評估。本研究使用PLINK[12]軟件執行了主成分分析,計算了前10個主成分的特征值并以主成分1和主成分2分別作為橫、縱坐標繪制PCA圖。
1.2.3 遺傳力評估 使用DMU[13]軟件估計試驗群體單個性狀的方差組分及個體育種值。模型如下:
y=+sex+ad+e
其中,y代表左、右、總乳頭數;為群體表型均值;sex為個體的性別;個體的加性效應ad,服從正態分布ad-(0,);殘差項e,服從正態分布e-(0,);是由invgmatrix[14]軟件使用50 504個SNPs構建的基因組親緣關系矩陣;是單位陣;和分別為加性方差和殘差方差。基因組遺傳力的計算公式為:2/(+)。
1.2.4 群體分化指數分析 研究進行了試驗群體內多乳頭數和少乳頭數兩組間的F分析,以檢測多乳頭數個體與少乳頭數的個體之間顯著分化的位點。分組規則如下:首先,按照左、右、總乳頭數的GEBV分別進行排序,各選擇排名前10%的個體和排名后10%的個體分別作為F分析的多乳頭組和少乳頭組;其次,由于GEBV是模型估計的值,可能存在一定的偏差,因此剔除了多乳頭組中表型值低于平均值的個體以及少乳頭組中表型值高于平均值的個體。最終,左、總乳頭數的多乳頭組及右、總乳頭數的少乳頭組均有32個個體,其余組為33個個體,并使用獨立樣本t檢驗估計極端乳頭組間表型和GEBV值的差異性。F分析的模型參照WEIR等[15]的研究模型并且使用VCFTOOLS[16]軟件計算全部SNPs的F值并取絕對值。取F值的絕對值前5%的位點作為顯著分化的位點。左、右、總乳頭數F分析的閾值分別為0.1674、0.1469、0.1482,均接近WRIGHT等[4]劃分的高度分化的閾值條件(0.15<F<0.25)。
1.2.5 全基因組關聯分析 試驗群體乳頭數與全基因組50 504個SNPs間的關聯性檢驗通過LDAK[17]軟件的Wald檢驗實現。模型如下:
=++++
其中,為乳頭數表型;為群體均值;為SNP基因型矩陣,為基因型效應值;為固定效應矩陣,為性別效應;為剩余多基因效應,服從正態分布-(0,),為校正的基因組親緣關系矩陣;為殘差,服從正態分布-(0,);其余字母含義同遺傳力估計的模型。由于GWAS分析共執行了50 504次假設檢驗,因此,采用BONFERRONI[18]方法計算基因組顯著的閾值為0.05/50504(9.90×10-7)。考慮到BONFERRONI[18]方法的嚴格性,染色體顯著的閾值定義為1/50504(1.98×10-5)[19]。其次,在估計單個SNP效應時,GWAS模型同時添加了SNP的固定效應和多基因效應,造成了效應的重復校正。參考SCHMID等[20]的方法,即每次估計SNP效應時,剔除該SNP所在染色體,使用剩余染色體的SNPs構建矩陣。GWAS的結果包括曼哈頓圖和Q-Q圖由R包CMplot[21]可視化。最后,使用Haploview4.2[22]軟件繪制16號染色體上6.36—10.66 Mb的候選SNPs的連鎖不平衡圖,且只計算1 Mb內的SNPs之間的LD值。
1.2.6 顯著SNPs解釋的表型方差比例 為進一步評估試驗群體的GWAS分析,計算了顯著SNPs所解釋性狀的表型方差的比例。計算公式同ZHANG等[23]:=2(1-)2/。為解釋的表型方差比例;為最小等位基因頻率;為SNP的效應值;為表型方差,并且代表觀測值的離散程度。
1.2.7 候選SNPs所在候選基因的鑒別與功能注釋 本研究使用的80K芯片上的SNPs的物理位置是根據豬11.1參考基因組注釋。候選SNPs所在或者附近的基因作為候選基因。候選基因名稱通過Ensembl數據庫(http://www.ensembl.org/)查找。候選基因的功能使用GeneCards(https://www.genecards.org/)和Pubmed數據庫(https://pubmed.ncbi.nlm.nih.gov/)注釋。
1.2.8 候選SNPs與全部群體乳頭數關聯分析 本研究將左、右、總乳頭數的F以及GWAS分析共同定位的顯著SNPs作為候選SNPs。本研究選取了每條染色體上最顯著的候選SNPs以驗證其在全部群體中的顯著性。上述SNPs的引物在NCBI的Primer-BLAST模塊(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)設計,引物信息如表1,PCR擴增流程見表2,擴增產物通過Sanger測序判定SNPs的基因型。

表1 候選SNPs的引物信息
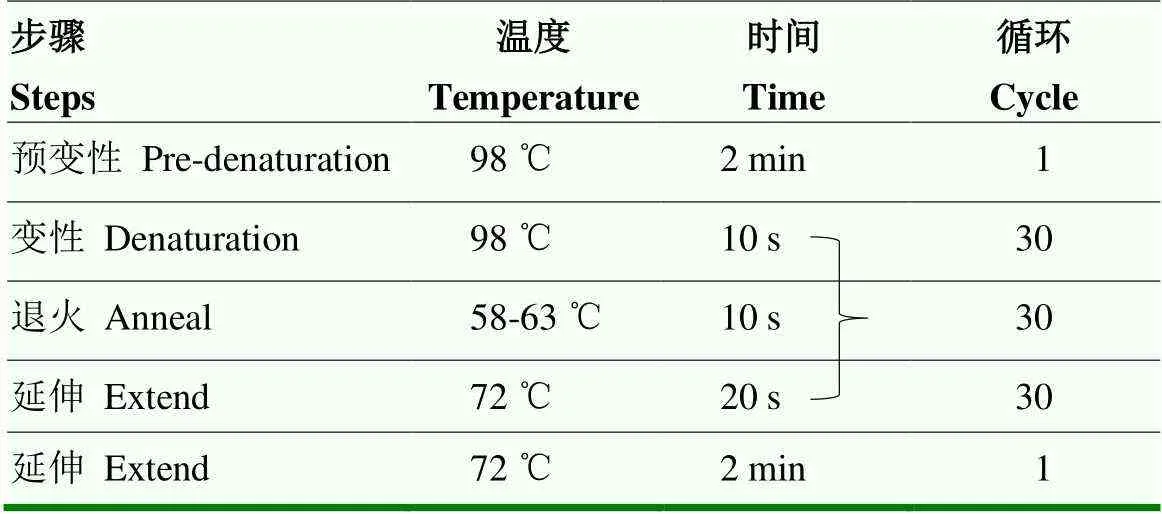
表2 PCR擴增流程
使用SAS 9.4(https://odamid-apse1.oda.sas.com/ SASStudio)的GLM模型對SNPs基因型和全部群體乳頭數進行關聯分析,并使用Bonferroni方法進行多重比較。模型如下:
y=+sex+g+e
其中,g為SNPs的固定效應,其余字母含義同遺傳力估計的模型。
2 結果
2.1 蘇淮豬試驗群體乳頭數描述性統計及遺傳力估計
表3展示了試驗群體334頭蘇淮豬乳頭數的分布、變異情況及遺傳力。左、右、總乳頭數的范圍分別是5—11、5—10、11—21,表型的分布比較分散。左、右、總乳頭數的變異系數分別為10.20%、9.26%、8.50%。蘇淮豬左、右、總乳頭數的遺傳力分別為0.212、0.257、0.312,屬于中高等遺傳力性狀。
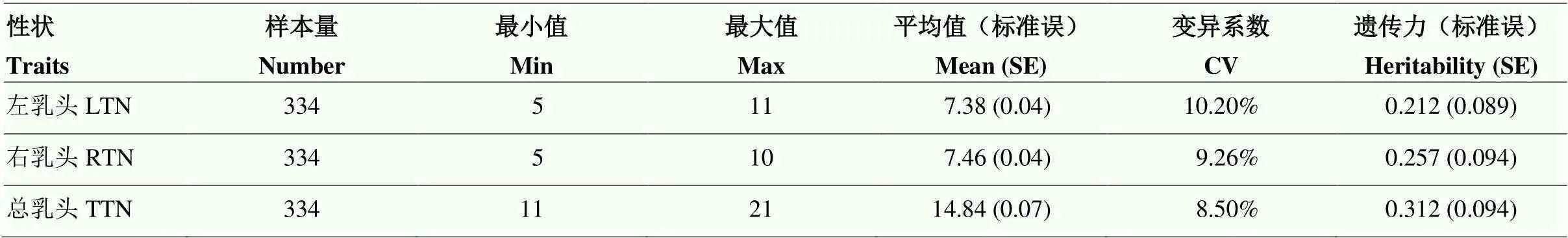
表3 334頭蘇淮豬乳頭數描述性統計及遺傳力估計
LTN,左乳頭;RTN,右乳頭;TTN,總乳頭;SE,標準誤;CV,變異系數。表7同
LTN, Left Teat Number; RTN, Right Teat Number; TTN, Total Teat Number; SE Standard Error; CV, Coefficient Variation. The same as table 7
2.2 蘇淮豬試驗群體分層檢驗
基于50 504個SNPs的基因型計算的主成分1和主成分2占總體特征值的百分比是相近的,并且群體內沒有明顯離群的個體(圖1)。因此,334頭蘇淮豬的群體內不存在更小的亞群。
2.3 蘇淮豬試驗群體乳頭數FST分析
試驗群體中用于F分析的多乳頭組的表型均值及GEBV均值均顯著高于少乳頭組(表4)。3個乳頭數性狀的F分析均鑒定到2 525個在多乳頭組和少乳頭組之間高度分化的SNPs(圖2)。左乳頭F值排名前五的SNPs位于SSC10的28.10—28.37 Mb;右乳頭F值排名前五的SNPs位于SSC8、SSC13、SSC14上;總乳頭F值排名前五的SNPs位于SSC8、SSC13、SSC16上(表5)。
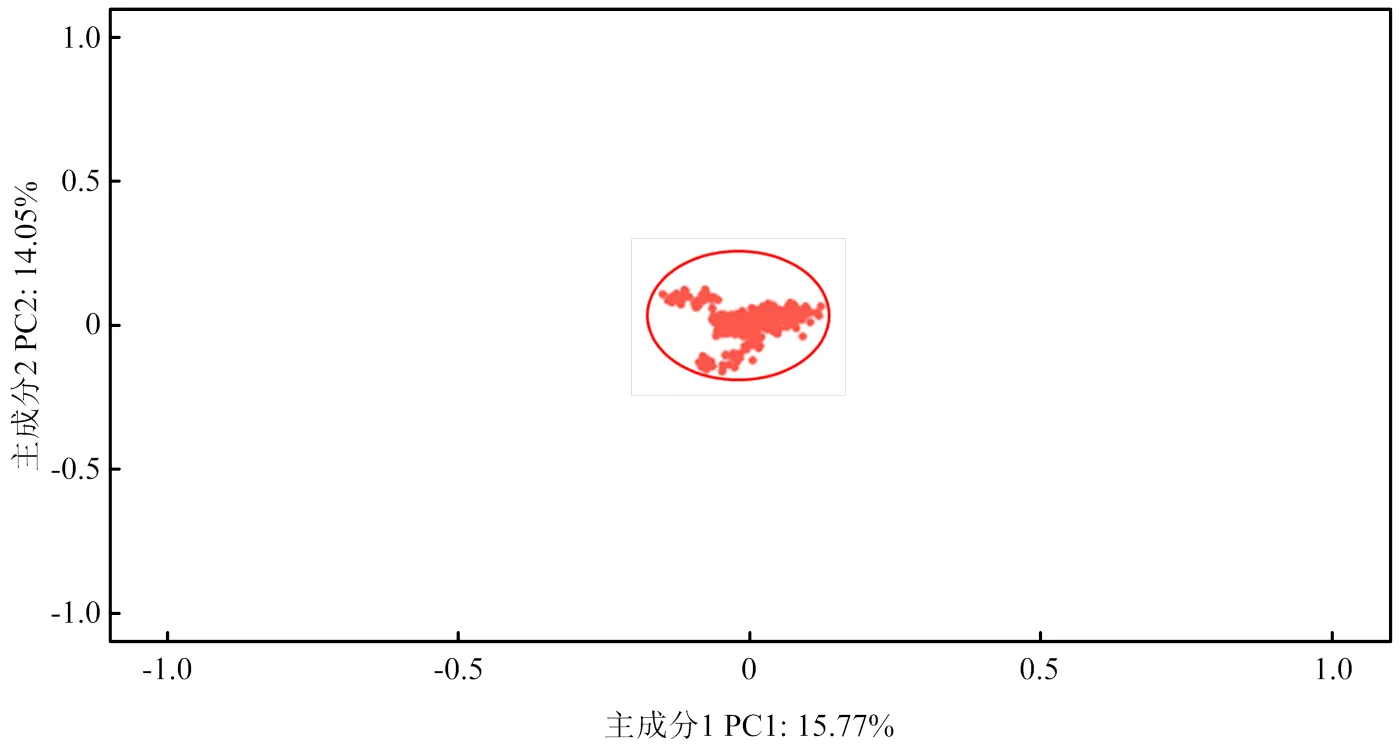
圖1 334頭蘇淮豬的PCA圖
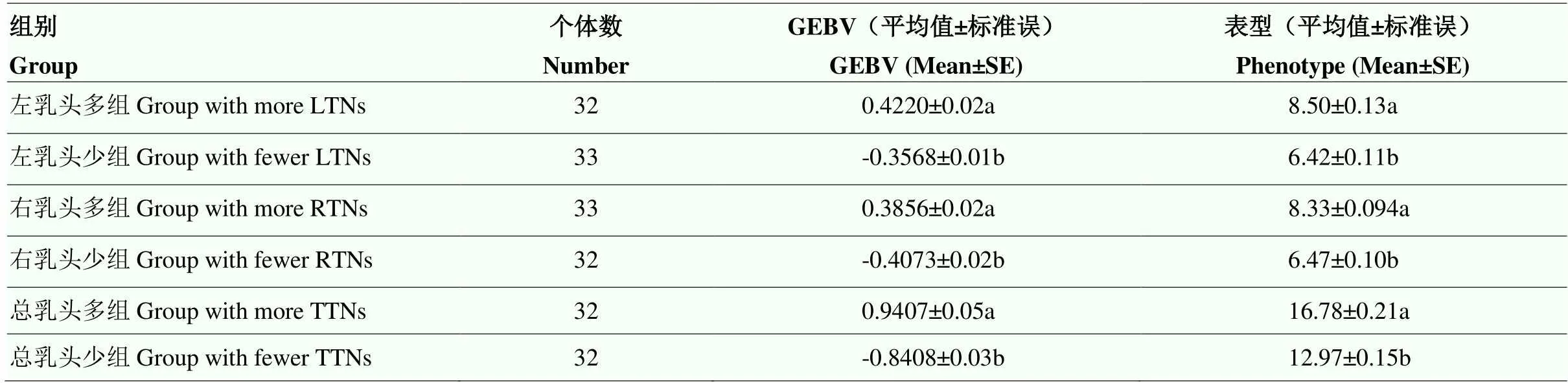
表4 極端乳頭數個體GEBV及表型分布
極端乳頭組間同列不同字母表示差異顯著
Different letters in the same column between groups with extreme teats indicated significant differences
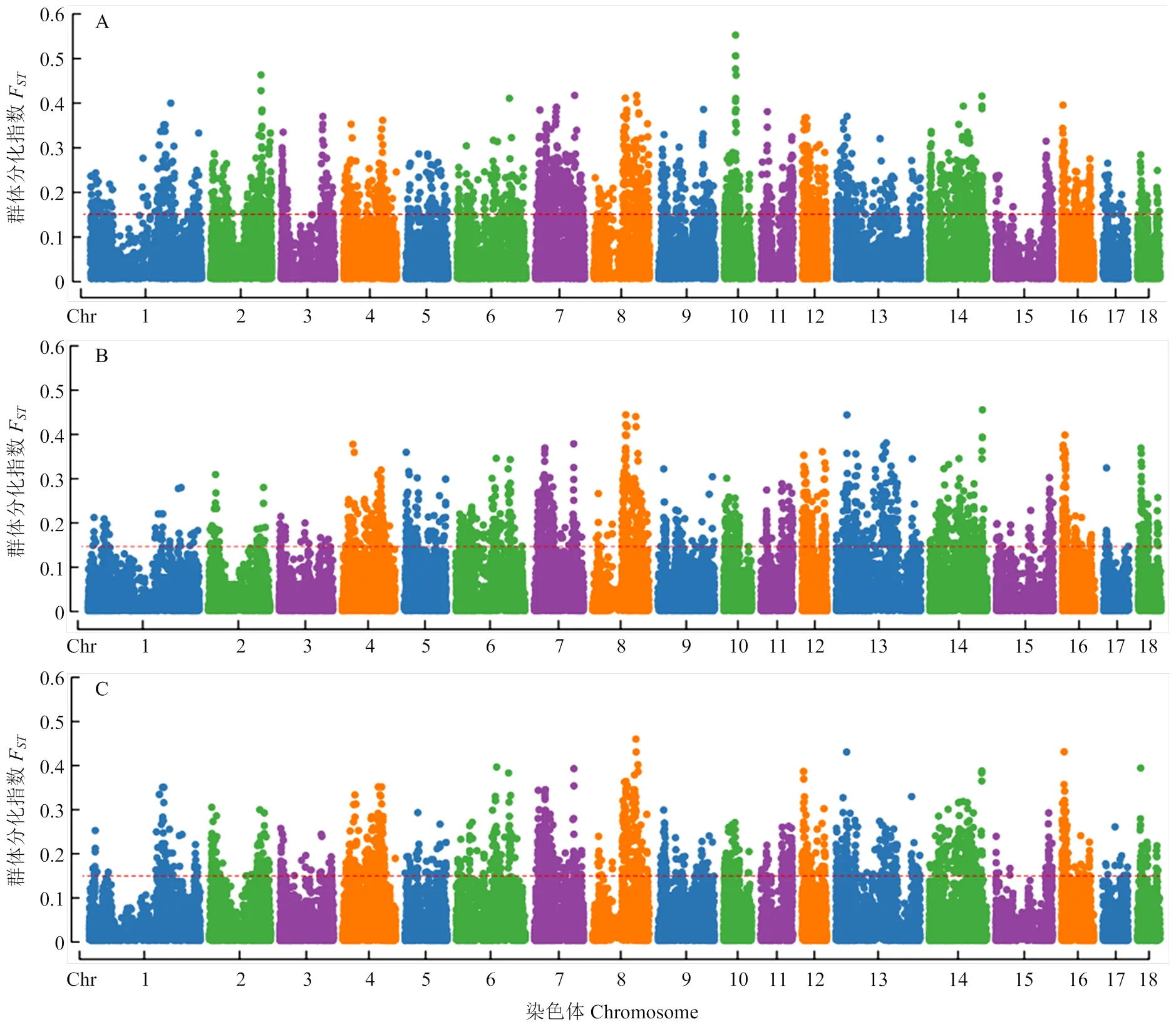
A:左乳頭;B:右乳頭;C:總乳頭。X軸為1-18號染色體,Y軸為FST值,紅色虛線代表閾值線
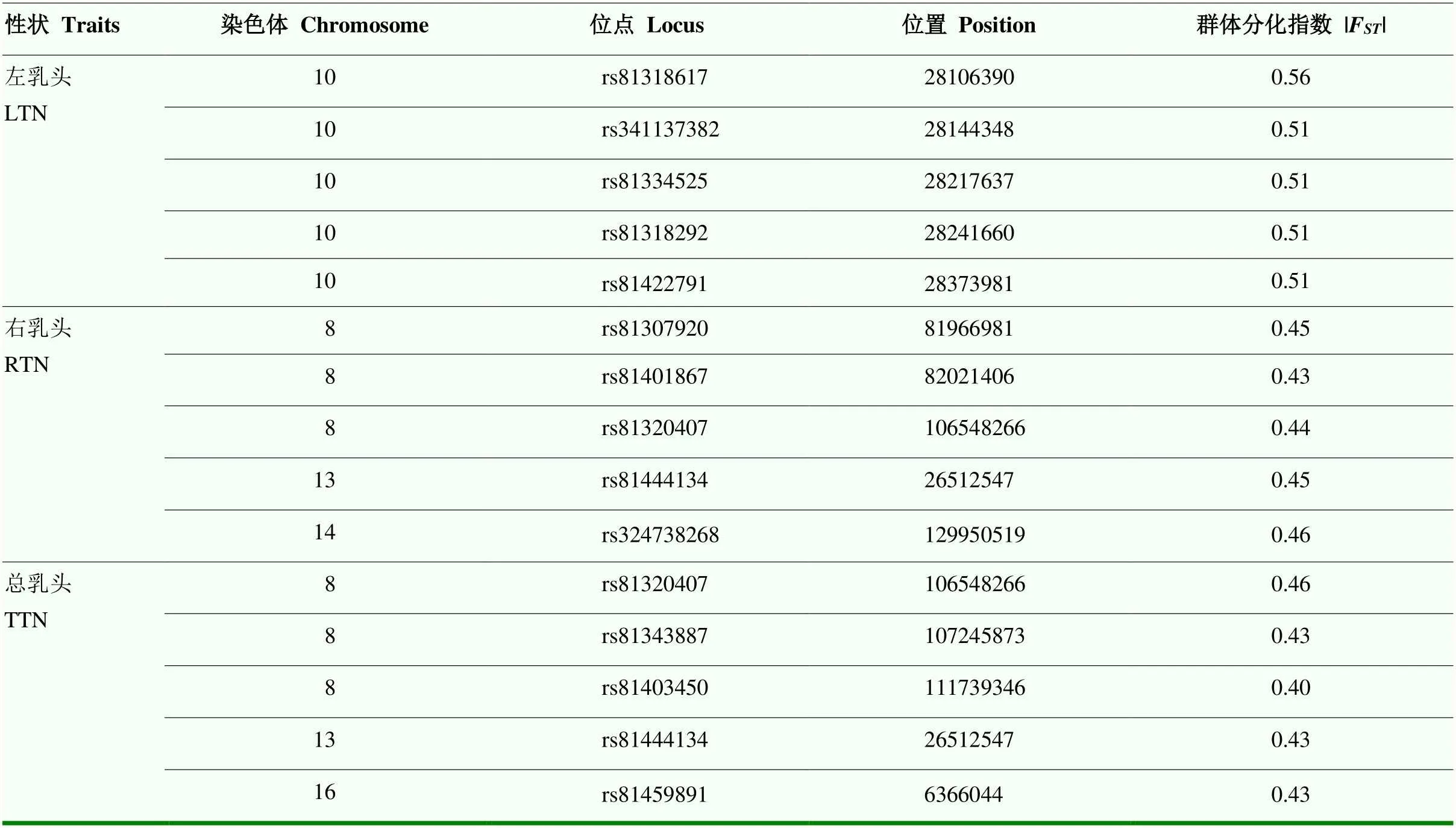
表5 蘇淮豬乳頭數FST值排名前五的位點
2.4 蘇淮豬試驗群體乳頭數GWAS分析
通過GWAS分析以更精確地定位影響乳頭數的位點。左、右、總乳頭數的GWAS分析的基因膨脹因子分別為1.07、1.179、1.035,并且Q-Q圖(圖3)中的觀測值和期望值沒有明顯的分離,說明不存在群體分層導致的膨脹現象。如表6和圖3所示,GWAS分析在SSC7、SSC13、SSC16、SSC18上鑒定到了22個與乳頭數顯著關聯的SNPs,其中16號染色體存在大量連續顯著的位點。顯著關聯的位點中,除了rs81315330 和rs319610259,剩余SNPs的F值均超過了F分析的閾值線。
將在極端乳頭數個體間高度分化且與乳頭數顯著關聯的20個位點認定為潛在地影響乳頭數的候選位點。在候選位點中,SSC13上的rs81444134以及SSC18上的rs81233299均為左乳頭的候選位點,均未在之前的研究中被報道,且分別解釋了6.16%和6.62%的表型方差。其中,rs81444134在右、總乳頭的F分析中的F值排名前五。SSC7上的rs80894106為總乳頭的候選位點,解釋了8.03%的表型方差。其余的左、右、總乳頭的候選位點集中位于SSC16的6.36—10.66 Mb區間內。LD分析顯示,SSC16上7.47—8.27 Mb內的7個候選SNPs形成了一個795 kb的單倍型塊(圖4),且其中的位點rs325271937(7.99 Mb)、rs343435106(8.04 Mb)、rs336743934(8.27 Mb)均位于cadherin 18()基因上。單倍型塊中的位點rs337606862(7.47 Mb,SSC16)在右、總乳頭的GWAS分析中均達到了全基因組顯著水平,且其右乳頭以及總乳頭的PVE分別為7.73%和7.57%。目前在QTL數據庫中,SSC16上的7.47—8.27 Mb區間沒有發現已報道的影響乳頭數的QTL,因此該區域可能是一個新的影響乳頭數的QTL,且rs337606862是一個重要的候選SNP。
2.5 候選基因注釋
SSC16上7.47—8.27 Mb的單倍型塊內包含了和cadherin 18()2個編碼蛋白的基因(圖4)。編碼一類鈣黏蛋白,與組織發育中細胞的識別、分選等有關,是潛在影響乳頭數的候選基因。SSC7上的rs80894106的上游28.35 kb處為,下游5.66 kb處為,其中為已報道的影響乳頭數的候選基因。距離rs81444134(SSC13)和rs81233299(SSC18)最近的編碼蛋白的基因分別為golgi associated kinase 1A(,38.9 kb)和taste 2 receptor member 3(,2.5 kb),暫未發現這兩個基因與乳頭發育有關。
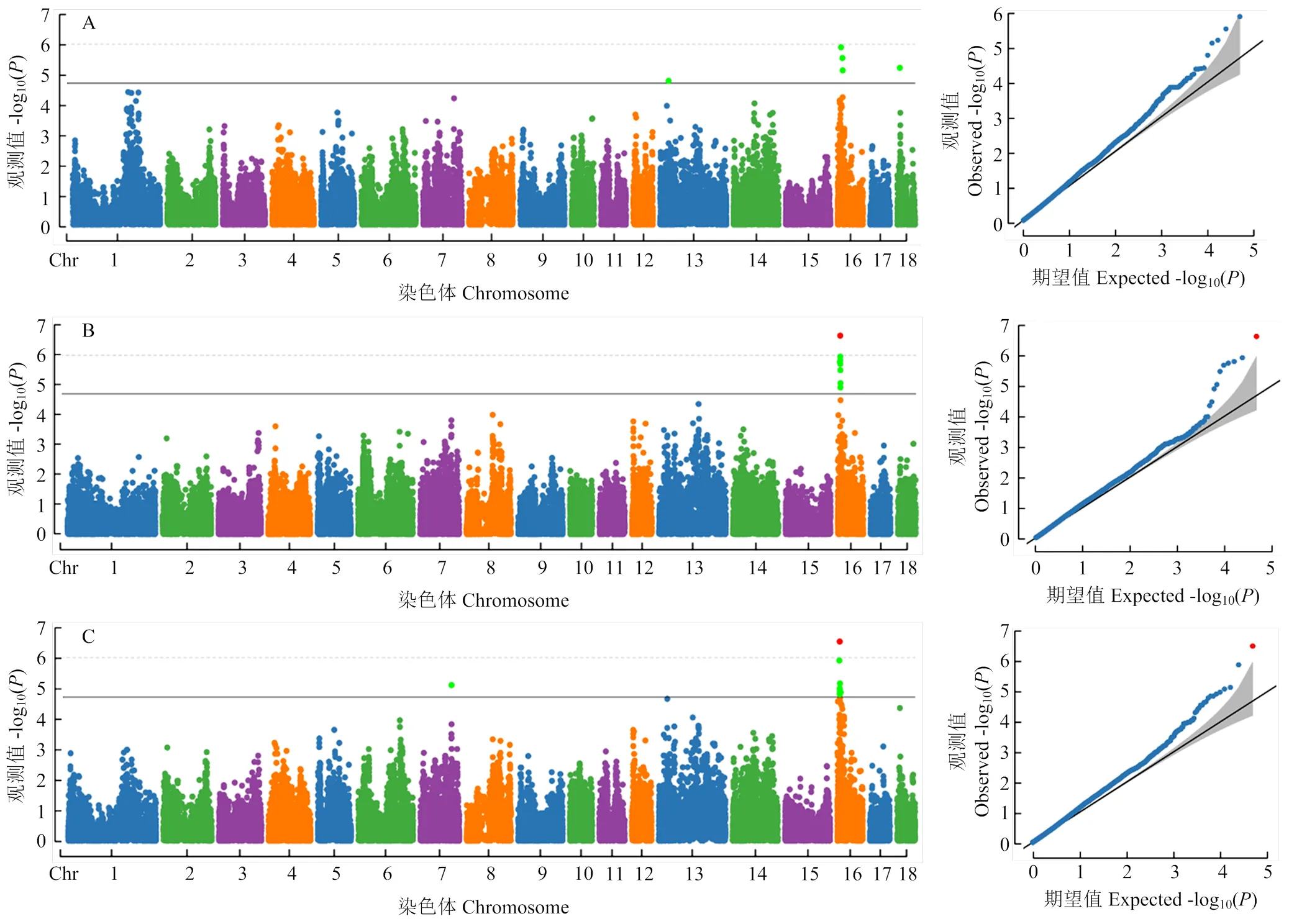
A:左乳頭;B:右乳頭;C:總乳頭。X軸為1-18號染色體,Y軸為-log10(P)。曼哈頓圖的實線和虛線分別代表染色體顯著閾值線及基因組顯著閾值線
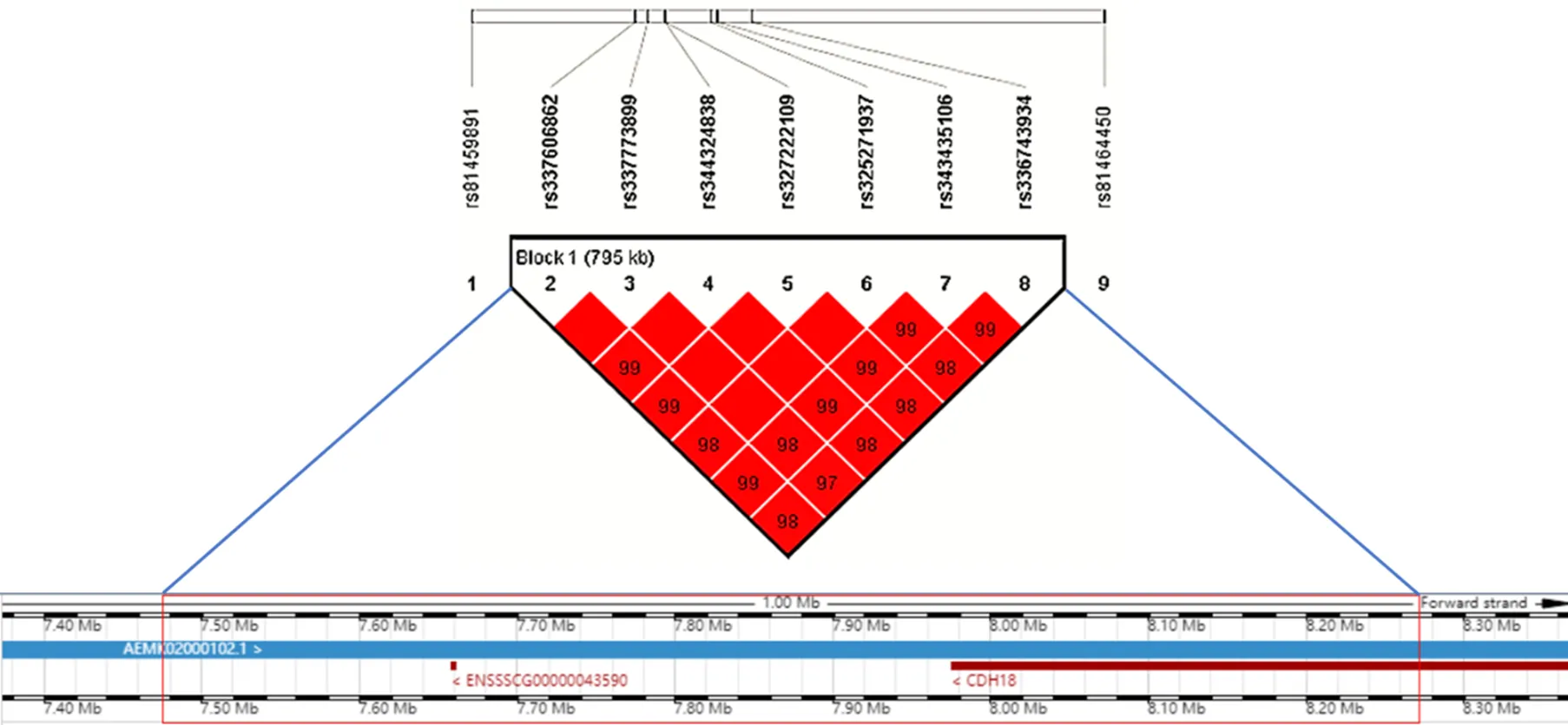
方格內的數字表示兩個SNP之間的D’值,深紅色意味著高的連鎖程度。共有兩個蛋白編碼基因位于795 kb的單倍型塊內
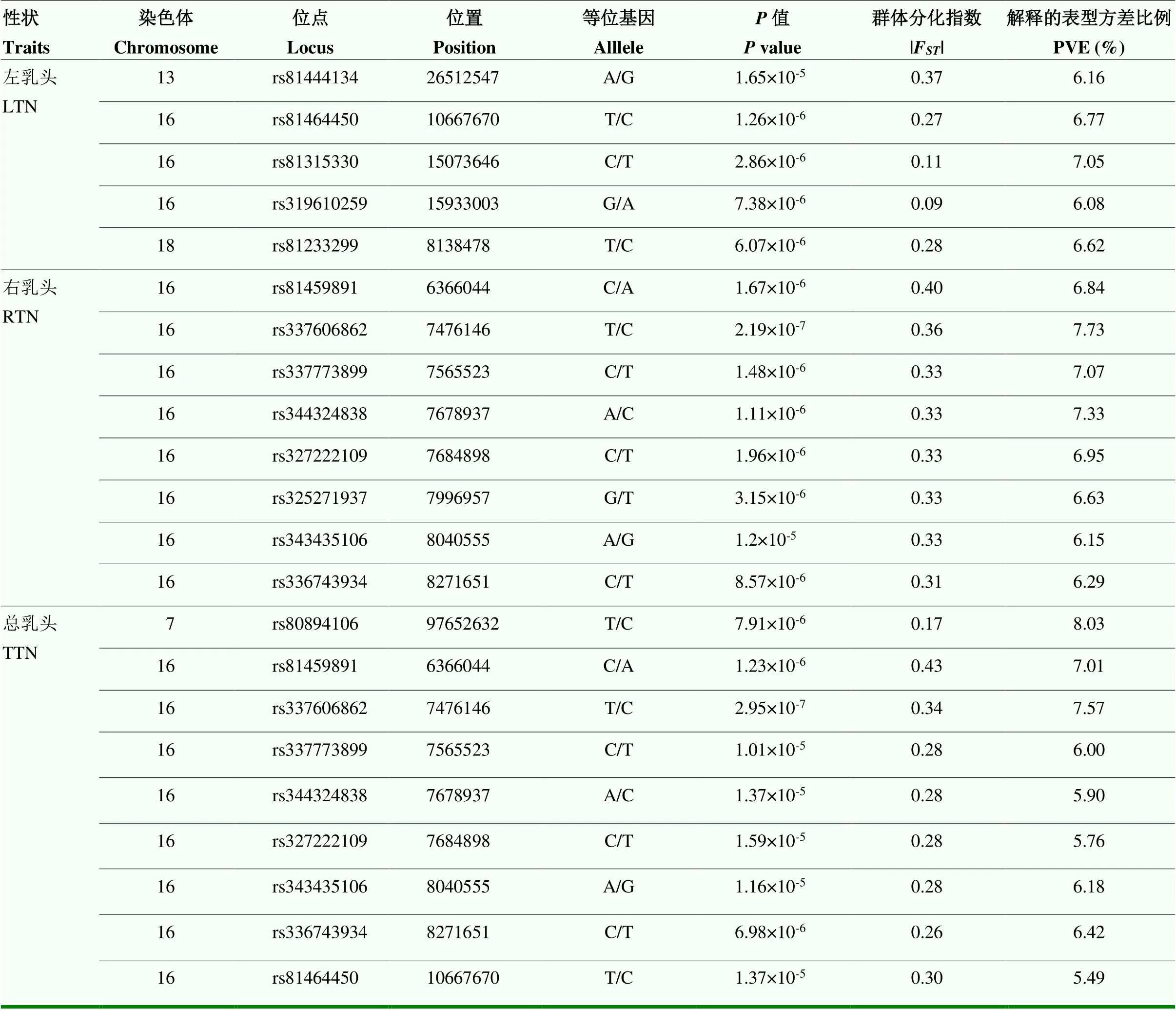
表6 蘇淮豬乳頭數GWAS鑒定的顯著位點的詳細信息
2.6 SSC7、SSC13、SSC16、SSC18上最顯著位點與蘇淮豬全部群體乳頭數關聯分析
選擇4條染色體上最顯著位點與709頭蘇淮豬的左、右、總乳頭數進行關聯分析。709頭蘇淮豬的左、右、總乳頭數的變異系數分別為8.58%、8.22%和7.34%(表7)。關聯分析結果如表8,4個位點均與左、右、總乳頭數顯著關聯(<0.05),說明F和GWAS分析鑒定的候選位點在樣本量更大的全部群體中仍然與乳頭數具有關聯性。因此,這4個位點可以作為分子標記用于蘇淮豬乳頭數的選育提升。
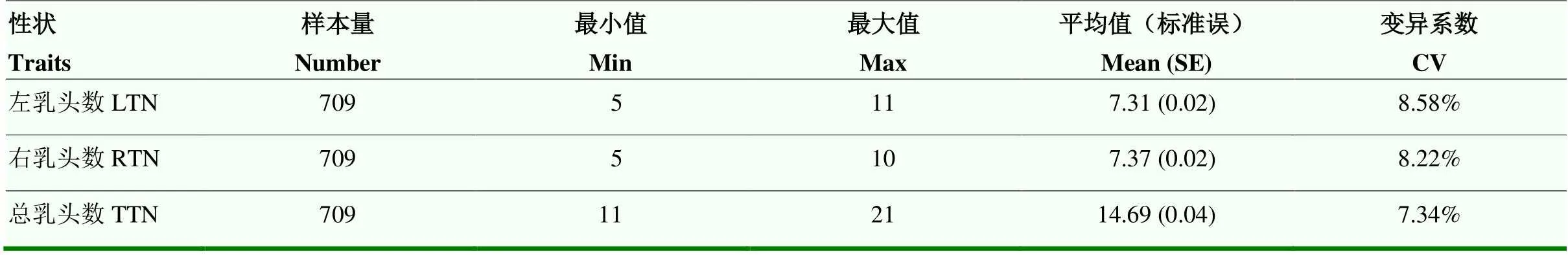
表7 709頭蘇淮豬乳頭數描述性統計
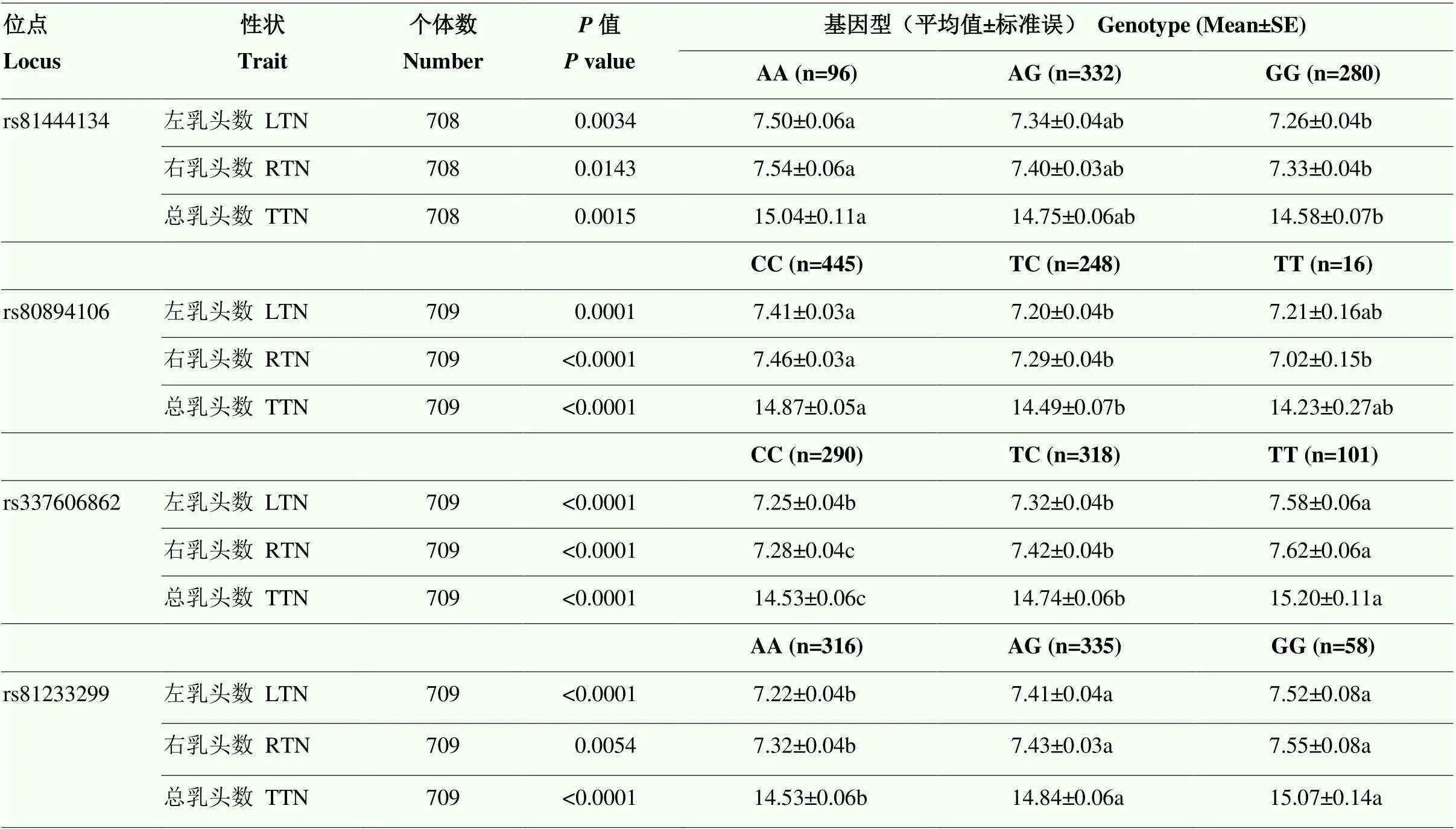
表8 4個位點與蘇淮豬全部群體乳頭數關聯分析
同行數字上標不同字母表示差異顯著(<0.05);rs81444134在80K芯片中有一個個體缺失,其有基因型的個體數為708頭
Different superscripts of numbers in the same line indicate significant differences; rs81444134 has one missing individual in 80K chip, and the number of genotyped individuals is 708
3 討論
3.1 蘇淮豬乳頭數變異統計及遺傳力估計
蘇淮豬是一個培育品種,群體內各性狀可能存在一定的變異。本研究統計的334頭蘇淮育肥豬以及全部群體的709頭蘇淮豬的左、右、總乳頭數的變異系數均超過了7%,這也證實了這一論述。周李生等[24]統計了中外豬種總乳頭數的分布情況,丹麥、英國、美國等豬種的乳頭集中在12—16個,中國豬種的乳頭分布在10—22個之間。本研究的蘇淮豬的總乳頭在11—21個之間,說明該群體是研究乳頭數變異機制的理想群體。在遺傳力估計上,多數研究估計的大白、長白、杜洛克豬的總乳頭數的遺傳力均在0.2—0.5之間[8, 25-26],與蘇淮豬遺傳力的結果相近。同時,LI等[8]估計的杜洛克豬的左乳頭(0.148)遺傳力低于右乳頭(0.177),這與蘇淮豬的結果一致。
3.2 影響蘇淮豬乳頭數QTL的鑒定
在實際的選種中,蘇淮豬育種者傾向選擇多乳頭的母豬留作種用,這種人工選擇作用會使得有利等位基因的頻率上升并在多乳頭的群體和少乳頭的群體之間產生基因頻率的差異。因此,期望通過F分析檢測極端乳頭數個體之間等位基因頻率差異顯著的位點。由于乳頭數的遺傳力中等,加上群體數量有限,因此結合育種值和表型值篩選極端乳頭的個體是較優的方法。同時,相較于僅依靠系譜信息的BLUP模型,基于基因組信息的GBLUP模型估計的育種值更準確[27],且廣泛應用于畜禽的育種中[28]。因此,本研究結合GEBV和表型值確定極端乳頭數的個體,而且統計發現本研究選擇的極端乳頭數組間的乳頭數GEBV和表型值均存在顯著差異,證明樣品選擇的合理性。F分析檢測到的高度分化的位點在18條常染色體上均有分布。由于F分析僅選擇了極端乳頭數的個體,群體量較小,檢測到的顯著分化的位點可能含有因抽樣誤差產生的假陽性的結果。因此,后續又開展了試驗群體的GWAS分析,并選定在F分析中高度分化且在GWAS分析中與乳頭數顯著關聯的位點為更可能的影響乳頭數的候選位點。
候選位點中,rs81444134(26.51 Mb,SSC13)和rs81233299(8.13 Mb,SSC18)均未在之前的研究中報道,是本研究新發現的乳頭數的候選位點。其中,rs81444134的F值在右、總乳頭的F分析中排名前五。rs81444134和rs81233299附近的基因為和,且Genecards數據庫顯示這兩個基因分別與高爾基體激酶以及味道受體有關,但其影響乳頭形成的功能有待進一步研究。在GWAS中,SSC7上97.65 Mb的候選位點rs80894106與總乳頭數顯著關聯,且與MOSCATELLI等[7]和LI等[8]的研究中報道的影響大白豬和杜洛克豬的總乳頭數的位點相一致。左、右、總乳頭的GWAS均在SSC16上出現連續的信號峰,且顯著信號集中在6.36—10.66 Mb。同時,3種乳頭數的F和GWAS分析在該區域均有一致的信號趨勢。本研究進一步對該區域進行LD分析,發現7.47—8.27 Mb區域內的候選SNPs之間高度連鎖,形成了一個795 kb的單倍型塊,而目前未有研究報道該單倍型區域與乳頭數相關。單倍型塊內的位點rs337606862與右乳頭和總乳頭均是最顯著關聯的,值分別為2.19×10-7和2.95×10-7。ZHUANG等[29]在加拿大杜洛克群體的GWAS中鑒定到SSC16上6.12 Mb處的總乳頭的QTL;BIDANEL等[30]使用梅山豬和大白豬的雜交群體鑒定的乳頭數的QTL位于SSC16的6.3—6.4 Mb處;這兩個QTLs分別距離本研究的7.47—8.27 Mb的單倍型塊約1.37 Mb和1.07 Mb遠。因此,SSC16上的7.47—8.27 Mb區域應是一個新的影響乳頭數的QTL,且位點rs337606862是QTL內具有較大效應的SNP。區域7.47—8.27 Mb包含了2個編碼蛋白的基因,其中的1個基因暫未有文獻研究,另外一個是一種鈣黏蛋白基因。生成Ⅱ型的鈣黏附素,在小鼠發育中的性腺細胞中高表達[31]。鈣黏附素在機體發育過程,包括胚胎期參與識別與分選不同種類的細胞,在組織形成中起到重要作用[32]。而豬的乳頭大概在胚胎期的23—26 d左右形成[33]。同時,鈣黏附素也可以調節細胞的增殖和凋亡活動[34]并且其功能的改變可能會導致乳腺癌的發生[35]。因此,推測是一個新的影響豬乳頭形成的候選基因,但該基因影響乳頭形成的機制還需要進一步研究。
為了進一步驗證試驗群體鑒定的乳頭數的候選位點的可靠性,本研究進一步選擇了包含試驗群體在內的共709頭蘇淮豬群體并進行了最顯著的SNPs:rs80894106(SSC7)、rs81444134(SSC13)、rs337606862(SSC16)、rs81233299(SSC18)的基因型與蘇淮豬群體乳頭數的關聯分析。結果表明,上述位點仍然與709頭蘇淮豬的乳頭數顯著關聯。盡管試驗群體使用了混合線性模型,而整個群體的關聯分析由于沒有足夠的親緣信息,沒有考慮隨機加性效應,但上述結果一定程度上驗證了4個最顯著位點與蘇淮豬乳頭數關聯的可靠性,可作為乳頭數選育的潛在分子標記。
4 結論
本研究發現蘇淮豬群體內乳頭數存在一定的變異,通過基因組F分析和GWAS分析,在蘇淮豬中鑒定到20個與乳頭數顯著相關的位點。其中,SSC13的26.51 Mb和SSC18的8.13 Mb是新的乳頭數的候選QTLs;SSC16的7.47—8.27 Mb區間存在連續與乳頭數顯著關聯的位點,是新發現的影響乳頭數的候選QTL區域,該區域內可能是新的影響豬乳頭形成的候選基因。
[1] ALEXOPOULOS J G, LINES D S, HALLETT S, PLUSH K J. A review of success factors for piglet fostering in lactation. Animals: an Open Access Journal from MDPI, 2018, 8(3): 38.
[2] KIM J S, JIN D I, LEE J H, SON D S, LEE S H, YI Y J, PARK C S. Effects of teat number on litter size in gilts. Animal Reproduction Science, 2005, 90(1/2): 111-116.
[3] ROHRER G A, NONNEMAN D J. Genetic analysis of teat number in pigs reveals some developmental pathways independent of vertebra number and several loci which only affect a specific side. Genetics, Selection, Evolution: GSE, 2017, 49(1): 4.
[4] WRIGHT S. The genetical structure of populations. Annals of Eugenics, 1951, 15(4): 323-354. doi:10.1111/j.1469-1809.1949. tb02451.x.
[5] HE L C, LI P H, MA X, SUI S P, GAO S, KIM S W, GU Y Q, HUANG Y, DING N S, HUANG R H. Identification of new single nucleotide polymorphisms affecting total number born and candidate genes related to ovulation rate in Chinese Erhualian pigs. Animal Genetics, 2017, 48(1): 48-54.
[6] 李開軍, 侯黎明, 蒲廣, 劉航, 劉根盛, 石傳宗, 金通, 周娟, 李平華, 黃瑞華. 基于全基因組Fst和nSL分析鑒別蘇淮豬中性洗滌纖維表觀消化率相關候選基因位點. 畜牧獸醫學報, 2021, 52(7): 1809-1819.
LI K J, HOU L M, PU G, LIU H, LIU G S, SHI C Z, JIN T, ZHOU J, LI P H, HUANG R H. Identification of candidate gene loci related to apparentdigestibility of suhuai pigs based on genome-wide fst and nSLAnalyses. Acta Veterinaria et Zootechnica Sinica, 2021, 52(7): 1809-1819. (in Chinese)
[7] MOSCATELLI G, DALL'OLIO S, BOVO S, SCHIAVO G, KAZEMI H, RIBANI A, ZAMBONELLI P, TINARELLI S, GALLO M, BERTOLINI F, FONTANESI L. Genome-wide association studies for the number of teats and teat asymmetry patterns in Large White pigs. Animal Genetics, 2020, 51(4): 595-600.
[8] LI Y, PU L, SHI L Y, GAO H D, ZHANG P F, WANG L X, ZHAO F P. Revealing new candidate genes for teat number relevant traits in duroc pigs using genome-wide association studies. Animals: an Open Access Journal from MDPI, 2021, 11(3): 806.
[9] TANG J H, ZHANG Z Y, YANG B, GUO Y M, AI H S, LONG Y, SU Y, CUI L L, ZHOU L Y, WANG X P, ZHANG H, WANG C B, REN J, HUANG L S, DING N S. Identification of loci affecting teat number by genome-wide association studies on three pig populations. Asian-Australasian Journal of Animal Sciences, 2017, 30(1): 1-7.
[10] ZHOU L, ZHAO W, FU Y, FANG X, REN S, REN J. Genome-wide detection of genetic loci and candidate genes for teat number and body conformation traits at birth in Chinese Sushan pigs. Animal Genetics, 2019, 50(6): 753-756.
[11] WANG, LI, ZHOU, GAO, LIU, LI, NIU, ZHANG, LI, ZHOU, HUANG. Association of twelve candidate gene polymorphisms with the intramuscular fat content and average backfat thickness of Chinese suhuai pigs. Animals, 2019, 9(11): 858.
[12] PURCELL S, NEALE B, TODD-BROWN K, THOMAS L, FERREIRA M A R, BENDER D, MALLER J, SKLAR P, DE BAKKER P I W, DALY M J, SHAM P C. PLINK: a tool set for whole-genome association and population-based linkage analyses. American Journal of Human Genetics, 2007, 81(3): 559-575.
[13] MADSEN P, JENSEN J. A user’s guide to DMU. A package for analysing multivariate mixed models version, 2013, 6: 1-33.
[14] VANRADEN P M. Efficient methods to compute genomic predictions. Journal of Dairy Science, 2008, 91(11): 4414-4423.
[15] WEIR B S, COCKERHAM C C. Estimating f-statistics for the analysis of population structure. Evolution; International Journal of Organic Evolution, 1984, 38(6): 1358-1370.
[16] DANECEK P, AUTON A, ABECASIS G, ALBERS C A, BANKS E, DEPRISTO M A, HANDSAKER R E, LUNTER G, MARTH G T, SHERRY S T, MCVEAN G, DURBIN R, GENOMES PROJECT ANALYSIS GROUP 1 0 0 0. The variant call format and VCFtools. Bioinformatics (Oxford, England), 2011, 27(15): 2156-2158.
[17] SPEED D, HEMANI G, JOHNSON M R, BALDING D J. Improved heritability estimation from genome-wide SNPs. The American Journal of Human Genetics, 2012, 91(6): 1011-1021.
[18] YANG Q, CUI J, CHAZARO I, CUPPLES L A, DEMISSIE S. Power and type I error rate of false discovery rate approaches in genome- wide association studies. BMC Genetics, 2005, 6(Suppl. 1): S134.
[19] YE S P, CHEN Z T, ZHENG R R, DIAO S Q, TENG J Y, YUAN X L, ZHANG H, CHEN Z M, ZHANG X Q, LI J Q, ZHANG Z. New insights from imputed whole-genome sequence-based genome-wide association analysis and transcriptome analysis: the genetic mechanisms underlying residual feed intake in chickens. Frontiers in Genetics, 2020, 11: 243.
[20] SCHMID M, MAUSHAMMER M, PREU? S, BENNEWITZ J. Mapping QTL for production traits in segregating Piétrain pig populations using genome-wide association study results of F2crosses. Animal Genetics, 2018, 49(4): 317-320.
[21] YIN L L, ZHANG H H, TANG Z S, XU J Y, YIN D, ZHANG Z W, YUAN X H, ZHU M J, ZHAO S H, LI X Y, LIU X L. rMVP: a memory-efficient, visualization-enhanced, and parallel-accelerated tool for genome-wide association study. Genomics, Proteomics & Bioinformatics, 2021, 19(4): 619-628.
[22] BARRETT J C, FRY B, MALLER J, DALY M J. Haploview: analysis and visualization of LD and haplotype maps. Bioinformatics, 2004, 21(2): 263-265.
[23] ZHANG T Y, GAO H D, SAHANA G, ZAN Y J, FAN H Y, LIU J X, SHI L Y, WANG H W, DU L X, WANG L X, ZHAO F P. Genome-wide association studies revealed candidate genes for tail fat deposition and body size in the Hulun Buir sheep. Journal of Animal Breeding and Genetics = Zeitschrift Fur Tierzuchtung Und Zuchtungsbiologie, 2019, 136(5): 362-370.
[24] 周李生, 趙為民, 涂楓, 吳云鶴, 任守文, 方曉敏. 豬乳頭性狀生理學和遺傳學研究進展. 遺傳, 2019, 41(5): 384-390.
ZHOU L S, ZHAO W M, TU F, WU Y H, REN S W, FANG X M. Physiology and genetics research progress of teat traits in pigs. Hereditas, 2019, 41(5): 384-390. (in Chinese)
[25] SON M V, LOPES M S, MARTELL H J, DERKS M F L, GANGSEI L E, KONGSRO J, WASS M N, GRINDFLEK E H, HARLIZIUS B. A QTL for number of teats shows breed specific effects on number of vertebrae in pigs: bridging the gap between molecular and quantitative genetics. Frontiers in Genetics, 2019, 10: 272.
[26] TAN C, WU Z F, REN J L, HUANG Z L, LIU D W, HE X Y, PRAKAPENKA D, ZHANG R, LI N, DA Y, HU X X. Genome-wide association study and accuracy of genomic prediction for teat number in Duroc pigs using genotyping-by-sequencing. Genetics, Selection, Evolution: GSE, 2017, 49(1): 35.
[27] 李晶, 王杰, 康慧敏, 劉冉冉, 李華, 趙桂蘋. 基于BLUP和GBLUP方法估計北京油雞胴體和肉質性狀遺傳參數的差異. 畜牧獸醫學報, 2020, 51(1): 35-42.
LI J, WANG J, KANG H M, LIU R R, LI H, ZHAO G P. The difference of genetic parameters for carcass and meat quality traits by BLUP and GBLUP methods in Beijing You chicken. Acta Veterinaria et Zootechnica Sinica, 2020, 51(1): 35-42. (in Chinese)
[28] 朱墨, 鄭麥青, 崔煥先, 趙桂蘋, 劉楊. 基于GBLUP和BayesB方法對肉雞屠宰性狀基因組預測準確性的比較. 中國農業科學, 2021, 54(23): 5125-5131. doi: 10.3864/j.issn.0578-1752.2021.23.016.
ZHU M, ZHENG M Q, CUI H X, ZHAO G P, LIU Y. Comparison of genomic prediction accuracy for meat type chicken carcass traits based on GBLUP and BayesB method. Scientia Agricultura Sinica, 2021, 54(23): 5125-5131. doi: 10.3864/j.issn.0578-1752.2021.23.016. (in Chinese)
[29] ZHUANG Z W, DING R R, PENG L L, WU J, YE Y, ZHOU S P, WANG X W, QUAN J P, ZHENG E Q, CAI G Y, HUANG W, YANG J, WU Z F. Genome-wide association analyses identify known and novel loci for teat number in Duroc pigs using single-locus and multi-locus models. BMC Genomics, 2020, 21: 344.
[30] BIDANEL J P, ROSENDO A, IANNUCCELLI N, RIQUET J, GILBERT H, CARITEZ J C, BILLON Y, AMIGUES Y, PRUNIER A, MILAN D. Detection of quantitative trait loci for teat number and female reproductive traits in Meishan × Large White F2pigs. Animal, 2008, 2(6): 813-820.
[31] PIPREK R P, KOLASA M, PODKOWA D, KLOC M, KUBIAK J Z. Cell adhesion molecules expression pattern indicates that somatic cells arbitrate gonadal sex of differentiating bipotential fetal mouse gonad. Mechanisms of Development, 2017, 147: 17-27.
[32] HALBLEIB J M, NELSON W J. Cadherins in development: cell adhesion, sorting, and tissue morphogenesis. Genes & Development, 2006, 20(23): 3199-3214.
[33] ROBINSON G W. Cooperation of signalling pathways in embryonic mammary gland development. Nature Reviews Genetics, 2007, 8(12): 963-972.
[34] PIPREK R P, KLOC M, MIZIA P, KUBIAK J Z. The central role of cadherins in gonad development, reproduction, and fertility. International Journal of Molecular Sciences, 2020, 21(21): 8264.
[35] ASHAIE M A, CHOWDHURY E H. Cadherins: the superfamily critically involved in breast cancer. Current Pharmaceutical Design, 2016, 22(5): 616-638.
Identifying Quantitative Trait Loci Associated with Teat Number of Pig by Genomic Analysis

1Institute of Swine Science, Nanjing Agricultural University, Nanjing 210095;2Huaian Academy, Nanjing Agricultural University, Huai’an 223001, Jiangsu;3Huaiyin Xinhuai Pig Breeding Farm of Huai’an City, Huai’an 223322, Jiangsu
【Objective】The purposes of this study were to analyze the variation of teat number, to explore the quantitative trait locus (QTL) and candidate genes related to teat number, and to provide important molecular markers for the breeding of pig teat number.【Method】This study accurately measured left, right, total teat number of 709 Suhuai pigs (335 fattening pigs and 374 breeding pigs). Fattening pigs were selected for 80K chip genotyping and the heritability and genomic estimated breeding value (GEBV) of left, right and total teat number were calculated by chip data. Based on the rank of GEBV and phenotype of teat number, the top 10% individuals and the bottom 10% individuals were selected for Fixation Index (F) analysis to detect highly differentiated loci. Then, the loci associated with teat number were identified by genome wide association analysis (GWAS) and loci which were highly differentiated and significantly associated with teat number were selected as candidate loci.Genes located near candidate loci and related to teat number after functional annotation were selected as candidate genes.Finally,the association analyses between the most significant candidate loci on each chromosome and teat number of 709 Suhuai pigs were performed to verify the significance of the above loci.【Result】The variation coefficients of left, right and total teat number of Suhuai fattening pigs were 10.20%, 9.26% and 8.50%, respectively, and the heritability were 0.212, 0.257 and 0.312, respectively. Based onFand GWAS analyses, a total of 20 candidate loci onchromosomes (SSC) 7, 13, 16 and 18 for teat number were identified and these candidate loci could explain 5.49%-8.03% of the phenotypic variance. Among them, locus rs80894106 on SSC7 associated with total teat number was consistent with the reported candidate locus of total teat number based on Large white and Duroc pig populations, but candidate loci rs81444134 (26.51 Mb, SSC13) and rs81233299 (8.13 Mb, SSC18) of left teat number were newly discovered loci related to teat number. Interestingly, candidate loci of left, right and total teat number were mainly concentrated in the 6.36-10.66 Mb interval on SSC16;Linkage disequilibrium (LD) analysis found that candidateloci in 7.47-8.27 Mb interval fit into a 795 kb haplotype block, andthis haplotype block was a newly discovered candidate area that affected teat number;rs337606862 (7.47 Mb) in the haplotype block was the most significantly SNP associated with the left and total teat number, and three loci in the haplotype block were all located on the intron of cadherin 18 () gene;gene encoded type II cadherin, and cadherin was related to the identification, sorting, proliferation, apoptosis of cells in developing tissue and the occurrence of breast cancer. Thus,might be a new candidate gene that affected pig teat number.In addition, the most significant loci rs81444134, rs80894106, rs337606862 and rs81233299 on 4 chromosomes were genotyped in 709 Suhuai pigs in this study. After association analysis, these loci were significantly associated with teat number, and could be used as potential molecular markers for the selection of teat number.【Conclusion】In this study, 20 loci significantly related to teat number were identified in Suhuai pig population by genome analysis. Among them, 26.51 Mb on SSC13 and 8.13 Mb on SSC18 were new candidate QTLs for teat number. The 7.47-8.27 Mb on SSC16 was also a newly discovered candidate QTL for teat number, andgene in this interval might be a new candidate gene that affected the formation of pig teat.
F; GWAS; QTL; Suhuai pig; teat number; candidate genes

10.3864/j.issn.0578-1752.2023.10.014
2021-12-17;
2022-01-19
國家自然科學基金-河南聯合基金項目(U1904115)、江蘇現代農業(生豬)產業技術體系建設項目(JATS[2020]399)、農業農村部農業品種改良提升專項(19210387)、江蘇省農業新品種創制重點項目(PZCZ201732)
尹彥鎮,Tel:13851711578;E-mail:2019105013@njau.edu.cn。通信作者李平華,E-mail:lipinghua718@njau.edu.cn。通信作者黃瑞華,E-mail:rhhuang@njau.edu.cn
(責任編輯 林鑒非)

