PLA2R1相關膜性腎病患者血漿差異表達多肽的鑒定
王亞捷 祖白玲 甘辰欣 武嬌祥 殳 潔杭 晨 陳明暉 林芙君 胡志剛 黃 飚 盛慧明
(1.上海交通大學醫學院附屬同仁醫院檢驗科,上海 200050;2.上海交通大學醫學院附屬新華醫院腎臟風濕免疫科,上海 200092;3.江南大學無錫醫學院附屬無錫兒童醫院,江蘇 無錫 214023;4.浙江理工大學生命科學與醫藥學院,浙江 杭州 310018)
原發性膜性腎病(primary membranous nephropathy,PMN)是一種器官特異性自身免疫性疾病,臨床表現為無癥狀蛋白尿和水腫,病理特征為腎小球上皮下免疫復合物沉積伴基底膜彌漫性增厚。有一項大型多中心回顧性研究調查了2004—2014年我國71 151例行腎穿刺的患者,結果顯示,在11年間,中國人群中膜性腎病的發病風險每年增加13%[1-2]。PMN的臨床預后差異較大,在未經治療的患者中,約有1/3病情可自行緩解,有1/3在10年內會進展為終末期腎病(end-stage renal disease,ESRD)。有學者利用激光顯微解剖和質譜技術對PMN患者的腎臟活體組織樣本進行研究,確定了主要的PMN相關抗原為M型磷脂酶A2受體(M-type phospholipase A2 receptor,PLA2R1)、血小板反應蛋白結構域7A(thrombospondin type-1 domain 7A,THSD7A)、中性肽鏈內切酶(neutral endopeptidase,NEP)、內皮素(exostosin,EXT)1和EXT2[3-4]。新的蛋白和潛在抗原的發現極大地推動了臨床對PMN的認知和診斷、治療的發展。相對于腎臟活體組織樣本,外周血樣本具有更易獲取且無創的優勢,但目前對PMN外周血中活性小分子蛋白的研究很少[5]。因此,探討外周血血漿中新的小分子蛋白及其功能對PMN的診斷和治療意義較大。PLA2R1是PMN患者最主要的內源性抗原,有70%~80%的PMN患者體內可檢測到PLA2R1抗體,而在其他腎小球腎炎或繼發性腎小球疾病患者體內則檢測不到PLA2R1抗體,提示PLA2R1對PMN有高度特異性[6]。有學者建議,在有PLA2R1抗體存在的情況下,除非懷疑患有其他疾病,否則不需要進行腎臟活體組織檢查[7]。因此,本研究采用納升級高效液相色譜串聯質譜(nano-high performance liquid chromatography tandem mass spectrometry,nano-HPLC-MS/MS)檢測PLA2R1抗體陽性的PMN患者血漿中相對分子質量低于3 000的小分子蛋白,分析PMN患者與健康對照者之間差異表達的小分子多肽,篩選可能參與PMN發生的小分子蛋白,尋找具有生物學意義的多肽標志物,為篩選潛在藥物治療靶點奠定基礎。
1 材料和方法
1.1 研究對象
選取2020年5月—2021年12月上海交通大學醫學院附屬同仁醫院首次接受腎臟活體組織檢查并被確診為PMN的患者28例(PMN組),其中男20例、女8例,年齡37~75歲。所有患者腎小球PLA2R1抗體陽性,排除其他自身免疫性疾病、感染、惡性腫瘤和藥物所致的并發癥等患者。選取同期上海交通大學醫學院附屬同仁醫院健康體檢者28名(正常對照組),其中男20名、女8名,年齡31~79歲,排除腎功能異常等可能患有腎臟疾病者。2個組之間年齡和性別差異均無統計學意義(P>0.05)。本研究經上海交通大學醫學院附屬同仁醫院倫理委員會批準(2021-017-01),所有研究對象均知情同意。
1.2 方法
1.2.1 樣本采集和處理
采集所有研究對象靜脈血2 mL,乙二胺四乙酸二鉀抗凝,離心分離血漿。
1.2.2 血漿PLA2R1相關抗體和補體檢測
采用時間分辨熒光免疫分析法檢測血漿抗PLA2R1-IgG抗體和抗PLA2R1-IgG4抗體滴度,試劑盒購自浙江博實生物科技有限公司。血漿抗 PLA2R1-IgG抗體滴度≥14.00 RU/mL、抗PLA2R1-IgG4抗體滴度≥200.00 ng/mL為陽性。采用ADVIA-2400全自動生化分析儀和配套試劑(德國西門子公司)檢測血漿C3、C4水平。
1.2.3 多肽提取
取500 μL血漿,與甲醇按1∶2渦旋混勻,4 ℃沉淀1 h,每10 min旋轉混勻1次。4 ℃12 000×g離心20 min,收集上清液,采用SAVANT SPD1010冷凍離心濃縮儀(美國ThermoFisher Scientific公司)冷凍抽干,用磷酸鹽緩沖液復溶,經3KD超濾管過濾后收集濾液。用去污劑去除試劑盒(美國ThermoFisher Scientific公司)去除聚乙二醇污染,經C18固相萃取柱脫鹽后冷凍干燥。
1.2.4 nano-HPLC-MS/MS鑒定
將凍干的多肽樣本溶于0.1%甲酸水溶液中,采用nano-HPLC-MS/MS檢測。檢測系統為EASY-nano LC 1200液相色譜系統+Q Exactive質譜儀(美國ThermoFisher Scientific公司)。上樣量為10 μL,分析柱為德國Dr Maisch公司Acclaim PepMap C18柱(75 μm×25 cm),以60 min的梯度分離樣本(0~4 min以4%B相平衡;4~46 min,B相以非線性梯度升高到60%;46~50 min,B相升高到100%,維持10 min),柱流量為0.6 μL/min,柱溫為55 °C。
1.2.5 數據分析
采用PEAKS Studio 10.6軟件(加拿大Bioinformatics Solutions公司)對原始文件數據進行分析。采用PEAKS Studio 10.6軟件中基于數據庫的搜索鑒定算法對GDP21080373數據庫進行檢索,檢索參數:碎片離子質量容許誤差為0.02,母離子質量容許誤差為0.007‰,可變修飾為Oxidation(M) 15.99、Acetylation(Protein N-term)42.01、Deamidation(NQ)0.98。按1%錯誤發現率(false discovery rate,FDR)過濾質譜圖/肽段,獲得鑒定后的質譜圖和肽段列表,然后在蛋白水平上以1%FDR和1 unique peptide再次進行質控過濾,最后基于特異譜峰面積強度進行半定量。差異蛋白篩選標準:對數據進行單因素方差分析(One way ANOVA),取|fold change|>1.2、P<0.05的差異蛋白。
1.3 生物信息學分析
在線獲取多肽等電點(isoelectric point,PI)和相對分子質量信息(https://web.expasy.org/protparam/)。利用UniProt數據庫(http://www.uniprot.org/)尋找差異多肽的來源。使用Blast2GO 5軟件進行功能注釋,采用GOATOOLS軟件對差異多肽進行基因本體(gene ontology,GO)富集,采用David BioInformation Resources 6.8軟件(https://david.ncifcrf.gov/)進行京都基因與基因組數據庫(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析。
1.4 差異表達多肽的驗證
利用差異表達多肽標準工作液在AB Sciex QTRAP 6500 LC-MS/MS系統中篩選并建立定量檢測的多重反應監測離子對信息,調整DP和CE參數。采用不同質量濃度的差異表達多肽標準工作液建立標準曲線(r2>0.99)。采用蛋白沉淀法提取多肽,將預冷的甲醇與血漿混勻,4 ℃14 000×g離心10 min,取上清,提取多肽。采用液相色譜串聯質譜(liquid chromatography tandem mass spectrometry,LC-MS/MS)檢測處理后的樣本,色譜柱為Acclaim PepMap C18柱(德國Dr Maisch公司)。根據標準曲線對PMN組和正常對照組外周血中目標差異肽段的信號進行定量。
1.5 統計學方法
采用SPSS 22.0 軟件進行統計分析。符合正態分布的計量資料以±s表示,組間比較采用獨立樣本t檢驗。采用Spearman相關分析評估PMN患者血漿C4b與抗PLA2R1-IgG抗體的相關性。以P<0.05為差異有統計學意義。
2 結果
2.1 PMN組和正常對照組血漿相關抗體和補體水平比較
PMN組血漿抗PLA2R1-IgG抗體和抗PLA2R1-IgG4抗體陽性率為100%,正常對照組均為陰性。PMN組與正常對照組血漿C3、C4水平差異均無統計學意義(P>0.05)。見表1。

表1 PMN組和正常對照組血漿C3、C4和抗體水平比較
2.2 PMN組和正常對照組血漿差異表達多肽分析
采用nano-HPLC-MS/MS檢出903條多肽,有31條多肽在PMN組和正常對照組中呈差異表達(P<0.05,|fold change|>1.2),其中表達下調15條、表達上調16條。所有差異表達多肽及其前體蛋白見表2、表3。
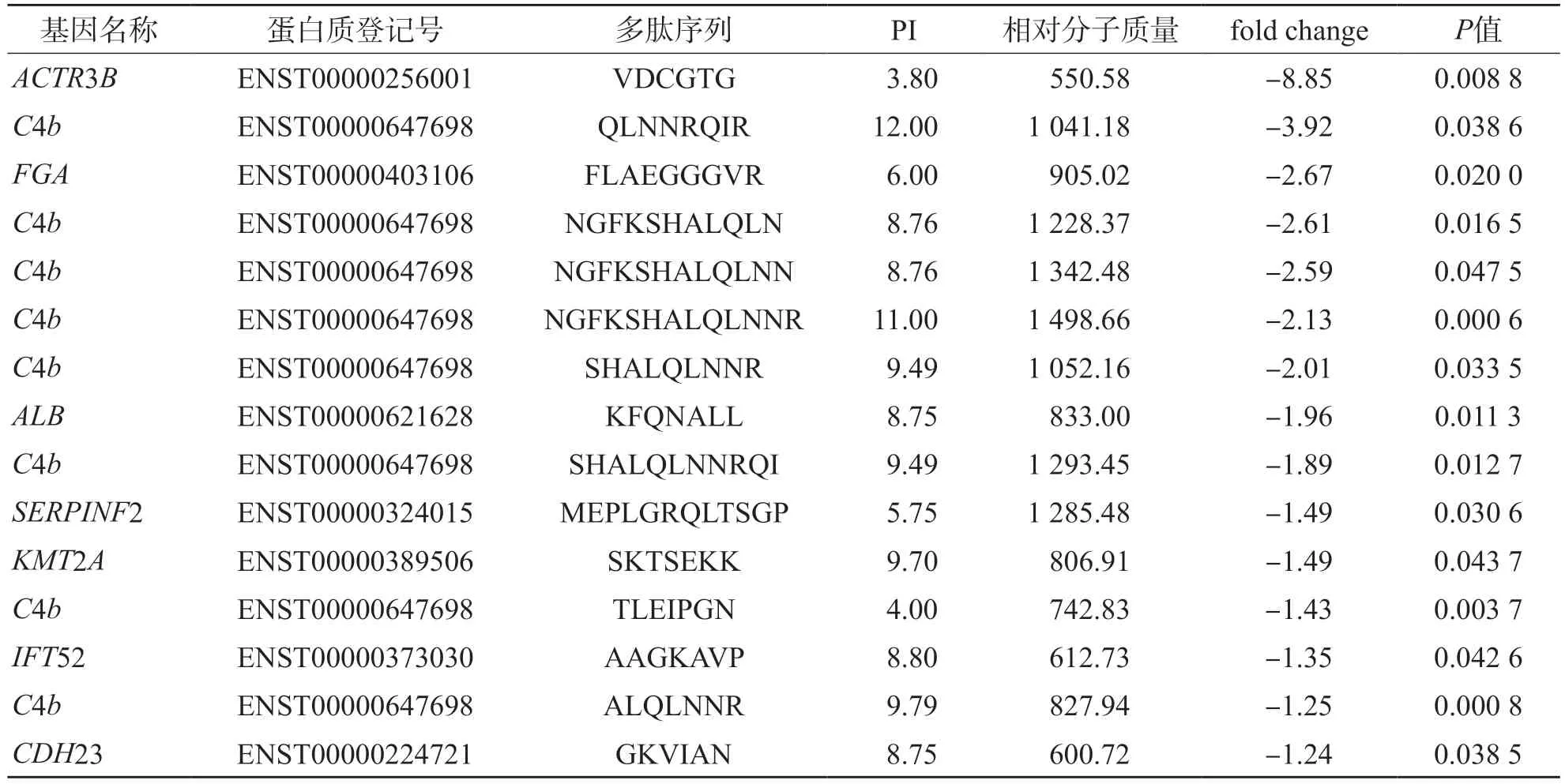
表2 PMN組較正常對照組表達下調的差異表達多肽
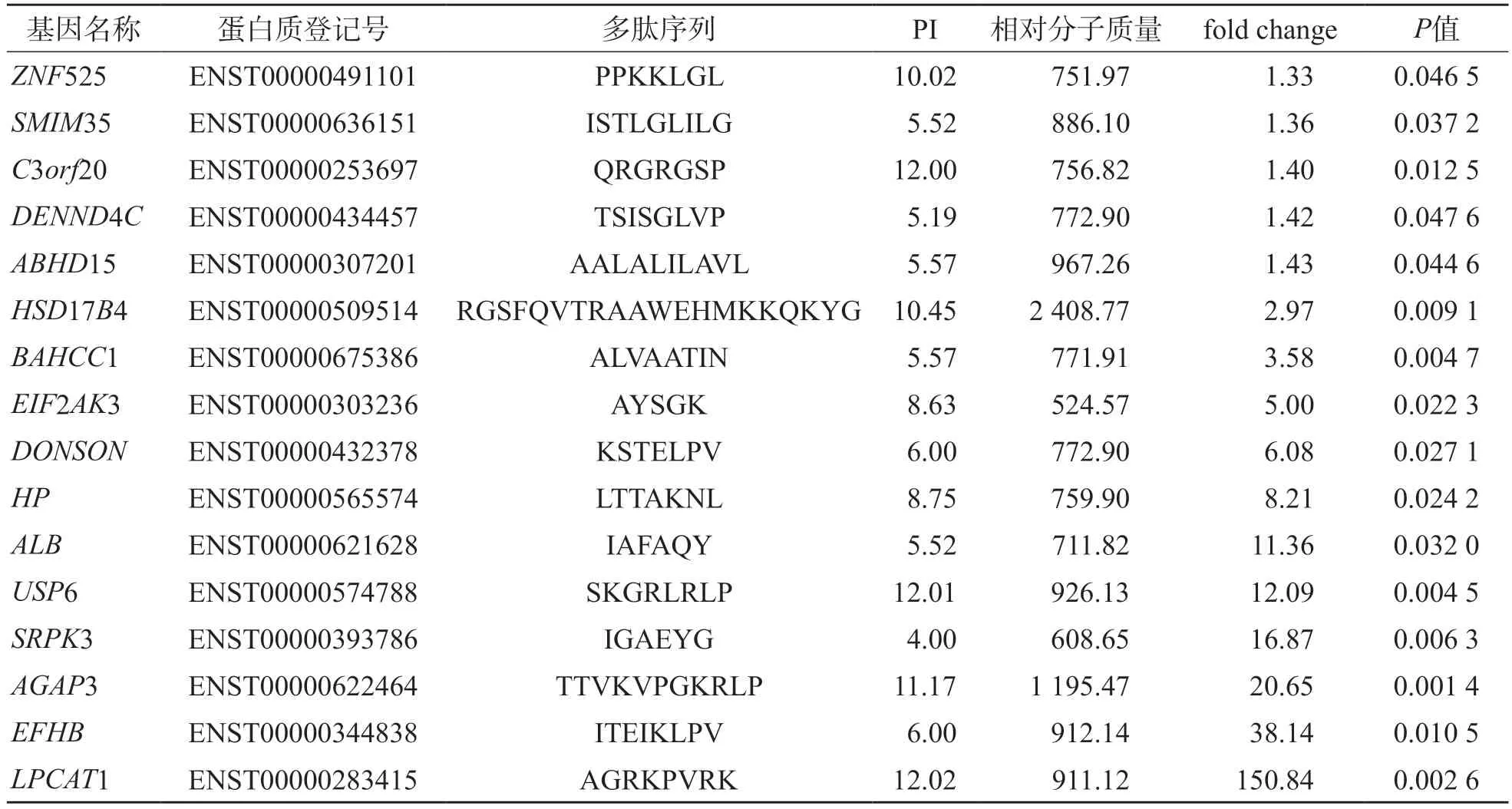
表3 PMN組較正常對照組表達上調的差異表達多肽
2.3 引導差異表達多肽的理化特性
大多數多肽的相對分子質量為500~1 500,PI為3.00~6.00或8.00~13.00。在31條差異表達多肽中,有8條來源于C4b。見圖1。
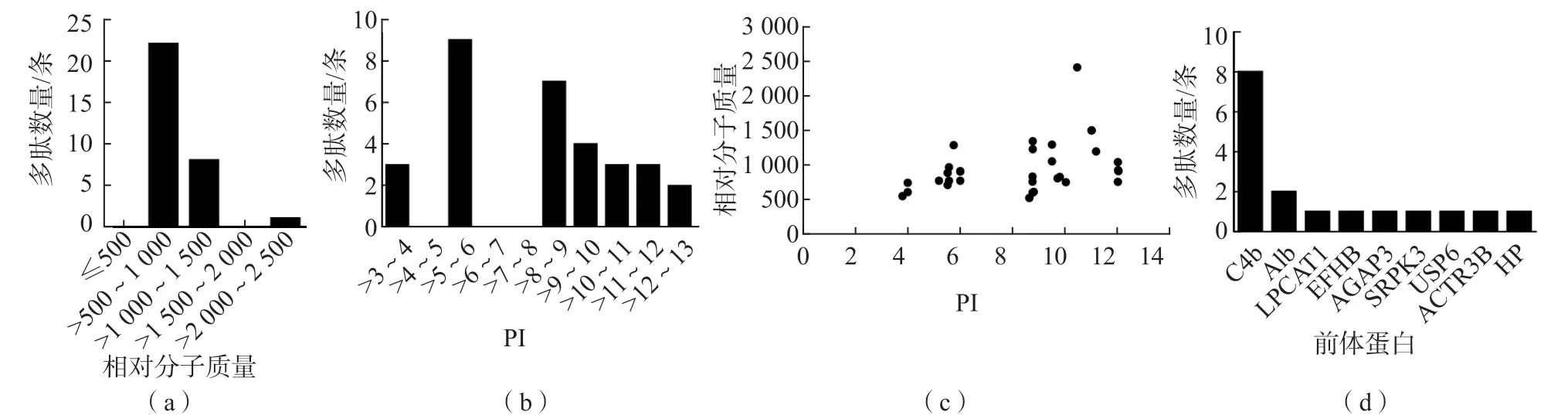
圖1 31條差異表達多肽的理化特性
2.4 差異表達多肽前體蛋白的生物信息學分析
GO富集分析結果顯示,差異表達多肽富集于囊泡、細胞外泌體、血液微粒、分泌顆粒腔、血小板α顆粒腔等區域;參與對無機物的反應、細胞分泌、胞外分泌、對金屬離子的反應、血小板脫顆粒、調節性胞吐作用、急性時相反應、蛋白質加工的調控、纖維蛋白溶解等生物過程;具有相同蛋白結合、內肽酶抑制劑活性、內肽酶調節活性、抗氧化活性等分子功能,在C5a過敏性毒素趨化受體結合、補體成分C1q結合等方面發揮作用,見圖2(a)~(c)。KEGG通路分析結果顯示,差異表達多肽前體蛋白主要在補體和凝血級聯、 系統性紅斑狼瘡通路中發揮作用,見圖2(d);其中,在補體和凝血級聯通路富集的前體蛋白所占比例最大。
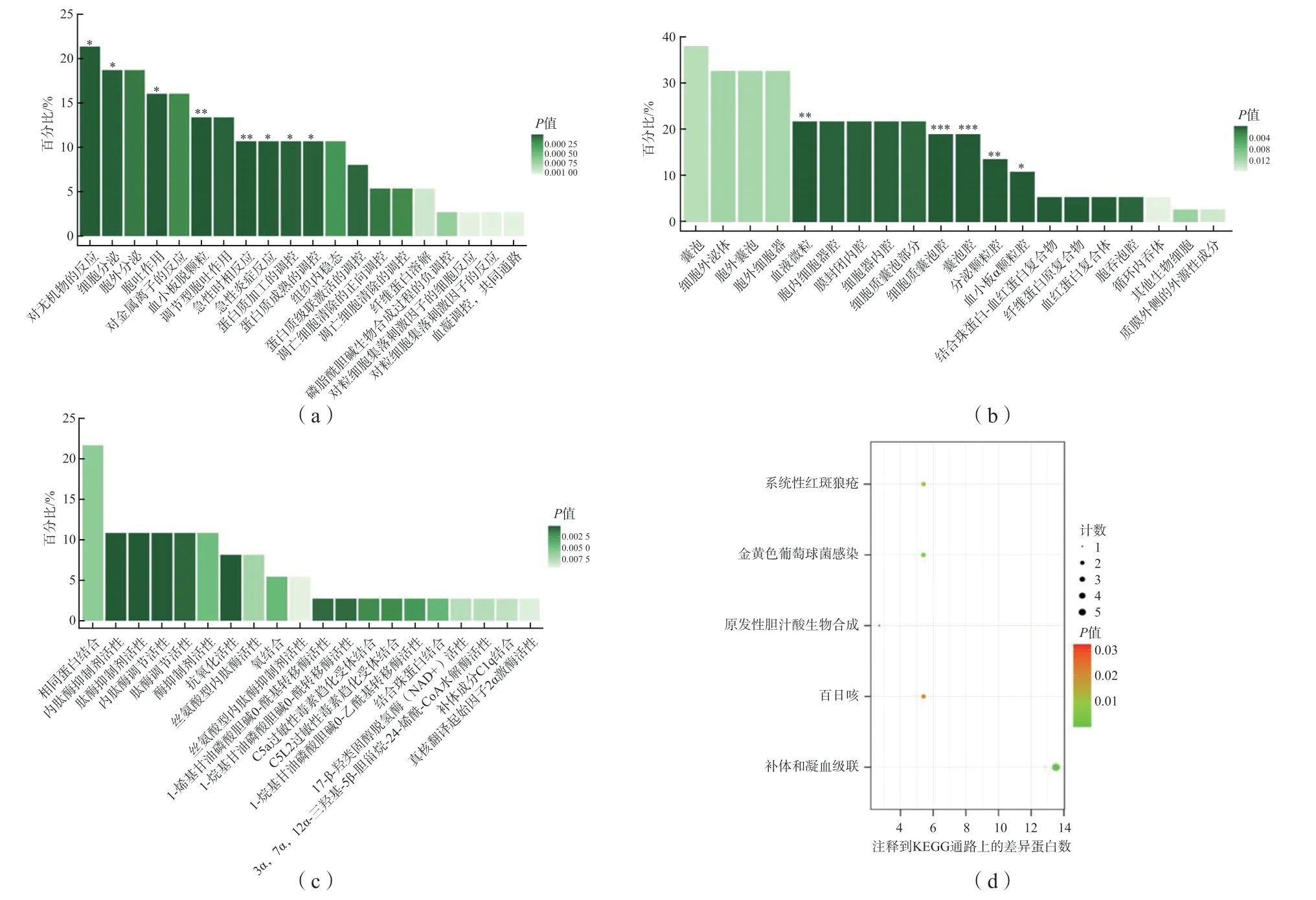
圖2 差異表達多肽前體蛋白的GO富集和KEGG通路分析
2.5 PMN患者血漿中C4b差異表達的驗證
基于C4b各分解多肽在血漿中的穩定性和相對豐度,本研究選擇表2中QLNNRQIR進行C4b定量驗證。結果提示,PMN組血漿C4b水平為(13.35±0.47)ng/mL,顯著低于正常對照組[(22.36±5.72)ng/mL](P<0.001)。Spearman相關分析結果顯示,PMN患者血漿C4b與抗PLA2R1-IgG抗體水平無相關性(r=0.03,P=0.877)。見圖3。
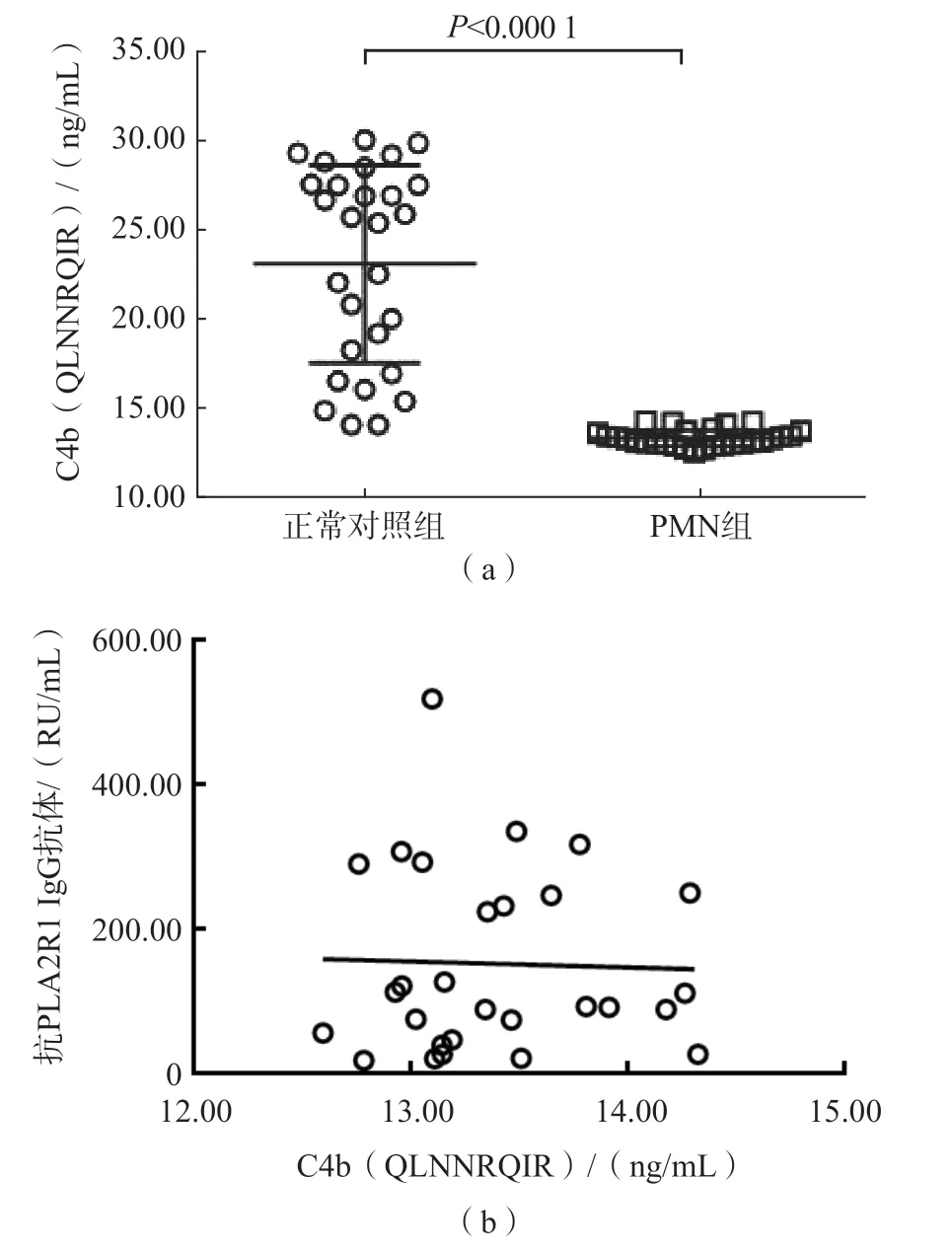
圖3 PMN組與正常對照組血漿C4b水平的比較及其與抗PLA2R-IgG抗體的相關性
3 討論
本研究通過對PMN患者和正常對照者血漿多肽的篩選、差異分析和驗證,發現補體級聯反應通路的C4b可能在PMN的發病過程中有重要意義。PMN是一種以免疫復合物沉積為病理特征的腎小球疾病,有70%以上的PMN患者體內可檢出PLA2R1抗體,主要亞類為IgG4[8]。PMN患者體內的PLA2R1抗體與足細胞表達的PLA2R1形成免疫復合物,介導了足細胞的免疫病理損傷。由于抗PLA2R1-IgG4抗體的Fc結構域上缺少半乳糖殘基,使甘露糖結合凝集素(mannose-binding lectin,MBL)能直接結合IgG4,并激活C4,進而激活MBL途徑,最終形成攻膜復合物,損傷腎小球基底膜,導致蛋白尿形成[9-10]。有研究發現,C4b和MBL沉積(提示補體級聯凝集素通路的激活)與IgA腎病的不良預后相關,但這一結果在膜性腎病中尚未得到證實。此外,C4b異常激活可能還會導致系統性紅斑狼瘡、阿爾茨海默病和精神分裂癥的發生和病情的加重。
與免疫復合物介導的補體消耗性疾病(如系統性紅斑狼瘡)不同,PMN患者血漿中總的補體蛋白(如C3和C4)水平通常不會降低。本研究發現,PMN患者血漿中C4b水平顯著降低,可能與PMN患者補體沉積相關。最新研究發現,PMN患者半乳糖缺陷型IgG4水平升高,抗PLA2R1-IgG4抗體以糖基化依賴的方式直接結合MBL,誘導足細胞骨架蛋白水解,進而激活補體受體C3aR1或C5aR1和C5b-9補體復合體末端的組裝,導致補體系統激活[11]。C4b由C4裂解而來,與C2裂解產物C2a形成C3轉化酶(即C4b2a形式),在補體激活的經典途徑和凝集素途徑中發揮重要作用。PMN患者C4b多肽顯著下調,提示C4b參與了PMN的補體激活,可作為補體藥物治療靶點的候選分子。有研究結果顯示,抑制補體激活旁路途徑(alternative pathway,AP)中C3轉化酶(即C3bBb形式)的形成在PMN中具有治療潛力,在海曼腎炎模型中,AP活性被抑制,幾乎沒有能被檢測到的C3沉積,阻止了疾病的進展[12-13]。將C4b作為新的靶向藥物分子,通過抑制C4b參與C3轉化酶的形成,阻止經典途徑和凝集素途徑的激活,可成為補體抑制藥物研發的新方向,為開發更特異和個性化的治療方案創造潛在的可能性。
本研究通過非靶向質譜方法獲得差異多肽表達譜,并通過生物信息學分析和定向質譜方法進行驗證,獲得了C4b來源的多肽,或可作為潛在的診斷標志物。但該多肽分子與抗PLA2R1抗體滴度無相關性,原因可能為:IgG4亞類抗體所形成的免疫復合物無法激活補體經典途徑,而以激活凝集素途徑為主;同時,PMN的自身抗體亞類也經歷了從IgG1到IgG3,再轉換為以IgG4為主的動態過程;另外,病理學檢查結果也提示受損組織局部有IgG不同亞類共存的情況,血清抗體滴度和轉歸之間的關系也存在爭論[14]。由于受損組織抗體種類的復雜性和個體遺傳背景的差異,C4b、抗PLA2R1-IgG4抗體和局部微環境之間的關系受到多種因素的影響。這也提示補體來源的多肽或能從另一個角度反映PMN患者的疾病進展。
綜上所述,本研究發現PLA2R1相關PMN患者血漿有31條差異表達多肽,其中C4b水平顯著降低。C4b主要參與補體激活、免疫反應和腎臟損傷。本研究結果為今后PMN血漿中小分子肽的分子診斷研究奠定了一定的基礎,C4b等差異表達多肽或可作為PMN新的疾病預測分子和治療靶點。

