發展學生“變化觀念”的項目式教學
付士林 高玉龍
摘要:以“硫代硫酸鈉的制備”為項目主題,開展高中化學“含硫物質轉化”的復習教學。學生將項目拆分成子任務并轉化為化學問題,完成了“硫代硫酸鈉的性質預測及制備原理的探究”“硫代硫酸鈉實驗制備條件優化及產品分離提純的探究”“硫代硫酸鈉產品純度的檢測”等三個子項目。在解決問題的過程中構建含硫物質轉化的“價-類”二維圖,使學生掌握從物質結構、元素價態和物質類別等多個角度認識物質的方法,同時培養學生實驗操作能力、分析問題及解決問題的能力。通過該項目的實施,嘗試將核心知識、學科思維方法、學科核心素養等有效落實,形成適用于元素化合物復習教學的一般模式。
關鍵詞:項目式教學;硫代硫酸鈉;含硫物質轉化;“價-類”二維圖
文章編號:1008-0546(2023)08-0013-07?? 中圖分類號:G632.41?? 文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2023.08.003
一、項目主題內容分析
元素化合物知識是高中化學的重要教學內容,該部分內容涵蓋了元素化合物性質、物質結構與性質、化學反應速率與平衡原理應用、氧化還原反應規律、物質分離提純的實驗操作、物質的定性定量檢驗等知識,因此元素化合物知識的教學是培養學生學科知識融合能力的重要載體。然而,由于知識本身具有龐雜、瑣碎的特點,使得該部分知識的教學多是孤立的、碎片式的,導致大部分學生采用機械記憶的學習方法,[1]難以實現知識的有效融合,不利于系統知識體系的建立。這樣的教學模式和學習方法易導致學生對陌生物質和情境無從下手,遠離《普通高中化學課程標準(2017年版2020年修訂版)》中指出的對學生五大學科核心素養的培養初衷。[2]
目前,項目式教學被認為是最具核心素養融合發展效力的教學方式之一。[3]通過設置一個真實、具體的問題情景,讓學生作為項目實施的主體參與其中,為促進項目的實施,主動提出驅動性任務,在完成項目任務的過程中,學生與教師不斷對話,完成自我評價和檢測,促進核心素養的融合發展。[4,5]項目式教學具有問題的真實性、任務的挑戰性、活動的體驗性等特點,在實施的過程中常要求學生融合運用學科內多模塊知識與技能完成項目,[4]因此,項目式教學是發展學生學科知識融合能力的一種有效途徑。
硫代硫酸鈉,俗稱大蘇打、海波,應用非常廣泛。現行教材中沒有涉及硫代硫酸鈉的性質及制備的有關知識,對于學生而言,硫代硫酸鈉屬于一種陌生物質。本文以硫代硫酸鈉的制備作為切入點,進行含硫物質轉化的復習教學,承載了化學熱力學和動力學、物質結構與性質、物質制備實驗操作、物質的定性定量檢驗等多個模塊內容,將學生置身于真實的、有意義的問題情境中,學生通過完成項目而掌握項目所承載的學科知識和方法,培養學生融合學科內多模塊知識分析和解決實際復雜問題的綜合能力。本文有可能為高中元素化合物的復習教學建立可復制模板,在實際教學過程中,教師可根據學生思維發展程度,選擇不同物質并設置不同驅動性任務進行項目式教學,使學生在已有知識的基礎上,通過教師的引導,將零散的化學知識進行整合,形成系統的知識體系。從未知到已知,在真實的項目情景中,引導學生將實際工業生產問題轉化為項目任務,再進一步拆解成化學問題,在問題解決的過程中建構元素化合物相互轉化的模型框架,[6]培養學生分析和解決問題的能力,增強化學知識與生活實際的內在聯系,獲得學科核心素養的融合發展。
二、項目教學目標分析
(1)通過“硫代硫酸鈉的制備”項目學習,使學生對含硫物質的相互轉化形成系統的知識體系,強化認識物質性質的角度,體驗模型構建的思路方法,培養宏觀辨識與微觀探析的學科核心素養。
(2)根據任務要求,設計并優化實驗方案,從熱力學和動力學角度分析實驗方案的可行性,提高學生分析問題及解決問題的能力,培養變化觀念與平衡思想的學科核心素養。
(3)根據實驗方案進行實驗探究,觀察實驗現象,并分析實驗中出現的問題,培養科學探究與創新意識的學科核心素養。
(4)根據支持信息,分析外界條件對硫代硫酸鈉制備的影響,提出優化制備及提純方案,提高學生信息獲取與加工的能力,培養證據推理與模型認知的學科核心素養。
(5)依托化學實驗創設的真實情境,以連續性問題為驅動,外顯分析思路,引導學生從定性認識層面逐漸上升到定量計算,進而提升學生分析和解決問題的能力。
三、項目任務及教學流程
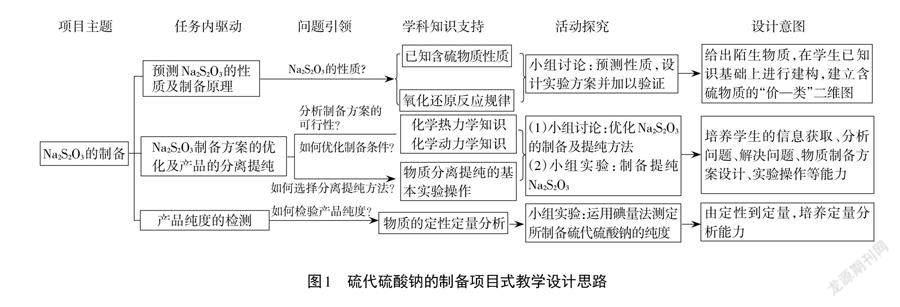
本文以“硫代硫酸鈉的制備”為項目主題,由學生自主拆解成三個驅動性任務:(1)預測硫代硫酸鈉的性質及制備原理;(2)硫代硫酸鈉實驗制備方案的優化及產品的分離提純;(3)產品純度的測定。具體對應關系如圖1所示。
四、項目實施過程及學生學習成果
1.項目的提出與拆解
【項目背景】硫代硫酸鈉是一種非常重要的化工原料,可作為定影劑應用于感光工業中,也可作為含氮氧化物尾氣的中和劑、媒染劑、麥稈和毛絨物品的漂白劑,以及紙張漂白時的脫氯劑等,在醫療上還可用作氰化物中毒的解毒劑。在實驗室中可以模擬工業生產硫代硫酸鈉的過程,為了制備硫代硫酸鈉,需要做哪些準備呢?
【項目拆解】對項目的拆解是項目式教學的關鍵。[7,8]通過思考與討論,學生將主項目拆解成三個子項目,即“預測硫代硫酸鈉的性質”“實驗室制備硫代硫酸鈉”及“產品純度的測定”,通過小組間的相互補充及教師的引導最終確定預設項目任務,此過程使學生建立了陌生物質性質預測及制備方案設計的思維模型(圖2)。
2.預測Na2S2O3的性質及制備原理
【教師】如何預測Na2S2O3的性質?
【學生】(1)結構決定性質,通過 Na2S2O3的結構預測其性質;(2)可以根據物質類別及硫元素的價態預測其性質。
【教師】物質結構和“價-類”二維模型是認識物質性質的重要方法。圖3為 Na2S2O3的結構,根據價鍵理論分析 S2O 3(2)-的空間結構及化學鍵的類型。
【學生】S2O 3(2)-為四面體結構,結構中存在著 S-O σ鍵、S-O配位鍵、S-S配位鍵。
【教師】S2O 3(2)-是由硫原子取代 SO4(2)-結構中的一個 O 原子而形成的。 S2O 3(2)-和 SO4(2)-在性質上具有一定的相似性,例如:BaSO4和 BaS2O3均難溶于水。然而,Na2S2O3還存在著很多特性。根據已有知識,構建含硫物質相互轉化的“價-類”二維圖,從價態和類別兩個角度預測硫代硫酸鈉的性質。
【小組展示】學生完成并展示含硫物質相互轉化的“價-類”二維圖(圖4)。經過小組討論,學生得出如下觀點:(1)從價態角度分析,Na2S2O3中 S 元素的化合價是+2價,處于硫元素的中間價態,應既具有氧化性,又具有還原性;(2)從類別角度分析,Na2S2O3屬于鹽,應具有鹽的通性,可能會和某些物質發生復分解反應。
【教師】如何驗證Na2S2O3的還原性?
【學生】利用KMnO4等氧化劑檢驗。
【教師】如何驗證Na2S2O3既具有氧化性,又具有還原性呢?
資料卡:Na2S2O3遇酸會產生淡黃色沉淀,并逸出具有刺激性氣味的氣體。
【學生】Na2S2O3在酸性條件下會發生歧化反應,淡黃色沉淀為硫,逸出的氣體可能是SO2。
【實驗驗證】各小組根據所提供的儀器及藥品,實驗驗證Na2S2O3的氧化性及還原性,觀察并記錄實驗現象。小組匯報結果詳見表1。
【教師】Na2S2O3具有還原性,很多氧化性較弱的物質均能將其氧化,例如在堿性條件下,I2可以將 S2O 3(2)-氧化成 SO? Na2S2O3的工業制備方法有很多,根據氧化還原反應的“價態歸中”規律,可通過硫單質與 SO3(2)-反應制備 S2O 3(2)-(圖4,虛線標注),反應原理如下:Na2SO3+ S = Na2S2O3。實際制備過程中,這一方案是否可行?如何對 Na2S2O3制備條件進行優化呢?這就是下一個任務需要解決的問題。
3. Na2S2O3制備方案的優化及產品的分離提純
【教師】如何從理論上分析一個化學反應能否應用于工業生產?
【學生】應該從兩個方面考慮:(1)反應發生的可能性,利用△G=△H - T △S 公式,若△G<0,則反應可以自發進行;(2)反應發生的現實性,即反應速率的快慢,活化能的大小。
【教師】分析制備方案的可行性,需從化學熱力學和動力學兩個方面考慮。根據所給信息(圖5),[9-12]分析制備方案的可行性?
【小組展示】學生通過計算得出結論:△ H=-3.95 kJ·mol-1,△S=23 J·K-1·mol-1,因此任何溫度下△G 均小于零,反應均具有自發進行的可能性。但動力學數據表明,反應的活化能較大,反應速率相對較慢。因此,若將該制備方案應用于實際生產,應采取一定措施,降低反應的活化能,提高反應速率。
【教師】運用化學熱力學和動力學數據可分別分析上述反應進行的可能性和現實性。在工業上,常通過改變反應歷程降低活化能的方法加快反應速率。[10-12]如何對實驗方案進行優化,并根據方案設計制備Na2S2O3的實驗裝置圖?
【小組展示】通過各小組間相互補充,確定優化實驗方案及裝置(圖6)。
【教師】Na2S2O3是通過各物質間復雜反應生成,因此需明確各種物質間的轉化過程,進而掌握反應的原理。結合已有知識,回答下列問題。
(1)問題1:SO2通入水溶液中后,會發生哪些反應,產物會以哪些形式存在?
(2)問題2:已知 H2SO3的電離平衡常數為:Ka1=1.54×10-2,Ka2=1.02×10-7;H2S 的電離平衡常數為:Ka1=9.1×10-8,Ka2=1.1×10-12。根據數據比較 H2SO3與 H2S 的酸性強弱關系,推測將 SO2通入Na2S 的溶液中會發生哪些反應?
(3)問題3:結合問題1、2,分析在錐形瓶中如何產生S,進而制備Na2S2O3。
【小組展示】通過小組討論及相互補充,學生得出如下結論。
(1)針對問題1:SO2會和水發生反應生成 H2SO3, H2SO3是弱酸,不完全電離,在溶液中的存在形式有: H2SO3、HSO3(-)、SO
(2)針對問題2:H2SO3的酸性強于 H2S,將 SO2通入Na2S 的溶液中,生成的H2SO3會與S2-反應生成H2S。
(3)針對問題3:根據問題1、2可知,反應體系中有 H2SO3和 H2S 生成,二者可發生“價態歸中”反應生成S,進而與 SO3(2)-反應制備 S2O
【教師】請分別寫出錐形瓶內進行的每一步反應方程式,并分析該方案的優點。
【小組展示】各小組討論優化制備方案的反應機理,結果見圖7。通過 H2S 與 SO2反應產生的硫單質,能夠與Na2SO3充分反應。同時,隨著硫單質的不斷消耗,逐步促進了可逆反應的正向進行。
【教師】在討論過程中,學生充分考慮到了反應方向、反應速率、化學平衡移動、實驗安全、尾氣處理等在實驗中應注意到的細節問題。實際工業生產中,很多條件會對物質制備產生影響,哪些因素會對 Na2S2O3的制備產生影響?通過什么方法進行研究呢?
【學生】溶液酸堿性及溫度可能會對 Na2S2O3的制備產生影響,可以通過控制變量法依次優化制備條件。
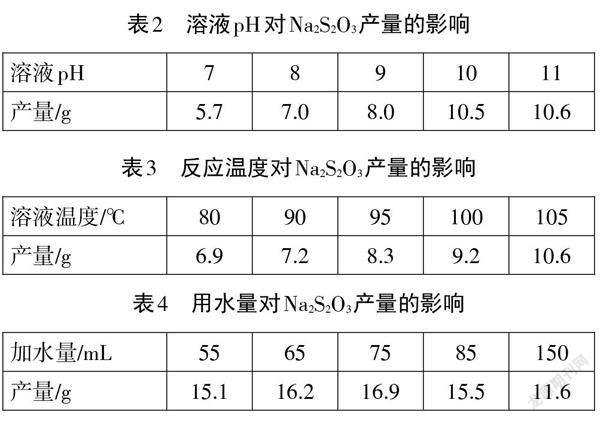
【教師】查閱資料發現,溶液的pH、反應溫度及水的用量都會對 Na2S2O3的產量產生影響。結合所給信息(詳見表2-表4),[9]選擇最佳制備條件。
【學生】Na2S2O3產量隨溶液pH升高而增加,但pH 高于10.0以后,產量變化不大,所以應保持溶液pH =10.0。類似的分析可知,反應溫度為100℃,用水量為75 mL 時,Na2S2O3產率最大。
【教師】維持溶液pH =10.0,可以向反應體系中加入一些堿性物質,如果從NH3· H2O、NaOH 和Na2CO3中選擇,選擇哪種物質更好?
【學生】NH3· H2O易分解,同時從原料成本角度考慮應選擇Na2CO3。
【教師】學生對信息進行了充分的提取和分析,選擇了制備 Na2S2O3的最佳條件。在實際制備過程中可
能遇到以下困難,[9]如何解決?
(1)問題4:Na2CO3和 Na2S 同時溶解時間過長, Na2S易被空氣氧化而使溶液變渾濁,加熱溶解會促進 Na2S水解且有臭味溢出。[9]
(2)問題5:Na2SO3固體與濃硫酸反應生成Na2SO4附著在Na2SO3表面,減慢了SO2的生成速率,延長反應時間。[9]
(3)問題6:由于反應體系是密封的,通過溶液pH 判斷反應進行程度很不方便,同時會導致 SO2氣體溢出。[9]
【小組展示】通過小組充分討論及相互補充,針對上述問題,學生提出如下解決方案:
(1)針對問題4:可調整試劑的加入順序,在微熱下先將Na2CO3溶于水,完全溶解后再將Na2S溶于Na2CO3溶液中,這樣可以抑制Na2S 的水解,縮短溶解時間。
(2)針對問題5:可適當降低硫酸濃度,同時用少量水潤濕Na2SO3固體。
(3)針對問題6:可通過觀察反應體系的現象變化判斷反應終點,反應溶液的顏色由無色→黃色→無色,繼續通入SO2氣體,當溶液中有淡黃色固體析出且附著在瓶壁上,反應一段時間仍不消失,說明溶液中的反應物已完全反應。
【教師】Na2S2O3產品中有哪些雜質?
【學生】通過上述方法制備的 Na2S2O3中可能含有的雜質為:Na2S、Na2SO3、Na2CO3,由于Na2S2O3具有還原性,易被氧化,因此產品中還可能有Na2SO4雜質。
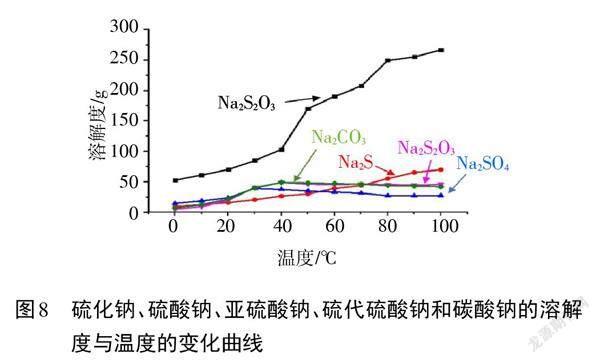
【教師】在制備過程中,選擇合適的分離提純方法是實驗成功的關鍵。圖8給出了Na2S2O3制備過程中,各種物質溶解度隨溫度變化的情況,結合所給信息,選擇提純Na2S2O3的具體方法。
【小組展示】對比五種物質溶解度隨溫度的變化情況,可以看出硫代硫酸鈉的溶解度受溫度影響較大,因此可采用重結晶的方法進行分離提純。具體提純方法為:蒸發濃縮至有晶膜出現,趁熱過濾,冷卻結晶,過濾,洗滌,干燥。
【教師】資料表明:Na2S2O3晶體析出時間過長,易造成濾液中 Na2S2O3的浪費而降低產量,[9]如何解決?
【學生】這可能和重結晶時溶劑的使用有關,根據 Na2S2O3的溶解性,可使用乙醇和水的混合溶液降低 Na2S2O3的溶解度,縮短結晶時間。
【教師】經過上述環節,學生已經掌握了Na2S2O3制備及提純方法,下面通過實驗來檢驗方案的可行性。
【任務完成-實驗制備】各小組根據優化方案及分離提純方法,實驗制備Na2S2O3。實驗過程由學生在實驗室完成,實驗過程中教師給予相應指導和提示,學生實驗操作記錄如下:連接實驗裝置并檢查裝置的氣密性。稱取3.3 g Na2CO3固體,微熱溶解于盛有75 mL 蒸餾水的錐形瓶中,再加入15.0 g Na2S 固體并使其完全溶解。向圓底燒瓶中加入32.0 g Na2SO3固體并用少量水潤濕,在分液漏斗中加入20 mL 70%硫酸。對錐形瓶內溶液加熱并攪拌,維持反應溫度為105℃。打開分液漏斗活塞,逐滴向 Na2SO3中滴入硫酸,產生的氣體不斷通入錐形瓶中,反應40 min后終止反應并冷卻至室溫。將錐形瓶內溶液蒸發濃縮,趁熱過濾,向濾液中加入15 mL 乙醇,降溫結晶,產品經過濾、洗滌、干燥后備用。不同小組原料用量不同,所得產品產量不同。
4.產品純度的檢驗
【教師】Na2S2O3具有還原性,易被氧化,因此產品中可能有Na2SO4雜質。如何在雜質存在的情況下,檢驗產品是否為Na2S2O3?
【學生】Na2SO4的存在不影響 Na2S2O3的檢驗,因此依然可以通過加稀硫酸的方法檢驗。
【教師】如何定量檢測Na2S2O3?
【小組展示】經過小組交流討論,匯報結果詳見表5。
【教師】兩個方案都利用了Na2S2O3本身的特性,但方案2操作更加簡捷、精確。
【小組討論優化方案】結合所給實驗儀器及藥品,各小組經過充分分析討論,最終確定Na2S2O3純度的測定方案(表6)。
【實驗測定】各小組根據實驗方案,測定Na2S2O3的純度(詳見表6)。
5.學生課后訪談
【教師】通過該項目的學習,學生從陌生物質的性質預測開始,逐步實現了陌生物質的實驗制備及定性/定量檢驗。為檢驗學生學習效果與項目預期目標的匹配程度,對學生進行了課后訪談。
【學生1】預測陌生物質性質時,應分別從物質結構、元素價態及物質類別等多個方面分析。結構決定性質,通過結構分析可了解物質中化學鍵類型,進而確定物質參與化學反應時的活性位點。根據物質所含元素價態可判斷其氧化性和還原性,這有助于設計制備及儲存方法。通過類別認識物質,則可以了解物質的通性。
【學生2】一個制備方案能否應用于工業生產,需要從化學熱力學和動力學兩個方面分析。
熱力學數據(反應焓變和熵變)可用于判斷反應進行的可能性,動力學數據(活化能和反應速率)可用于判斷反應進行的現實性。
【學生3】實施實驗之前,需要查閱相關資料精心設計實驗方案,對實驗過程中可能出現的各種問題充分預判并進行優化。在實驗的過程中,要和小組同學進行充分討論,這樣可以相互補充,更有利于問題的解決。
【學生4】在定量分析的過程中,要注意細節,仔細觀察實驗現象,微小的失誤就可能會導致實驗的失敗。當實驗出現誤差時,要根據原理對誤差進行分析,了解誤差出現的原因并在后續實驗中加以糾正。
【教師】通過該項目的學習,學生掌握了從物質結構和“價-類”二維圖等多方位預測物質性質的思路方法;學會了利用化學熱力學及動力學數據設計及優化物質制備方案;團隊協作能力、分析和解決問題的能力得到顯著提高。同時,綜合實驗探究能力得到了提升,學生能夠充分分析實驗中存在的問題,尋找解決方案,有效地實現了項目預期發展目標。
五、項目式教學反思
本文以“硫代硫酸鈉制備”為項目主題,運用學生已有含硫物質相互轉化的知識解決了未知問題。物質制備實驗是一個有機整體,它包含陌生物質性質預測、制備條件的調節和控制、實驗制備、分離提純、定性/定量檢驗等幾個項目。在傳統的高中化學元素化合物復習中,學生的思維大多停留在單點結構、多點結構水平上,知識關聯與抽象拓展的思維能力不足。實施項目式教學,在具體項目任務的驅動下,學生作為項目實施的主體參與其中,激發了學生學習和思考的主動性,通過小組間的相互討論及教師的問題引導,學生內在的思維過程得以外顯,使學生知曉自己思維的障礙點,同時改變了高三復習課知識滿堂灌的現象,充分發揮學生的主體性,調動學生學習的主動性。在解決問題的過程中,學生的信息提取、分析問題、解決問題、語言表達、邏輯推理和小組合作等能力都得到了充分的鍛煉。綜上所述,將項目式教學應用于元素化合物的復習過程,一定會促進學生核心素養的融合發展,彰顯化學學科特色,進一步強化學科核心素養的落實。
參考文獻
[1]姜言霞,王磊,支瑤.元素化合物知識的教學價值分析及教學策略研究[J].課程·教材·教法,2012(9):106-112.
[2]中華人民共和國教育部.普通高中化學課程標準(2017版2020年修訂)[S].北京:人民教育出版社,2020.
[3]王磊,陳光巨.外顯學科核心素養促進知識向能力和素養的轉化—北京師范大學“新世紀”魯科版高中化學新教材的特點[J].化學教育(中英文),2019,40(17):9-19.
[4] Joseph S K,Charlene M C,Carl F B.中小學科學教學—基于項目的教學方法與策略[M],王磊,等譯.北京:高等教育出版社,2004.
[5]陳穎,王磊,徐敏,等.高中化學項目教學案例—探秘神奇的醫用膠[J].化學教育(中英文),2018,39(19):8-14.
[6]亓玉成.建構主義學習理論在初中化學教學中的應用[J].天津教育,2021(6):131-132.
[7]竇卓,劉炯明,江合佩.基于真實情境促進核心素養發展的項目式實驗教學—以“草酸亞鐵的制備及檢測”為例[J].福建基礎教育研究,2021(11):118-121.
[8]宋立棟,劉翠,王磊,等.基于項目式教學的含硫物質轉化復習教學設計與實施[J].化學教育(中英文),2019,40(19):37-40.
[9]陳英,賴紅珍.實驗室硫代硫酸鈉的制備條件的研究及改進[J].綿陽師范學院學報,2015,34(2):121-126.
[10]韋漢昌,趙鳳春.硫代硫酸鈉合成反應動力學模型研究[J].廣西廣播電視大學學報,2004,15(2):57-58.
[11]邸萬山,段樹斌硫代硫酸鈉合成條件的優化[J].遼寧化工,2003,32(2):54-55.
[12]張永,鄭志勝,張成芳,液相中H2S與SO2反應動力學研究[J].高校化學工程學報,2003,17(3):279-283
——硫代硫酸鈉

