小麥DREB4蛋白的原核表達及多克隆抗體制備
李永波 魯琳 方會見 崔德周 孟福燕 黃琛 隋新霞 樊慶琦 楚秀生

關鍵詞:小麥:非生物脅迫:DREB4轉錄因子:多克隆抗體
中圖分類號:S512.1:Q786 文獻標識號:A 文章編號:1001-4942(2023) 03-0009-06
干旱、鹽、高溫、冷等各種非生物脅迫會嚴重影響小麥產量。DREB蛋白含有一個保守的AP2結構域,可以和順式作用元件DRE核心序列(A/GCCGAC)發生特異性結合,通過在轉錄水平上調控下游基因的表達,進而應對各種非生物脅迫。到目前為止,DREB轉錄因子在擬南芥、大豆、水稻、玉米、大麥和小麥等多種植物中被鑒定出來。DREB分為六大類(DREB1~6),其中,DREB1在擬南芥、水稻、玉米中主要應答冷脅迫,DREB2主要應答干旱、鹽脅迫,DREB3參與ABA和糖信號途徑,DREB4應答干旱、冷脅迫及在乙烯與茉莉酸途徑中起作用,DREB5參與應答干旱、冷脅迫,DREB6應答干旱、鹽脅迫。大量研究已驗證了DREB在植物應對非生物脅迫中的功能。如在小麥中過表達擬南芥DREBIA、大豆GmDREB1或棉花Gh DREB基因,可通過提高根系活力、光合作用及滲透調節能力提高小麥的抗旱性;在擬南芥中過表達大豆GmDREB2、GmDREB3或小麥Ta DREB3基因,可提高擬南芥抗旱、耐鹽、耐高溫及抗凍性;過表達GmDREB6基因,可增強大豆的耐鹽能力。
然而,目前幾乎所有關于DREB的研究是集中在轉錄水平上的調控,缺乏蛋白質水平上的調控研究,且DREB蛋白發揮生物學功能是否通過磷酸化、乙酰化等蛋白水平上的調控尚未可知,因此,研究識別內源性DREB蛋白的特異性多克隆抗體,對于DREB在蛋白水平的調控研究具有非常重要的意義。
本研究通過對小麥中已有的DREB4A、4B和4C進行序列分析,選取DREB4A進行原核表達、純化,并以其作為抗原,首次制備出可識別小麥內源DREB4蛋白的多克隆抗體,以期為進一步研究植物DREB4在蛋白水平上的調控機理提供方法學基礎。
1材料與方法
1.1試驗材料
供試小麥品種為濟麥379,由山東省審定(魯審麥20210017)。取其幼苗期根、葉為材料進行試驗。
1.2 DREB4序列分析與合成
本研究通過DNAMAN8軟件對NCBI中提交的DREB4A(AY781354.1)、4B(AY781355.1)和4C(AY781356.1)序列進行分析;DREB4A序列的合成由北京擎科生物科技有限公司進行。
1.3 DREB4A載體構建、原核表達及純化
將上述合成的DREB4A序列與大腸桿菌表達載體PET30a通過同源重組的方法(pEASY-Basic Seamless Cloning and Assembly Kit,CU201-02,北京全式金生物技術股份有限公司)連接,將連接產物轉入DH5α(北京擎科生物科技有限公司)感受態細胞中,冰上放置15 min.42℃水浴熱激90s,再冰上放置2 min,加入1 mL無任何抗生素的LB液體培養基,37℃、210r/min水平搖th,然后取100μL菌液,涂于含有卡那霉素的LB固體培養基上,37℃過夜培養。挑取10個單克隆進行PCR檢測,選取2個陽性信號最強的單克隆由北京擎科生物科技有限公司進行測序,對測序正確的單克隆進行搖菌、質粒提取(質粒小提試劑盒,DP103,北京天根生化科技有限公司)。將提取好的質粒轉入B121( DE3)感受態細胞(CD701-02,北京全式金生物技術股份有限公司)中,剩余步驟同DH5a感受態細胞轉化。挑單克隆,置于5 mL LB液體培養基中,37℃過夜培養,然后吸取1 mL菌液,加入到300 mL LB液體培養基中進行擴大培養,待菌液OD值為0.6~0.8時,加入終濃度為50 mmol/L的IPTG(G5042-1G,武漢塞維爾生物科技有限公司)進行誘導表達,28℃過夜培養;菌液于6000 r/min離心10 min,收集菌體沉淀,用1×PBS( phosphate buffer saline)清洗沉淀1次,然后加入40 mL lxPBS重懸,超聲破碎(開3s,關3s;共計30 min),6000 r/min離心10min,分別將沉淀、上清液進行SDS電泳檢測。利用His標簽蛋白純化試劑盒(P2226,上海碧云天生物技術有限公司)對上清液進行純化,然后置于透析袋中4℃過夜透析,將透析后的蛋白置于-20℃保存備用。
1.4小麥DREB4多克隆抗體制備
選取實驗級日本大耳白兔和新西蘭大白兔各1只,飼養體重至1~2 kg時,用注射器將充分混勻的1mL完全弗氏佐劑(液體石蠟:羊毛脂=2:1)和0.3 mg DREB4A融合蛋白對每只兔子進行皮下注射第1針,標記為第1天;第12天,將充分混勻的1 mL不完全弗氏佐劑(完全弗氏佐劑+終濃度20 mg/mL的卡介苗)和0.15 mg融合蛋白對每只兔子進行皮下注射第2針;第26天,將充分混勻的1 mL不完全弗氏佐劑和0.15 mg融合蛋白對每只兔子進行肌肉注射第3針;第40天,將充分混勻的1 mL不完全弗氏佐劑和0.15 mg融合蛋白對每只兔子進行肌肉注射第4針:第53天,取兔子血清進行Western blot驗證。
1.5 Western blot分析
利用植物組織蛋白裂解液提取小麥幼苗期根、葉部的總蛋白(植物蛋白提取試劑盒,CW0885,康為世紀生物技術有限公司),配制15%的聚丙烯酰胺凝膠進行電泳:通過濕法轉膜,將凝膠中的蛋白轉移到硝酸纖維素薄膜上,然后將膜放人含有2%脫脂奶粉的TBS(25 mmol/LTris-HCl,137 mmol/L NaCl)中,封閉1h;加入DREB4多克隆抗體(1:1000稀釋于2%脫脂奶粉中),4℃過夜;用TBST(TBS+20%吐溫-20)洗滌3次后,向封閉液中加入堿性磷酸酶(alkalinephosphatase,AP)標記的二抗,緩慢搖動24 h,然后TBST洗滌3次,每次10 min;最后用發色液(TBS 10 mL,5% NBT 45μL,5% BCIP 35μL)進行發色。
1.6免疫組織化學法進行亞細胞定位
將小麥葉片下表皮撕下,置于4%多聚甲醛中,室溫放置24 h,棄掉多聚甲醛,用1×PBS清洗3次,加入2%脫脂奶粉于37℃封閉30 min,然后在4℃下加入DREB4多克隆抗體(1:200稀釋于2%脫脂奶粉中)過夜;用PBS洗滌3次后,加入1μL二抗(山羊抗兔-Alexa Fluor 555抗體)和10mL BSA,37℃繼續孵育th,然后用TBS清洗3次,在室溫下用4′,6-二脒基-2-苯基吲哚(DA-PI,AnaSpec Inc., San Jose, CA,USA)染色10 min,然后用TBS清洗3次,置于熒光顯微鏡(HT7700,Hitachi,Tokyo,Japan)下觀察并拍照。
2結果與分析
2.1小麥DREB4序列分析
在普通小麥中,DREB4存在DREB4A、4B、4C三種轉錄本,其中,DREB4A編碼394個氨基酸,分子量為42.8 kDa;DREB4B編碼346個氨基酸,分子量為37.7 kDa;DREB4C編碼68個氨基酸,分子量為7.1 kDa(圖1)。三個蛋白氨基酸序列的保守性為61.28%,第1~25位的氨基酸完全一致,其中,DREB4B除第26~73位氨基酸缺失外,其它位置的氨基酸與DREB4A完全一致。DREB4A、4B和4C存在序列間的差異,可能是應對不同非生物脅迫產生的可變剪切所致。
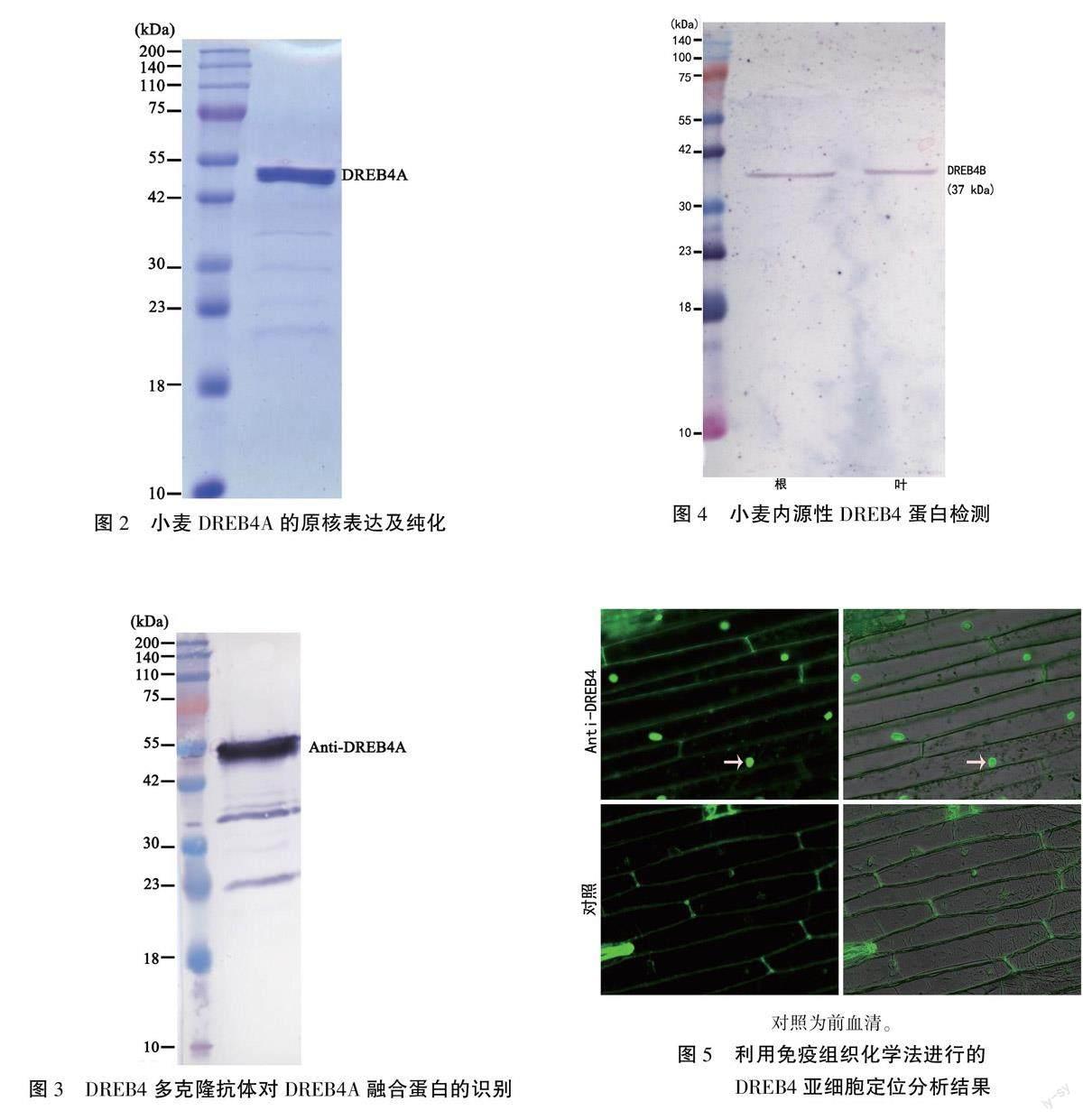
2.2小麥DREB4A的原核表達
鑒于DREB4A的氨基酸序列最長,選其進行后續分析。首先,將人工合成的DREB4A序列與表達載體PET30a連接后,在大腸桿菌中進行表達,上清液中的蛋白純化后進行SDS -PAGE檢測。結果顯示,在大約50 kDa處出現清晰的蛋白條帶(圖2),與預期的蛋白分子量相符,表明DREB4A成功表達。
2.3 DREB4多克隆抗體的制備
本研究以上述獲得的純化DREB4A融合蛋白為抗原免疫兔子,從兔血清中獲取了DREB4多克隆抗體。Western blot結果顯示,該抗體在目的蛋白位置清楚地識別到DREB4A蛋白(圖3)。
2.4 DREB4多克隆抗體對小麥內源性DREB4蛋白的識別及特異性檢測
為了進一步驗證該抗體能否識別小麥內源性DREB4蛋白,分別提取小麥苗期根、葉總蛋白進行免疫識別。Westem blot結果顯示,僅在37 kDa處檢測到清晰的蛋白條帶,這與預測的DREB4B蛋白分子量一致(圖4)。表明該抗體可以識別小麥內源性DREB4B蛋白,而且特異性好,可以用于后續植物DREB分子機理的相關研究。
2.5 DREB4亞細胞定位分析
DREB4定位于細胞核中(圖5),與前人報道的DREB轉錄因子核定位的結果一致,進一步證實了該抗體特異性較好,可用于開展免疫組織或細胞化學研究的可行性。
3討論與結論
DREB是一類抗非生物脅迫的轉錄因子,目前主要用于抗逆轉基因植物的培育及相關分子機理的解析。小麥DREB4蛋白是一種對動物和人類無危害的蛋白,將其用于糧食作物抗逆性轉基因改良有著廣闊的市場前景。DREB4在小麥中存在三種轉錄形式(DREB4A、4B和4C),其中,DREB4A編碼的多肽鏈最長,涵蓋的蛋白信息最豐富,推測由此蛋白作為抗原產生的抗體可識別DREB4的所有三種形式,因此本研究利用DREB4A蛋白作為抗原,進行了DREB4多克隆抗體的制備。經過抗原上清蛋白的純化、免疫注射,最終研制出能識別小麥內源性DREB4蛋白的多克隆抗體。
盡管從植物中已克隆出多種類型的DREB基因,但由于其抗體類型匱乏以及識別內源性蛋白抗體的空白,導致有關DREB在蛋白水平上的調控機理研究進展相對緩慢。目前,只有擬南芥DREBIA的抗體制備成功,且僅對大腸桿菌中表達的擬南芥DREBIA融合蛋白進行了檢測。本研究首次開發了特異性識別小麥內源DREB4蛋白的多克隆抗體,既豐富了植物DREB的抗體類型,也為進一步推動DREB在蛋白水平上的研究提供了方法學基礎。
利用本研究制備的DREB4多克隆抗體檢測小麥苗期根、葉內源性DREB4蛋白時,僅識別到了DREB4B蛋白條帶,與預測的該抗體能識別小麥中DREB4三種蛋白形式的結果不一致,這可能是因為DREB4具有組織器官以及不同發育階段表達特異性,在小麥苗期根、葉中主要以DREB4B的形式表達,而在花、籽粒等其它組織器官以及不同發育階段中則以其它形式表達;另外,DREB4在不同小麥品種中的表達形式也可能存在一定的差異,本研究所用小麥品種濟麥379為抗旱節水型品種,在其苗期根、葉中主要以DREB4B的形式表達,但在其它類型的小麥品種中以哪種形式表達還有待進一步研究。
傳統DREB基因亞細胞定位是采用構建DREB-GFP過表達載體轉入組織或細胞中的方法進行定位,而本研究是利用該抗體對內源DREB4進行免疫定位,與傳統方法相比可避免因過表達造成目的蛋白移位的現象。
綜上所述,本研究通過對DREB4A進行大腸桿菌表達、純化,并以此作為抗原成功制備出可識別小麥內源性DREB4蛋白的高度特異性多克隆抗體,可為深入研究植物DREB4在蛋白水平上參與非生物脅迫的調控機理奠定方法學基礎。

