初、高中化學“水溶液”主題內容的銜接性教學研究
武衍杰 宮琦 王春姣


摘要: 以“水溶液”主題內容為研究對象,參照初、高中新課標要求和教科書編排分析該主題在初、高中的銜接特點。基于初、高中“水溶液”主題的連貫性和發展性特點及主題內容結構,選取“侯氏制堿法”為主題情境,設計初、高中貫通的“水溶液”主題銜接性教學,以促進學生在不同學段對“水溶液”主題認識角度的豐富和發展。
關鍵詞: 水溶液; 初、高中化學; 銜接教學; 教學研究
文章編號: 10056629(2023)05004807
中圖分類號: G633.8
文獻標識碼: B
義務教育和高中化學課程標準的頒布(以下簡稱初、高中新課標),標志著基礎化學教育正式進入核心素養時代。盡管初、高中新課標對學科核心素養的呈現表現出連貫性,但初、高中課程性質、課程目標、課程評價、學生認知等大不相同,致使初、高中化學課程的實施具有明顯差異。因此,新課標時代如何進行銜接性教學便成為亟需研究的問題,包括新課標、教科書等對具體內容主題呈現的銜接性如何,基于主題的初、高中銜接性教學如何開展等。本文以“水溶液”主題為例,分析其在新課標和教科書中不同學段呈現的特點并開發主題情境,嘗試設計初、高中貫通的“水溶液”主題教學。
1 “水溶液”主題內容在初、高中新課標中的銜接方式特點
“水溶液”主題作為初、高中化學教學的核心內容,承載著培養學生“宏觀辨識與微觀探析”“變化觀念與平衡思想”的學科核心素養價值。通過對初、高中新課標中有關“水溶液”主題的內容要求和學業要求(見表1)的分析,有利于把握“水溶液”主題在不同學段認識視角和認識深度的發展進階要求,對開展“水溶液”主題的初、高中銜接教學具有指導作用。
通過表1分析發現,新課標對“水溶液”主題內容的教學要求具有鮮明的進階性和連貫性,初、高中對“水溶液”的認識均包括定性和定量兩個水平,均圍繞“組成”和“限度”兩個學科大概念建構對“水溶液”的定性和定量認識,具體概念層級結構如圖1。基于內容要求和學業要求,初中段主要是從宏觀物質層面認識水溶液的組成及溶質的溶解限度,高中必修段認識視角轉變為基于電離從微觀粒子視角認識水溶液的組成及微觀粒子在水溶液中的相互作用,而到了高中選擇性必修段對水溶液組成的認識進一步進階為基于平衡關系全面認識水溶液中微觀粒子的種類和數量,并能基于平衡常數這一工具從限度視角定量認識微粒間的相互作用。即初、高中對水溶液認識的三級水平可簡要概括為:關注物質→關注微粒及微粒間作用→關注微粒間平衡關系,把握認識視角的轉變和認識深度的發展是開展初、高中貫通的銜接性教學的基礎。
2 “水溶液”主題內容在教科書中的銜接方式特點
以人教版初、高中化學教科書為例,分析“水溶液”內容在不同階段的分布(見表2)及呈現特點,總結不同階段“水溶液”知識間的聯系。
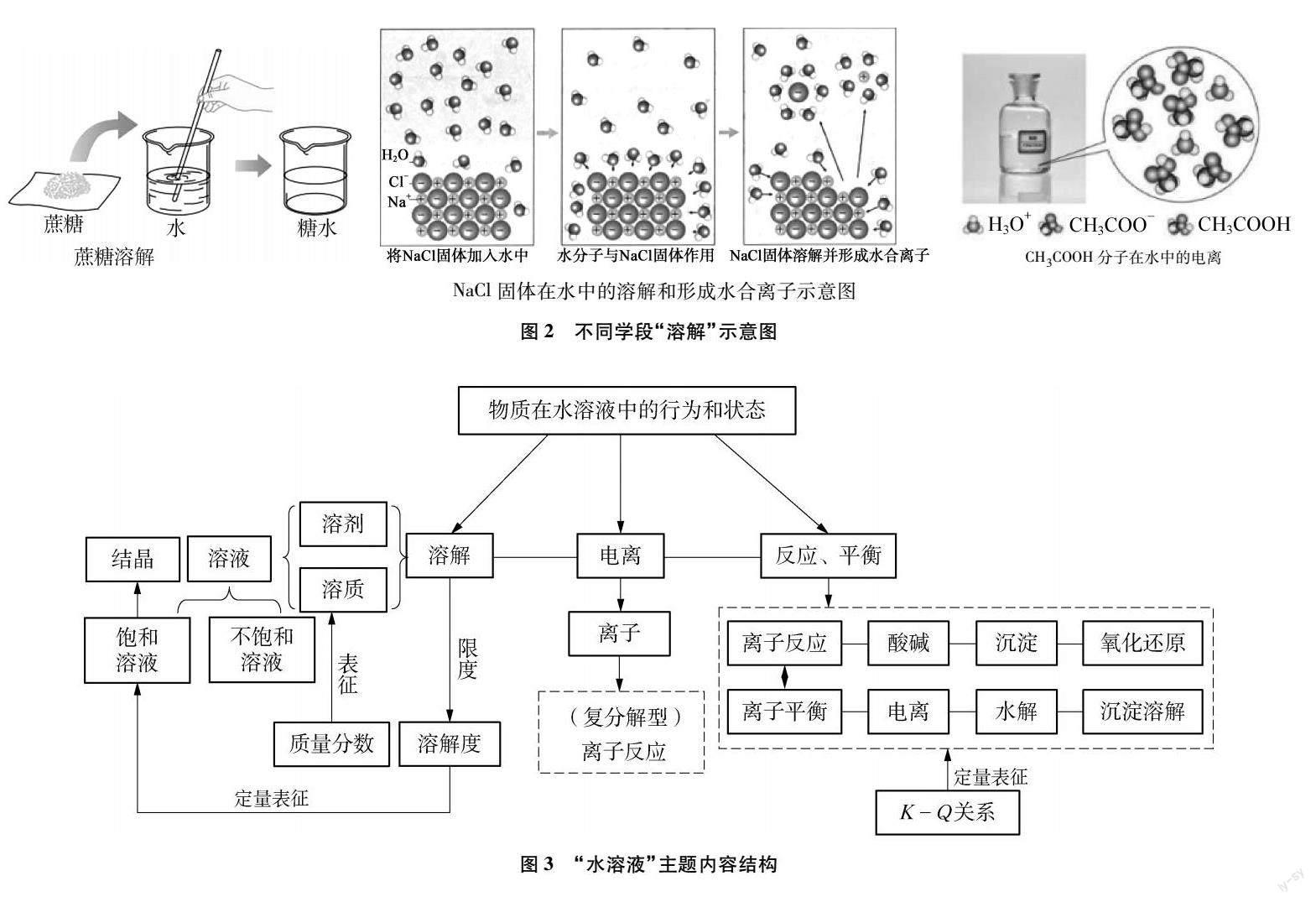
由表2可知,初、高中段都是將“水溶液”主題內容集中編排在同一學段的同一單元或章節。“溶液”“物質及其變化”“水溶液中的離子反應及平衡”三個單元/章標題緊緊圍繞“物質在水溶液中的行為和狀態”展開敘述,在不斷豐富水溶液認識角度的過程中建構“組成”和“限度”學科大概念。如初中段從溶解的視角以氯化鈉等溶液的形成為載體認識溶液是由溶質和溶劑組成的,以氯化鈉能否無限制溶解在水中為進階問題,認識溶解的限度(溶解度),最后在定量層面用質量分數對溶液濃度進行表征;高中必修段從微觀視角以氯化鈉在水溶液中電離的微觀過程為載體認識電解質溶液的組成,并能基于離子間的相互作用認識微粒在水溶液中的行為,從而對初中復分解反應進行再認識;高中選擇性必修段則進一步基于反應和平衡的視角認識水溶液中存在的弱電解質電離平衡、鹽類水解平衡、難溶電解質沉淀溶解平衡等,對離子反應的認識從復分解型擴大到酸堿、沉淀、氧化還原等多類,對電離的認識也從強電解質的完全電離進階到弱電解質的電離存在限度,并能通過平衡常數K定量表征電離、水解、沉淀溶解平衡等的限度。三個學段教科書在編排過程中除了關注認識視角的不斷豐富和大概念的建構外,還注意了前后之間的聯系。如認識溶解(見圖2),初中段主要是從物質水平認識溶解的現象,而高中必修段對物質溶解過程的認識上升到微觀電離水平,到了高中選擇性必修段對電離的認識進一步深化,用微觀示意圖表征了弱電解質電離的動態平衡。可見教科書對物質在水溶液中行為的認識逐步加深,從宏觀物質水平上升到微觀、動態平衡水平,將新內容建立在學生已有知識之上,體現了初、高中知識間的銜接。
基于上述分析,將“水溶液”相關的認識角度外顯、核心概念結構化,形成圖3的主題內容結構,進一步指導初、高中銜接性教學的開展。
3 “水溶液”主題內容的初、高中銜接性教學
3.1 主題教學情境
選取“侯氏制堿法”為主題教學情境,設計初、高中貫通的銜接性教學。“侯氏制堿法”是我國民族工業的驕傲,初、高中化學教材都有呈現,內容既關注情感維度的民族精神,又挖掘了認知維度的學科原理,具有多維教學價值。三個學段對情境的運用如圖4所示,促進學生對“水溶液”主題認識的三級進階。
3.2 教學目標
基于“水溶液”主題認識要求制定如表3所示的教學目標。需注意由于實施初、高中貫通的銜接性教學,教學中基于情境載體和學生水平(廈門市某校初中和高中實驗班學生進行教學實施)對新課標中的學段要求進行了融合處理,特別是在設計高中必修段教學時將教科書[6]拓展視野部分“弱電解質”內容融合進了此課時,使用時可根據學校實際靈活處理。
3.3 教學流程
結合圖5兩種制堿工藝,設計如表4所示的教學流程。
3.4 教學實施
教學流程中初中段教學對應“溶液”主題復習課,高中必修段教學對應“電解質的電離”新授課,選擇性必修段教學對應“水溶液中的離子平衡”復習課。由于篇幅所限,僅以初中段任務2、高中必修段和選擇性必修段任務3為例呈現教學實施情況,這三個任務是對同一問題在不同視角和水平的認識,是促進學生認識角度建立、鞏固的核心環節。
3.4.1 基于物質溶解度視角分析NaHCO3的析出原理和工藝條件
[教師提問]通過對“侯氏制堿工藝”在物質轉化層面的分析,知道了“吸氨”“碳酸化”兩步操作可生成NaHCO3,思考還可能生成什么?
[學生]從元素守恒角度分析CO2、 NH3、 H2O和NaCl反應,還可能生成NH4Cl或NH4HCO3(引導學生類比過量CO2與澄清石灰水的反應,明確CO2過量時生成碳酸氫鹽)。
[教師追問]NH4Cl、 NH4HCO3和NaHCO3都屬于可溶性鹽,為什么析出NaHCO3固體,而NH4Cl、 NH4HCO3未析出?
[學生]有可能是相同條件下三者在水中的溶解度不同。
[教師]提供表5溶解度數據。
[學生]在相同溫度下NaHCO3溶解度最小,當生成NaHCO3的量超過了其在特定溫度下的溶解度時就會有固體析出,而此條件下未達到其他幾種物質的溶解度,因此NH4Cl和NH4HCO3未析出。
[教師]根據表5繪制出NaCl和NaHCO3溶解度曲線,分析如何控制條件,提高NaHCO3的產量?
[學生]基于繪制的溶解度曲線,學生直觀認識到NaHCO3的溶解度受溫度影響程度遠超NaCl,因此部分學生認為直接采取降溫的方法以使更多的NaHCO3結晶;但也有學生提出如果先蒸發一部分溶劑,獲得NaHCO3飽和溶液,再降溫結晶能進一步提高產量。(注:雖然學生不知道加熱蒸發溶劑會使NaHCO3部分分解,但是學生頭腦中已經初步對“不飽和溶液飽和溶液結晶”之間建立了聯系,這正是本節課的核心目標。)
[教師梳理]“不飽和溶液飽和溶液結晶”間的轉化關系(見圖6),實現知識結構化[8]。
3.4.2 基于電離視角分析NaHCO3、 NH4Cl等物質的析出
[教師提問]從電離角度分析“吸氨”和“碳酸化”(通入過量CO2)兩步操作后體系中HCO-3大幅增加的原因。
[學生]NH3、 CO2溶于水后溶質分別為NH3·H2O和H2CO3,則體系中存在弱電解質NH3·H2O、 H2CO3的電離,電離出的H+和OH-反應,使得體系中剩余HCO-3和NH+4。
[教師補充]正是由于電離出的H+和OH-反應生成水,使得作為弱電解質的NH3·H2O、 H2CO3的電離程度大大增加,從而大大增加了HCO-3的量。
[學生]這也解釋了足量CO2和NH3的反應產物為什么是NH4HCO3(NH3+CO2+H2ONH4HCO3)。
[教師追問]從電離的角度分析“碳酸化”后體系的組成。
[學生]反應后,溶質為NaCl、 NH4HCO3,強電解質完全電離,體系中大量存在Na+、 Cl-、 NH+4、 HCO-3。
[教師]提供表5數據,如何從離子的角度解釋NaHCO3的析出?
[學生]工藝以飽和食鹽水為原料,存在大量Na+,隨著反應的進行,體系中HCO-3不斷增加,根據溶解度數據,相同條件下NaHCO3溶解度最小,因此只要Na+和HCO-3的濃度達到NaHCO3的溶解度,就會有固體析出。此外生產過程中只要不斷加入NaCl并通入NH3和CO2就能持續獲得產品。
[教師追問]大家是否同意“不斷加入NaCl并通入NH3和CO2就能持續獲得產品”的說法?
[學生]伴隨NaCl、 NH3、 CO2不斷加入,體系中Cl-和NH+4也會增加,如果不及時降低NH+4和Cl-濃度,NH4Cl、 NH4HCO3等也會析出。
[教師]那如何降低NH+4和Cl-的濃度?
[學生]由于NH4Cl溶解度受溫度影響大,可采用降溫結晶的方法,析出的NH4Cl還可用作氮肥,并且濾液中剩余的Na+、 Cl-還可循環利用。[注:學生通過NaHCO3、 NH4Cl析出的問題初步建立了分析水溶液體系的思路(電解質電離離子反應);此外雖然學生這時缺乏平衡知識,不能真正認識“侯氏制堿工藝”的循環原理,但依賴這種簡單處理,學生神奇地發現實際工業流程和自己的循環思路基本一致,成就感油然而生。]
3.4.3 基于平衡移動視角分析如何實現“母液”循環
[教師提問]“索爾維工藝”的最大缺點是Na+利用率低,并且合成氨工業的發展也使NH3循環的價值大大降低。為了中國民族工業的發展,愛國主義情懷驅動了侯德榜對這一工藝的革新。思考能否直接將“母液”循環?
[學生]母液中含有較高濃度的NH+4和Cl-,一方面根據“KQ關系”,體系中存在NaCl(s)Na+(aq)+Cl-(aq)平衡,高濃度Cl-不利于Na+濃度再增加;另一方面也會造成產品含大量雜質。
[教師]提供表5數據,如何減小Cl-濃度,增大Na+濃度?
[學生1]降溫結晶析出NH4Cl。
[學生2]不行,循環的目的是為了減少Na、 C元素的損失,如果直接降溫結晶通過表5數據發現還可能會析出NH4HCO3和NaHCO3。
[教師]能否從平衡移動視角分析“侯氏制堿工藝(圖5b)”中“母液I”→“母液Ⅱ”的循環原理?
[學生討論匯報]基于平衡移動視角分析離子濃度和種類變化(見圖7)。最終從“母液I”→“母液Ⅱ”,Na+濃度增加、Cl-濃度降低,HCO-3轉化為CO2-3,實現Na元素和C元素的循環利用,還能獲得大量氮肥。(注:此任務是在動態平衡水平上的系統綜合分析,需要關聯體系中多個反應,此任務除能幫助學生在原理水平上真正認識“侯氏制堿工藝”的創新性,還幫助學生建構了復雜水溶液體系分析的一般思路。此任務后,學生在課堂上自發地對侯德榜創新性的平衡思想豎起大拇指,潛移默化地培養了科學精神。)
參考文獻:
[1]中華人民共和國教育部制定. 普通高中化學課程標準(2017年版)[S]. 北京: 人民教育出版社, 2018.
[2]中華人民共和國教育部制定. 義務教育化學課程標準(2022年版)[S]. 北京: 北京師范大學出版社, 2022.
[3]王晶, 鄭長龍主編. 義務教育教科書·化學(九年級下冊)[M]. 北京: 人民教育出版社, 2012:25~42.
[4]王晶, 鄭長龍主編. 普通高中教科書·化學(必修第一冊)[M]. 北京: 人民教育出版社, 2019:5~20.
[5]王晶, 鄭長龍主編. 普通高中教科書·化學反應原理(選擇性必修1)[M]. 北京: 人民教育出版社, 2019:55~85.
[6]王磊等主編. 普通高中教科書·化學(必修第一冊)[M]. 濟南: 山東科學技術出版社, 2020.
[7][美]J. A. 迪安主編. 魏俊發等譯. 蘭氏化學手冊(第二版)[M]. 北京: 科學出版社, 2003.
[8]宮琦, 武衍杰, 王秀紅. 初中化學“溶液”主題項目式復習教學[J]. 化學教學, 2021,(9): 56~62.

