自噬在膀胱癌發展和治療中的研究進展
陳 詩,付 什,譚智勇,王劍松,王海峰
(昆明醫科大學第二附屬醫院泌尿外科/云南省泌尿系統疾病臨床醫學中心,云南 昆明 650101)
膀胱癌(bladder cancer,BC)是泌尿系最常見的惡性腫瘤之一,分為非肌層浸潤性膀胱癌(75%)和肌層浸潤性膀胱癌(20%~30%)[1]。膀胱癌在全球的發病率呈逐年上升趨勢,盡管經過科學的治療,仍具有較高的復發率或進展風險[2],促使許多研究者致力于尋找更加簡便、經濟、有效的預防和診療方法。
自噬即細胞“吃掉自己”的現象,通過降解細胞內成分和再利用降解產物,以滿足自身代謝需求和清除受損的細胞器,在維持細胞穩態中起重要作用[3]。近年來,研究者發現自噬參與了腫瘤發生、發展、轉移、耐藥等多種生物學過程,被認為是有巨大潛力的治療途徑[4]。因此,本文就自噬在膀胱癌發展和治療中的研究進展作一綜述。
1 自噬與腫瘤
巨自噬(簡稱自噬)是一種高度保守的分解代謝調控機制,負責以溶酶體依賴的方式大量降解細胞內大分子或受損的細胞器,用以合成新的成分和產生能量[5]。營養或生長因子缺乏、氧化應激、缺血缺氧狀態、衰老或受損的細胞器、錯誤折疊或聚集的蛋白質以及放、化療等應激刺激,可抑制mTOR 活性并通過磷酸化UNC-51 樣自噬激活激酶1 誘導自噬[6]。此時,胞質內會形成一個類似“脂質體”雙層膜結構,隨后向周圍延伸形成自噬泡。在延伸過程中,自噬泡吞噬細胞內的成分,如蛋白質聚集體或細胞器,最后與溶酶體融合形成自噬溶酶體,并將其內容物降解。最終自噬的降解產物(氨基酸、葡萄糖和游離脂肪酸等)將會被釋放回胞質中供細胞重新利用,用以維持和調節細胞動態平衡[7]。整個分解代謝過程受到16~20 個核心自噬相關基因(autophagyrelated gene,ATG)嚴格調控,且不同的應激刺激可通過不同的信號通路對自噬進行調節[8],如mTOR 信號通路、P53 信號通路、絲裂原刺激信號通路等。
隨著對自噬的深入研究,研究者證實自噬在癌癥發展和治療過程中兼具促癌和抗癌2 種不同的作用[9?10]。一方面,致死性或毒性自噬,也稱為自噬性細胞死亡,可導致細胞死亡增加。通過自噬調節聯合傳統的癌癥治療,能夠有效消除腫瘤細胞,降低復發率。而另一方面,保護性自噬則可以降解多余的細胞器和蛋白質產生能量,維持腫瘤細胞在營養缺乏、氧化應激、放化療等應激條件下生存并產生耐藥性。因此,本文總結了保護性自噬在膀胱癌發展中的作用以及自噬調節藥物在膀胱癌治療中的最新進展,為今后自噬調控藥物研發和腫瘤治療提供足夠的理論依據。
2 自噬與膀胱癌發展
自噬是細胞對環境變化的有效反應,在腫瘤形成的早期,能夠通過降解代謝維持細胞內蛋白質循環和細胞器更新,抑制腫瘤發生。而腫瘤發生后,自噬就成為腫瘤重要的保護機制,介導腫瘤發展和轉移。因此,筆者總結了自噬在膀胱癌發生和進展中的矛盾作用,以期為自噬作用于膀胱癌治療提供充分的理論依據,見表1。
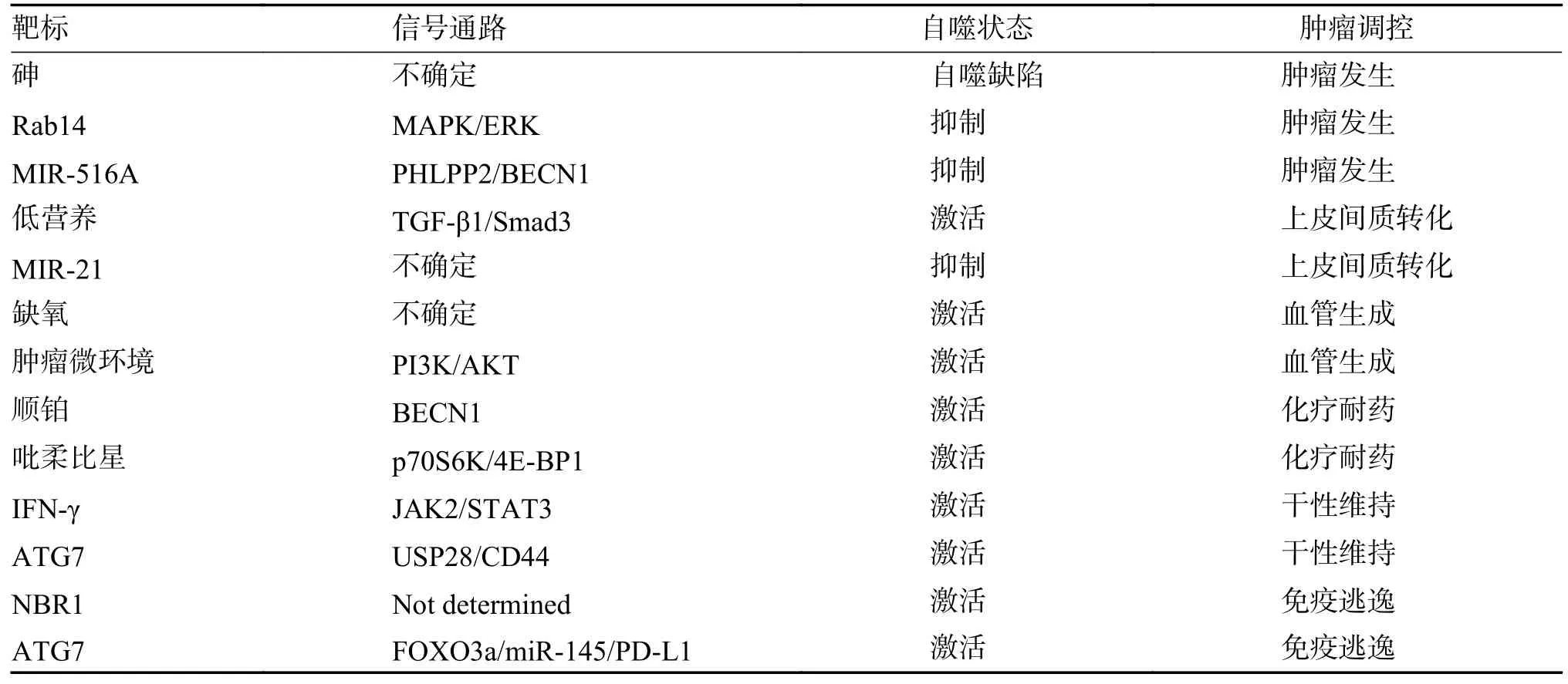
表1 自噬與膀胱癌發展Tab.1 Autophagy and the development of bladder cancer
2.1 自噬與膀胱癌發生
研究發現致癌物質砷可以通過氧化應激誘導尿路上皮細胞線粒體DNA 損傷和突變[11],而自噬缺陷會導致線粒體更新障礙,細胞內活性氧(reactive oxygen species,ROS)水平上調,基因不穩定性增加,促進細胞癌變[12]。此外,Chao 等[13]發現致癌蛋白Rab14 可通過MAPK/ERK 信號通路導致細胞代謝途徑改變,而自噬活性紊亂可導致該蛋白異常聚集,介導膀胱癌發生。這些結果表明,自噬是抑制腫瘤生成的關鍵機制,自噬受損可能導致腫瘤發生。Jin 等[14]發現MIR-516A 在膀胱癌組織中上調,并且實驗證實MIR-516A 能夠下調PHLPP2 表達,介導BECN1 蛋白降解抑制自噬,發揮致癌作用。所以,miRNA 能夠通過轉錄后調控,來實現對自噬相關基因的表達調節,依賴自噬促進膀胱癌發生。
2.2 自噬介導上皮間質轉化(epithelial-mesenchymal transition,EMT)
上皮間質轉化是上皮細胞失去細胞連接和細胞極性轉化為間質細胞的過程,是腫瘤細胞獲得侵襲和遷移能力的重要生物學機制。Tong 等[15]在低營養狀態下誘導膀胱癌細胞自噬活化,發現腫瘤侵襲和遷移能力增強,表現出間質細胞表型,進一步的機制研究發現自噬活化能通過TGFβ1/Smad3 信號通路促進膀胱癌細胞增殖、侵襲和遷移。miR-21 在胱癌組織中過度表達,為確定其在膀胱癌發展中的作用,Zhang 等[16]使用miR-21 模擬物轉染膀胱癌T24 細胞實現miR-21 表達上調,進一步研究發現miR-21 能夠抑制自噬誘導膀胱癌細胞發生EMT。可見,自噬在腫瘤EMT 中具有重要作用,自噬調控能夠抑制腫瘤發展和轉移,可作為腫瘤的治療靶點。然而因其兼具抑制或促進腫瘤EMT 的“雙重效應”,增加了通過靶向自噬治療膀胱癌的難度。
2.3 自噬促進血管生成
血管新生是原有血管通過“芽生”的方式形成的腔毛細血管的過程,是腫瘤發生和進展的重要生理過程。自噬參與調控細胞外基質降解、血管內皮細胞增殖、遷移和出芽與膀胱癌血管形成密切相關。研究表明在低血流、低氧、低營養的腫瘤微環境刺激下,血管內皮細胞能夠活化自噬促進其增殖、遷移[17]。Li 等[18]分別將膀胱癌T24 細胞與腫瘤相關的人臍靜脈內皮細胞在常氧和低氧條件下共培養,發現內皮細胞在缺氧的微環境中,自噬活性和糖酵解供能增加,表現出更強的增殖和遷移能力。Li 等[19]發現腫瘤微環境還可以激活膀胱癌細胞的分泌型自噬體,促進細胞外囊泡中活性組織蛋白酶B(CTSB)的分泌,從而通過TPX2/AURKA/PI3K/AKT 信號軸增強血管內皮生長因子A(VEGFA)表達,進而促進內皮細胞增殖、遷移和出芽。研究提示,腫瘤微環境誘導的自噬活化能夠促進腫瘤血管生成,介導腫瘤惡性進展。而抑制腫瘤和內皮細胞自噬,能夠抑制血管內皮細胞增殖、遷移和出芽,可能有助于抗腫瘤血管生成治療。
2.4 自噬促進化療耐藥
化療耐藥是腫瘤治療中的最大障礙,也是腫瘤進展和復發的根源。以順鉑為基礎的化療是膀胱癌的一線治療方法,Lin 等[20]使用順鉑處理膀胱癌T24 和5637 細胞,發現細胞自噬活化,自噬相關蛋白BECN1 表達增加,而聯合使用自噬抑制劑能顯著增強順鉑對膀胱癌細胞的毒性。吡柔比星也是膀胱癌常用的化療藥,盡管能顯著降低患者復發風險,但仍有10%~30%的患者會在5 a內復發和轉移,Li 等[21]將吡柔比星作用于膀胱癌細胞,發現吡柔比星可通過mTOR/p70S6K/4EBP1 信號通路誘導保護性自噬,介導腫瘤產生耐藥性。由此可知,化療藥物誘導的保護性自噬是腫瘤產生耐藥性的主要機制,而自噬抑制劑聯合常規抗癌藥有望為克服腫瘤耐藥性和改善臨床療效開辟新的可能。
2.5 自噬維持干性能力
腫瘤干細胞是一類具有自我更新能力并能產生異質性腫瘤細胞的細胞亞群,具有成瘤性高、多向分化、對放療化療不敏感等特點。自噬介導的腫瘤干性維持被認為是腫瘤復發和耐藥的關鍵因素之一。Ojha 等[22]培養了化療耐藥的原代膀胱癌細胞,通過檢測細胞自噬通量、干性能力及其耐藥的分子機制,研究發現吉西他濱和絲裂霉素可通過γ-干擾素介導的JAK2/STAT3 信號途徑誘導自噬,并通過上調糖酵解基因表達,促進腫瘤干性維持和產生耐藥性[23]。可見,自噬是腫瘤干性維持的重要機制。細胞自噬通過代謝重編程維持干細胞干性特征產生耐藥性,與腫瘤復發和轉移密切相關。CD44 被證明是腫瘤干性標志物,可以指示膀胱癌的干性能力,Zhu 等[24]發現自噬相關基因7(ATG7)可以抑制AUF1 蛋白表達,并通過 TET1/USP28/CD44 信號軸維持膀胱癌細胞干細胞樣特征,而敲低ATG7 基因后腫瘤細胞CD44 表達下調,且在干細胞成球實驗中成球能力顯著下降。由此推斷,自噬抑制能夠下調腫瘤干性能力,而利用自噬抑制劑建立安全、有效的聯合治療策略可能有助于克服耐藥性、降低復發率。
2.6 自噬介導免疫逃逸
腫瘤免疫逃逸是指腫瘤細胞通過各種機制避免被免疫系統識別和攻擊的現象,是腫瘤生存和發展的重要策略。主要組織相容性復合體(major histocompatibility complex,MHC)在抗原呈遞和T細胞增殖、活化中起關鍵作用,而腫瘤細胞MHC 可被NBR1 蛋白介導的自噬溶酶體途徑降解,導致腫瘤免疫逃逸[25]。同時,Alissafi 等[26]發現下調自噬相關基因5(ATG5)引起的自噬抑制則會提高細胞表面MHC 蛋白水平,促進CD4+T 細胞活化。研究提示,自噬活化能通過靶向MHC 分子降解從而幫助腫瘤細胞免疫逃逸。程序性細胞死亡受體1(PD-1)是一種重要的免疫抑制分子,而腫瘤細胞表面的PD-L1 能夠與T 細胞PD-1 結合使其活性抑制,Zhu 等[27]發現膀胱癌細胞內ATG7 可通過FOXO3a/miR-145 信號軸促進PDL1 的表達,介導腫瘤免疫逃逸。
綜上所述,自噬通過調控免疫檢查點、抗原抗原呈遞、T 細胞數量和活性在腫瘤免疫中發揮重要作用,可能是免疫治療失效的關鍵因素之一。靶向自噬可能是增強T 細胞對腫瘤殺傷能力的有效策略,有望幫助更多的癌癥患者收益于免疫治療。
3 自噬與膀胱癌治療
盡管自噬在腫瘤細胞中有諸多問題懸而未決,在臨床應用方面任重而道遠,但隨著自噬機制研究的進展,研究者發現自噬抑制能顯著增加腫瘤細胞對放、化療藥的敏感性;而自噬過度激活則可引起腫瘤細胞自噬性死亡。越來越多的資料顯示自噬作為一種新型抗癌機制,在腫瘤治療中具有巨大的潛力。所以,筆者總結了臨床前和臨床研究中靶向自噬的膀胱癌治療,見表2。
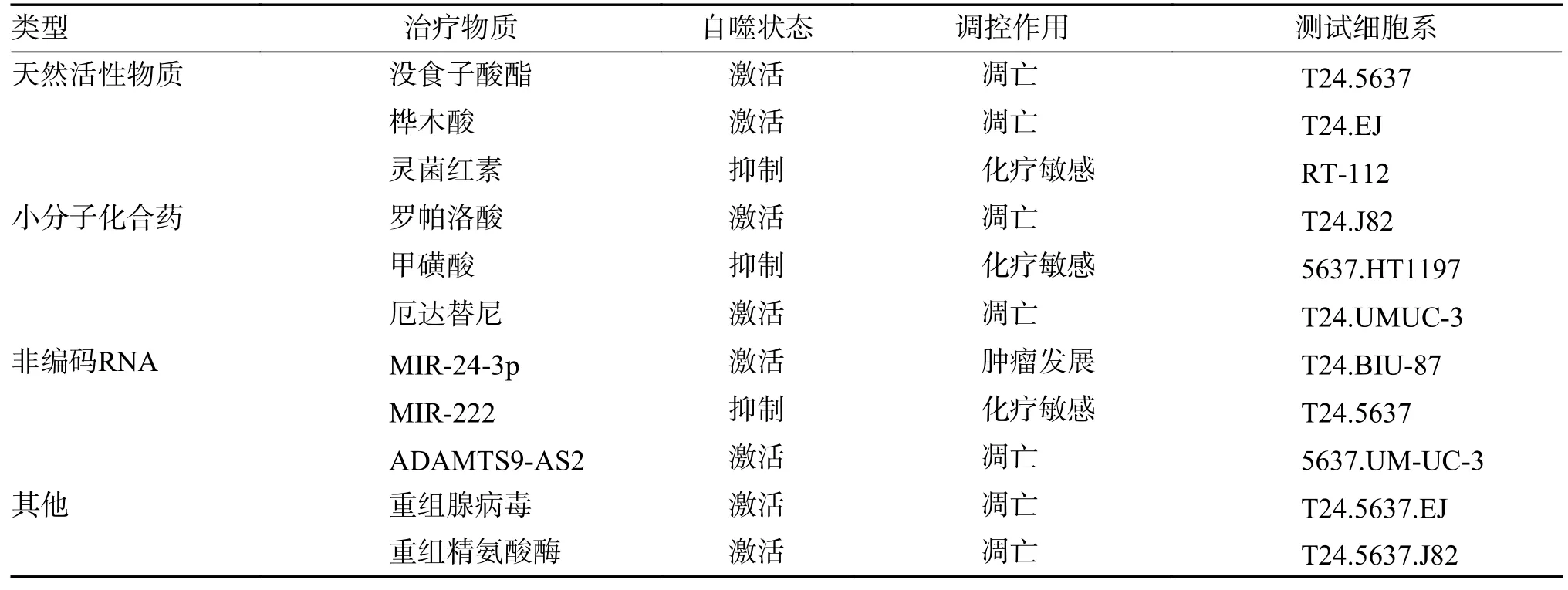
表2 膀胱癌中的靶向自噬治療Tab.2 Targeted autophagy therapy in bladder cancer
3.1 天然活性物質
天然活性物質是從動、植物或微生物中提取的具有獨特功能和生物活性的物質,已被證明能通過自噬調控作用抑制腫瘤生長或增強放、化療的敏感性。例如,表兒茶素沒食子酸酯(epigallocatechin gallate,EGCG)是從綠茶中提取的活性物質,其通過調節LC3-II 和BECN1 自噬相關蛋白的表達,誘導膀胱癌細胞發生自噬相關凋亡[28]。樺木酸是從白樺樹皮中提取的五環三萜化合物,可以通過 AMPK/mTOR/ULK1 途徑誘導膀胱癌細胞自噬,發揮出抗膀胱癌作用[29]。天然活性顯示出的抑癌的作用依賴于自噬活化,而阻斷自噬則會顯著減弱抗癌作用,這表明自噬過度激活可導致腫瘤細胞自噬性死亡。此外,天然活性物質能夠抑制保護性自噬,加強化療藥物的腫瘤殺傷效果。Berning 等[30]發現由鏈霉菌發酵產生的靈菌紅素能夠抑制膀胱癌細胞溶酶體組織蛋白酶B 和L 活性,減少自噬溶酶體數量來抑制自噬,進而增強順鉑的細胞毒性。這提示我們,靶向自噬調控的天然物質不僅能夠抑制腫瘤細胞生長,而且能夠降低耐藥性。同時由于存在經濟、獲取便捷、藥物副作用少等優勢,其單獨或與常規細胞毒性藥物聯合應用,可能會是一種新型癌癥治療策略。
3.2 小分子化合藥
小分子藥物主要是指分子量小于1000 的有化學合成藥物,具有使用廣泛,理論成熟等優勢,在抗癌領域中表現出巨大優勢。Hung 等[31]發現羅帕洛酸能通過MAPK 途徑誘導細胞內線粒體ROS 產生,介導膀胱癌細胞自噬相關凋亡和周期阻滯,發揮抑癌作用。甲磺酸是BH3 模擬物類化合物,能夠特異性抑制Bcl-2 蛋白,Guerrero 等[32]將甲磺酸和紫杉醇聯合作用于膀胱癌細胞,發現甲磺酸能夠抑制細胞自噬,誘導周期阻滯,顯著增強紫杉醇的促凋亡效果。厄達替尼是一款FGFR 抑制劑,已被FDA 批準用于治療晚期或轉移性膀胱癌,而研表明實厄達替尼在膀胱癌治療過程中也能夠上調自噬活性,誘導自噬相關凋亡和周期阻滯,抑制腫瘤細胞的侵襲和遷移[33]。由此可知,自噬相關的靶向小分子藥在腫瘤治療和藥物開發中具有廣闊的前景,無論是其單獨還是聯合應用,都將會是一種非常有潛力的腫瘤治療手段。
3.3 非編碼RNA
miRNA 水平失調不僅與細胞癌變有關,而且會影響腫瘤的生長和進展。例如,miR-24-3p 在膀胱癌組織中高表達,可通過LC3、P62、DEDD蛋白參與膀胱癌細胞自噬調控,促進腫瘤增殖、侵襲和遷移[34]。此外,Zeng 等[35]發現下調miR-222 通過PPP2R2A/Akt/mTOR 信號軸抑制自噬,不僅能抑制膀胱癌細胞增殖,而且增強腫瘤對順鉑的敏感性。這表明,調控自噬活性的miRNA 水平變化能夠對癌細胞的存活和藥物敏感性產生重要影響。長鏈非編碼RNA ADAMTS9-AS2 在膀胱癌細胞中下調與腫瘤惡性程度負相關,研究發現作為膀胱癌中的抑瘤因子,其能夠靶向調控自噬相關蛋白LC3-I/II 和BECN1,抑制膀胱腫瘤細胞的增殖、遷移和侵襲[36]。以上研究提示,自噬相關非編碼RNA 作為靶點可能在膀胱癌治療中具有光明的前景,然而遺憾的是在實際使用中其分子機制、藥物的安全性和有效性尚不明確,仍需大量的臨床試驗去研究和探索。
3.4 其他
癌癥病毒療法是利用腺病毒來攻克癌細胞的新方法,Shang 等[37]開發了一種可以表達凋亡誘導基因的重組腺病毒Ad-VT,發現Ad-VT 能夠在膀胱癌異種移植小鼠模型中選擇性復制,發揮溶瘤作用,進一步研究其抗癌機制發現,Ad-VT可通過AMPK/Raptor/mTOR 信號途徑誘導膀胱癌細胞自噬,抑制腫瘤生長。氨基酸剝奪是癌癥治療的一種新策略,通過精氨酸耗竭來阻斷腫瘤細胞獲得所必需的營養,從而阻礙癌細胞生長,Zhao 等[38]發現重組精氨酸酶1 在降低精氨酸水平的同時,能夠上調細胞活性氧水平并通過AKT/mTOR 信號通路誘導膀胱癌細胞自噬相關凋亡。綜上所述,自噬激活劑和抑制劑的應用為開發新型膀胱癌治療提供了新的見解。由于目前膀胱癌患者主要采用手術與放療或化療聯合的治療策略,因此能夠增加癌細胞對放、化療的敏感性自噬抑制劑(包括氯喹和3-甲基腺嘌呤)可能在膀胱癌治療中更具優勢。但筆者相信隨著自噬在腫瘤中作用機制的完善,以及更多自噬靶點抗癌藥問世,自噬激活劑也將成為腫瘤治療的新方案。
4 小結
隨著腫瘤中自噬的研究進展,自噬在膀胱癌預防和診療中的作用越來越明確,展現出廣闊的臨床應用前景。尤其自噬相關蛋白在腫瘤預后評估以及克服耐藥性中的價值一直是近幾年研究的熱點。然而自噬用于腫瘤治療要實現臨床轉化主要面臨著以下幾點挑戰:根據腫瘤細胞成分、治療方式和所處微環境的變化,自噬這把“雙刃劍”可表現出抑癌或促癌作用,并且自噬相關蛋白數量龐大,信號調節途徑錯綜復雜,稍有不慎將與我們的意愿背道而馳。其次,自噬相關抗癌藥仍以我國傳統中草藥提取的活性物質為主,且在不同類型和階段的腫瘤中,其臨床效果和安全性尚不確定。盡管自噬應用于腫瘤治療某些方面還存在不足,但相信隨著自噬機制研究的不斷深入以及動物實驗和臨床試驗的完善,這些困難都將迎刃而解,成為膀胱癌預防、診斷、和治療的新突破。

