糖皮質激素替代劑量對腺垂體功能減退癥患者激素暴露的影響
夏友娟,曹衛娟
0 引言
腺垂體功能減退癥(Hypopituitarism,HP)是指由于下丘腦和(或)垂體全部或大部分受損累及性腺、甲狀腺、腎上腺軸,導致一種或多種垂體前葉激素分泌不足所致的內分泌功能減退綜合征[1]。糖皮質激素(Glucocorticoid,GC)替代是HP患者治療的基石。最近研究報道,根據當前對每日皮質醇產生率和口服氫化可的松(Hydrocortisone,HC)生物利用度的測量發現,健康成年人每天的皮質醇產生率為5.2~8.8 mg/m2,平均每天皮質醇產生率約7 mg/m2,相當于HC替代劑量15~25 mg/d,中間HC替代劑量為20 mg/d[2-4]。鑒于HP患者皮質醇生成率較低,而等劑量外源性激素替代高于內源性皮質醇生成率,將可能導致超生理劑量的激素水平。文獻報道,超生理劑量GC(30 mg/d)替代激素暴露的風險明顯增加[2,5],但生理替代量或小劑量是否亦存在激素暴露風險尚不明確。本研究擬采用回顧性分析HP患者服用不同劑量的GC發生激素暴露的風險,探討生理劑量尤其小劑量GC替代能否在保證良好生活質量基礎上降低激素暴露發生風險,旨在為HP患者尋找合理個性化GC替代劑量。
1 材料與方法
1.1 研究對象
1.1.1 入選標準 選取2010年1月至2020年12月于湖南師范大學附屬湘東醫院和湖南師范大學第一附屬醫院確診的192例HP患者的臨床資料進行回顧性分析。①年齡18~80歲,配合隨訪的患者;②HP診斷標準符合《2016年美國內分泌學會臨床實踐指南:成人垂體機能減退癥激素補充治療》[3];③至少含促腎上腺皮質激素(ACTH)缺乏并服用糖皮質激素替代的患者;④所有患者均接受1年以上穩定GC劑量替代治療;⑤檢驗檢查資料完整。其中男81例,女111例,年齡18~80歲,平均年齡(55.30±12.59)歲。本研究通過湖南師范大學附屬湘東醫院和湖南師范大學附屬第一醫院倫理委員會批準[湘東倫審2022第(002)號]。
1.1.2 排除標準 ①妊娠期及哺乳期女性;②激素替代治療前存在相關疾病影響本研究結果;③一過性腺垂體功能減退;④合并垂體后葉受損。
1.2 方法
1.2.1 收集資料 查閱HP患者病歷,收集病史、人口學特征、常規生化指標、激素水平及影像學檢查(心電圖、垂體MRI、骨密度檢查等)、糖皮質激素替代種類及劑量、內分泌系統(向心性肥胖、糖尿病)、心血管系統[高血壓、血脂異常、非酒精性脂肪肝病(Non-alcoholic fatty liver disease,NAFLD)、冠心病、心肌梗死]、骨骼系統(低骨量、骨質疏松、股骨頭壞死)、消化系統(慢性胃炎、消化性潰瘍、消化道出血)、神經精神系統(精神癥狀)。
1.2.2 研究分組與隨訪 參照 Dineen等[6-7]2項前瞻性研究,所有未接受HC的患者按照氫化可的松當量(Hydrocortisone equivalent,HCeq)計算,根據患者出院后服用GC替代劑量分為小劑量組(HCeq<20 mg/d)(37例)、生理劑量組(HCeq=20 mg/d)(53例)、超生理劑量組(HCeq≥30 mg/d)(102例),部分藥物劑量予等價替換[3](20 mg HC=5 mg醋酸潑尼松=4 mg甲潑尼龍),分別占總體的19.3%、27.6%和53.1%。隨訪患者出院后服用GC劑量、其他激素替代及激素暴露的情況。
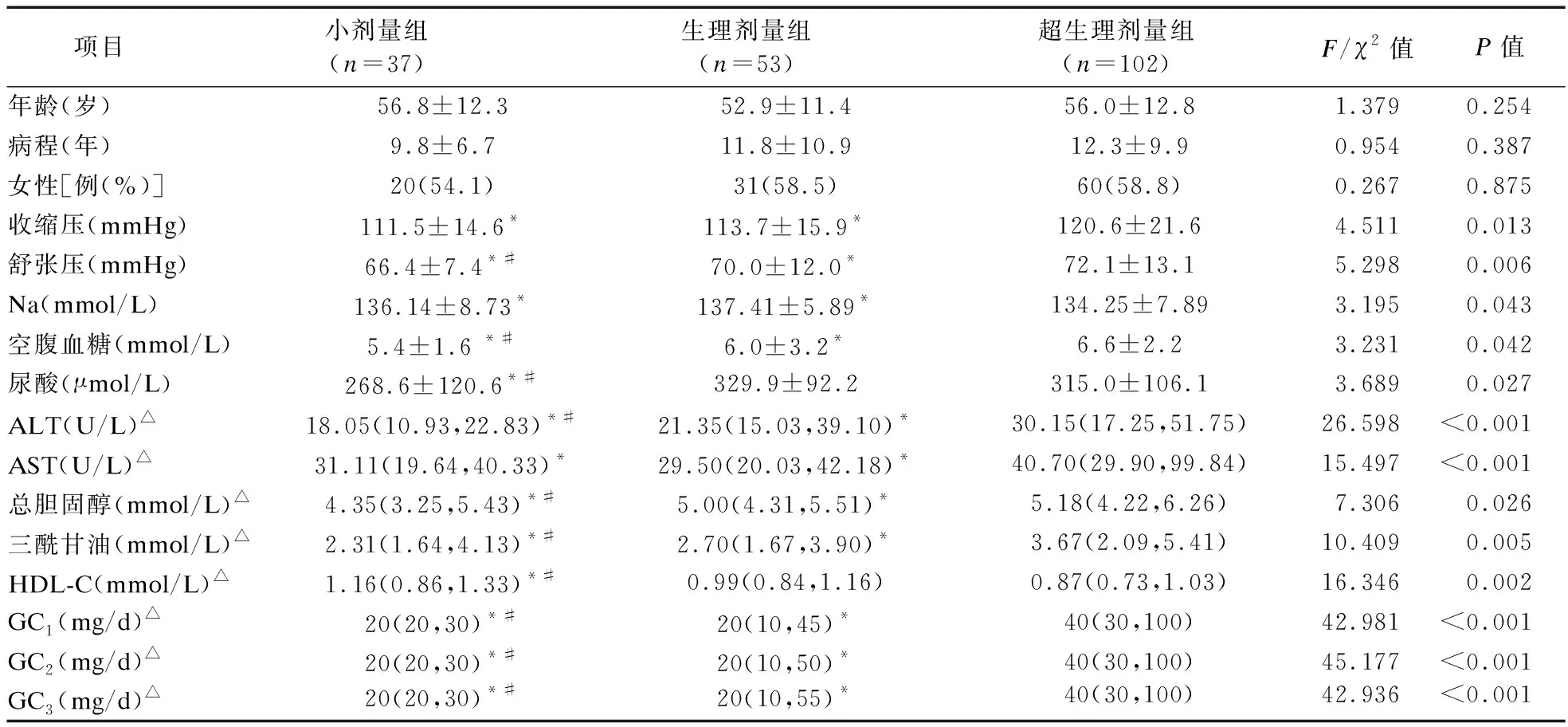
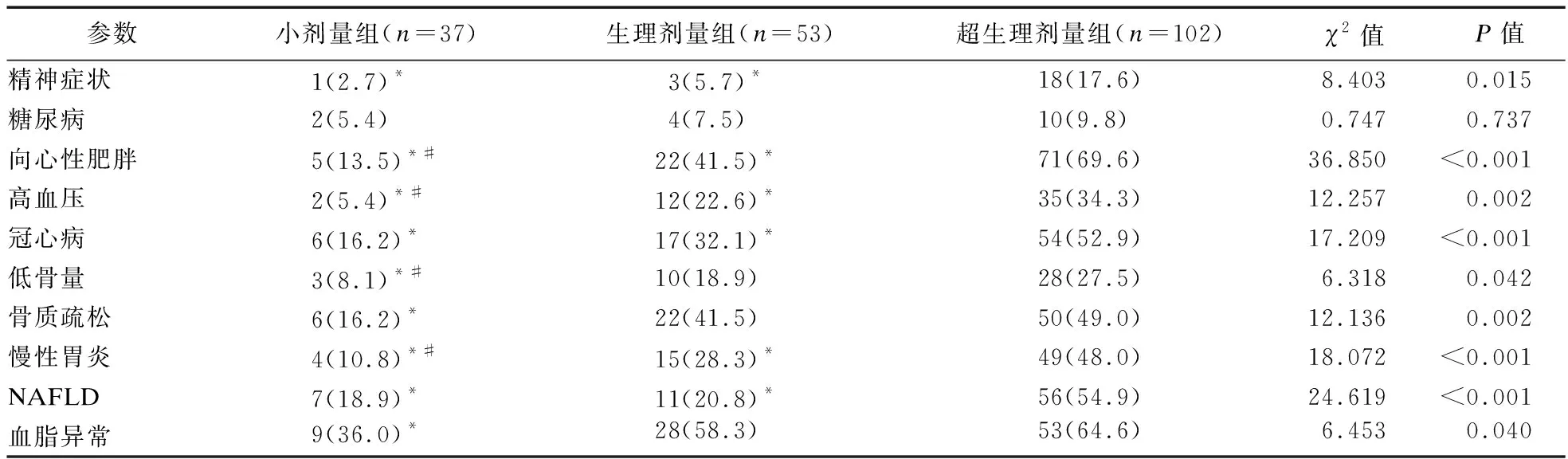
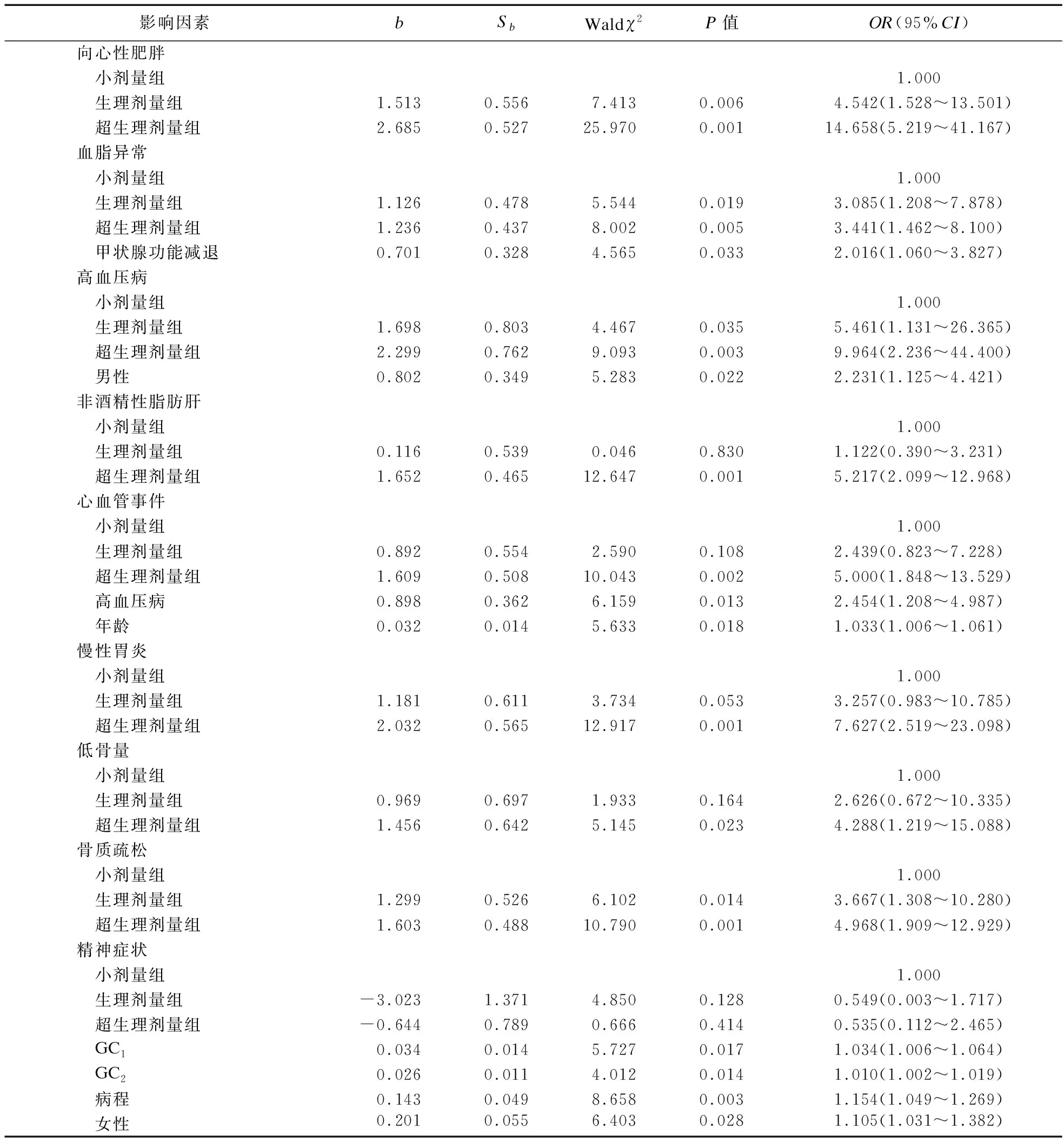
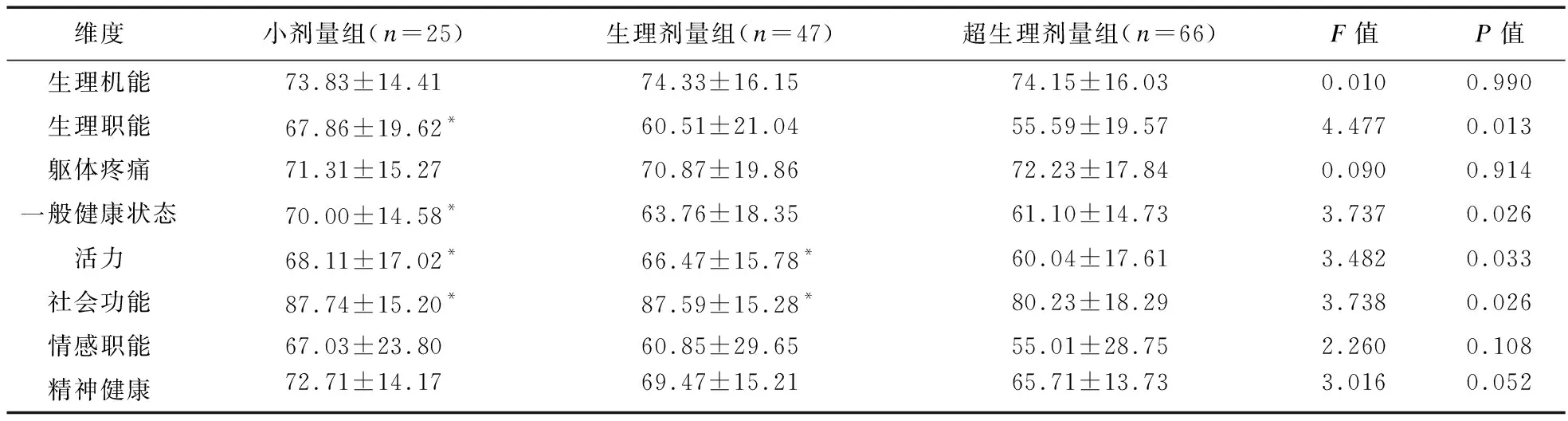
1.2.3 激素暴露的定義 ①高血壓病:參照《中國高血壓防治指南》[8];②糖尿病、向心性肥胖:參照《中國2型糖尿病醫療標準》(2019年版)[9];③心血管事件:診斷為冠心病、心力衰竭、心肌梗死、冠狀動脈重建術或心血管死亡的住院治療復合終點[10];④低骨量和骨質疏松癥:DXA測量分別為腰椎或髖部的-2.5 2.1 三組患者一般臨床資料比較 三組患者性別、年齡、病程差異無統計學意義。本研究中,有102例患者長期規律服用超劑量GC替代治療,占總體53.1%,與規律服用小劑量GC(19.3%)、生理劑量GC(27.6%)患者相比,超生理劑量組收縮壓(SBP)、舒張壓(DBP)、空腹血糖(FBG)、尿酸(UA)、ALT、AST、總膽固醇(TC)、三酰甘油(TG)、GC1、GC2、GC3更高,HDL-C更低,差異均有統計學意義(P<0.05),故超劑量GC可影響HP患者的血壓、血糖、血脂等代謝指標。見表1。 表1 三組患者基線指標比較 2.2 三組患者激素暴露發生情況比較 超生理劑量組激素暴露的人數最多,主要表現為精神癥狀、向心性肥胖、高血壓、冠心病、低骨量、骨質疏松、慢性胃炎、NAFLD、血脂異常,差異均有統計學意義(P<0.05)。①與超生理劑量組相比,小劑量組、生理劑量組精神癥狀、向心性肥胖、高血壓、冠心病、慢性胃炎、NAFLD的發生率較低,小劑量組低骨量、骨質疏松、血脂異常發生率較低,差異均有統計學意義(P<0.05);②與生理劑量組相比,小劑量組向心性肥胖、高血壓、低骨量、慢性胃炎的發生率低,差異有統計學意義(P<0.05)。見表2。 表2 糖皮質激素替代劑量對激素暴露發生情況比較 2.3 多因素二元Logistic回歸分析 分別以單因素分析中有統計學意義的變量作為因變量,以GC替代劑量和其他對因變量有影響的變量為自變量,進行Logistic分析(α入=0.05,α出=0.10),模型中設定因變量和自變量(如心血管事件:GC劑量、年齡、性別、向心性肥胖、糖尿病、高血壓、血脂異常、NAFLD),Logistic回歸分析結果顯示,以小劑量組為參照,生理劑量及超生理劑量GC是向心性肥胖、血脂異常、高血壓病、骨質疏松的危險因素(P<0.05),超生理劑量GC是NAFLD、心血管事件、慢性胃炎、低骨量的危險因素(P<0.05),甲狀腺功能減退是血脂異常的危險因素(P<0.05),男性是高血壓病的危險因素(P<0.05),高血壓病、年齡是心血管事件的危險因素(P<0.05),GC1、GC2、女性、病程是精神癥狀危險因素(P<0.05)。見表3。 表3 多因素二元Logistic回歸分析結果 2.4 生活質量評估 生活質量評估采用SF-36表[15],共隨訪138例患者(71.9%),54人失聯;與超生理劑量組相比,小劑量、生理劑量組在活力、社會功能維度上得分較高,小劑量組更高,差異有統計學意義(P<0.05),與超生理劑量組相比,小劑量組在生理職能、一般健康狀態維度上得分較高,差異有統計學意義(P<0.05)。見表4。 表4 GC替代劑量治療的生活質量評比 研究表明,腺垂體功能減退的發病率逐年增加,激素替代治療是迄今為止唯一的治療選擇。GC替代是治療的基石,激素替代治療的目標是以最小有效劑量去緩解臨床癥狀,最大程度地優化生活質量[1]。Husebye等[4]研究表明,對繼發性腎上腺皮質功能不全的患者,推薦每日HC劑量為15~25 mg,分2~3次替代治療,而部分患者服用的生理替代劑量遠高于此。多個研究發現,經常暴露于相對過量的糖皮質激素機體,代謝性疾病、骨密度降低、心血管疾病和死亡風險增加,生活質量嚴重受損[2,5]。 目前,國內外對HP的研究多集中于病因、臨床表現、常規生化等指標的分析上,對于不同劑量GC替代治療對HP患者激素暴露的影響研究較少,甚至國內外文獻沒有標準的GC劑量的定義。本研究以Dineen等[6-7]2項前瞻性研究作為參考,將HP患者分為3組,以GC替代劑量(HCeq<20 mg/d)及(HCeq≥30 mg/d)作為切值,進一步了解不同組別患者激素暴露程度差異。本研究中不同GC替代劑量的HP患者在性別、年齡、病程上未見差異。與國內外大樣本研究相類似,與低劑量組、生理劑量組對比,超生理劑量組患者SBP、DBP、FBG、UA、AST、ALT、TC、TG、GC1、GC2、GC3更高,HDL-C更低,差異均有統計學意義。說明超生理劑量GC可影響HP患者的血壓、血糖、血脂等代謝指標,導致機體糖脂代謝紊亂。Danilowicz等[16]研究證實,GC替代劑量從每日30 mg降低至15 mg可減少腹部脂肪、降低血脂水平和改善生活質量。Behan等[7]研究將10例ACTH缺乏癥患者隨機分配到3種HC劑量方案:30 mg/d、20 mg/d和15 mg/d,結果表明,服用15 mg/d HC劑量的患者動脈硬化程度更低,夜間血壓下降更具生理性。以上研究報道與本研究生化指標提示的結果相符,即超生理劑量GC更易導致糖脂代謝紊亂,激素暴露風險更高。 本研究結果顯示,超生理劑量組激素暴露風險顯著高于小劑量、生理劑量組,激素暴露主要包括向心性肥胖、血脂異常、NAFLD、高血壓病、骨質疏松或低骨量、冠心病等代謝性疾病。與小劑量、生理劑量組相比,超生理劑量組向心性肥胖、高血壓病、血脂異常、NAFLD發生率更高,且超生理劑量組心血管疾病(Cardiovascular disease,CVD)發生率高于小劑量、生理劑量組。這與既往研究報道相符,超生理劑量GC可通過誘導代謝綜合征(Metabolic syndrome,MS):如肥胖、高血壓、胰島素抵抗、糖脂代謝異常等增加CVD危險因素[17-18]。本研究Logistic回歸分析結果顯示,以小劑量組為參照,超生理劑量GC(OR=5.000)、高血壓病(OR=2.454)、年齡(OR=1.033)為心血管事件的獨立危險因素。既往研究顯示,GC劑量是CVD的危險因素,超生理劑量GC促使脂肪等代謝組織過度表達11β-羥基類固醇脫氫酶-1,出現內臟肥胖、胰島素抵抗、血脂異常和高血壓等MS表現,且非生理性皮質醇暴露于血管內皮和免疫系統,加速動脈粥樣硬化進展[17]。Li等[19]研究發現,MS患者存在左心室肥大、收縮功能受損以及舒張期充盈減少,其可能機制是血管緊張素II的反應增強和過量GC誘導的鹽皮質激素受體激活,導致心肌纖維化、心室重構、舒張功能受損,最終導致心力衰竭。眾所周知,高血壓是冠心病、心肌梗死、心力衰竭等心血管疾病發生發展的危險因素。陳宏等[20]研究發現,高血壓發展為冠心病大約需6年,未罹患高血壓人群發展為冠心病平均11年,表明高血壓在促進動脈粥樣硬化進程中起著關鍵作用,血壓升高可以激活血管緊張素-醛固酮系統,血管收縮導致冠脈狹窄甚至冠脈痙攣,繼發心血管事件。年齡是CVD不可改變的危險因素,隨著年齡增長,人體血管壁彈性下降,CVD風險增加[21]。因此,認識GC替代劑量與心血管危險因素之間的關聯,建議使用最低可耐受HC替代劑量,以及積極篩查和管理心血管危險因素降低CVD風險,改善患者生活質量。 GC誘導的骨質疏松(Glucocorticoid-induced osteoporosis,GIOP)是長期大劑量GC導致的最常見繼發性骨質疏松,臨床表現為骨量減少、骨質疏松甚至股骨頭壞死。我國一項納入3 136例GC治療患者的研究發現,高達90%的患者存在骨量減少或骨質疏松,其中骨質疏松患病率為41.4%[22]。本研究Logistic回歸結果顯示,超生理劑量GC(OR=4.288)是低骨量的危險因素,生理劑量(OR=3.667)、超生理劑量(OR=4.968)為骨質疏松的獨立危險因素。Ragnarsson等[23]研究表明,GC替代治療可降低骨密度,是骨骼系統受損的獨立危險因素。Schulz等[24]前瞻性研究報道,減少HC替代劑量會導致骨密度增加,增加HC替代劑量骨密度降低,證實小劑量HC更有利于骨形成。GC可能通過促進破骨細胞的分化和成熟來增加骨吸收、加速成骨細胞和骨細胞的凋亡,抑制成骨細胞生成導致骨形成減少[6]。因此,應將GIOP視為可預防的疾病,終生GC替代的患者應給予最小有效替代劑量,并改善生活方式,預防性補鈣治療。 本研究Logistic回歸分析結果顯示,入院第1天GC劑量(OR=1.034)、第2天GC用量(OR=1.010)、病程(OR=1.154)、女性患者(OR=1.105)是精神癥狀發生的危險因素,提示病程長的女性患者對GC替代劑量更為敏感。Chatterjee等[25]研究報道席漢綜合征患者每日服用30 mg HC和25 μg甲狀腺素替代后,出現了精神行為異常表現,改用每日20 mg HC和25 μg甲狀腺素,精神癥狀逐漸緩解。這可能是由于腦皮質醇水平急劇下降和糖皮質激素受體的負反饋抑制減少,長期皮質醇缺乏的患者對外源性類固醇的敏感性增加所致。因此,在HP患者救治中,GC與精神癥狀的發生呈劑量和時間依賴性,暫停治療或減少GC劑量可緩解,特別對于病程長的患者,需小劑量GC啟始,個性化地調整劑量。 多個研究顯示,與健康受試者或服用低劑量GC患者相比,超劑量GC替代治療患者的生活質量受損,對整體健康的認知降低[26-27]。Ragnarsson等[28]回顧性研究證實,GC劑量與生活質量呈劑量依賴性惡化,每日使用10 mg HCeq的患者生活質量最好,接受25 mg HCeq患者的生活質量最差,推測生活質量與HC劑量之間的負相關可能是由于HP患者非特異性癥狀而經驗性增加HC劑量所致。本研究顯示,與生理劑量、超生理劑量組對比,小劑量組在生理職能、一般健康狀態、活力、社會功能4個維度上評分均較高,說明小劑量GC替代可改善生活質量,仍強調個性化調整劑量改善預后。由于目前GC替代療法無法模擬皮質醇分泌的晝夜節律,且缺乏可靠的臨床生化監測指標,劑量調整主要依賴于患者的癥狀及體征,替代過量或不足是導致HP患者生活質量受損的重要原因。因此,避免GC替代過度或不足,需遵循個體化替代原則,盡可能以最小有效劑量緩解皮質醇不足的癥狀同時又避免激素暴露,加強自我管理可改善生活質量。 綜上所述,本研究發現超生理劑量GC是導致HP患者激素暴露的危險因素,建議予以個性化、小劑量GC替代降低激素暴露風險,改善生活質量。由于目前GC替代療法無法模擬皮質醇分泌的生理節律,且缺乏可靠的臨床生化監測指標。因此,開展更可靠的檢測方法和研發更符合生理節律的GC替代制劑為當前亟待解決的問題,有待多領域合作研究。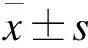
2 結果
3 討論

