早期胃癌患者內鏡黏膜下剝離術血清IL-35、PECAM-1水平變化及臨床意義
李艷玲 翟莎娜 楊君華
1 邯鄲明仁醫院,河北省邯鄲市 056001; 2 清華大學附屬垂楊柳醫院
胃癌是一種常見消化系統惡性腫瘤,是第三大癌癥死亡原因,全世界大部分地區的5年相對生存率約為20%,嚴重威脅人群的生命健康[1]。早期胃癌由于淋巴結轉移率較低,病灶僅限于黏膜或黏膜下層,內鏡黏膜下剝離術(ESD)被臨床上用于治療早期胃癌的主要手段之一,但ESD術后部分患者會發生局部復發。白介素(IL-35)屬于IL-12家族的成員、血小板內皮細胞黏附分子-1(PECAM-1)屬于免疫球蛋白超家族,兩者在臨床上被用于胃癌的鑒別診斷指標,但有關兩者在ESD術后復發的研究尚少[2-3]。本研究探討早期胃癌患者內鏡黏膜下剝離術(ESD)血清IL-35、PECAM-1水平變化及臨床意義,以期為臨床診治提供理論依據,現將結果報道如下。
1 資料與方法
1.1 一般資料 選取2013年1月—2016年10月在本院行ESD術的359例早期胃癌患者,失訪33例,最終納入326例作為研究組;同時選取本院65名同期健康體檢人員作為對照組。納入標準:胃鏡下活組織病理證實為EGC;年齡≥18歲;病灶局限于胃黏膜或黏膜下層且經CT和超聲內鏡證實未見淋巴結或遠處轉移;行ESD術患者;患者及家屬均知情同意。排除標準:伴有其他腫瘤者;伴有嚴重感染或凝血障礙;伴有精神疾病或者拒絕配合者;伴有心、肝、腎等器官功能障礙者;既往因胃癌行手術者;術后失訪者。
1.2 方法 研究對象入組后,收集年齡、性別、BMI、疾病史等臨床資料;早期胃癌患者行ESD術,患者行全身麻醉,采用日本Olympus GIF-Q260J電子胃鏡進鏡后用Dual刀在病變外緣0.5~1cm處電凝標記病變范圍,在病灶范圍黏膜下多點注射氯化鈉、亞甲藍、腎上腺素混合液,使病灶明顯抬舉,應用Dual刀環周切開病灶黏膜,數次實施黏膜下注射并逐步剝離黏膜下層。隨時做好止血,仔細觀察創面,當創面出現可見血管時,熱止血鉗處理創面,確定創面無活動性出血后即可退鏡。ESD術后第2天空腹靜脈血2~3ml,離心分離血清備用。采用酶聯免疫吸附法檢測血清IL-35和PECAM-1水平,嚴格按照IL-35和PECAM-1的試劑盒說明書進行操作。早期胃癌患者ESD術后隨訪5年,每年1次胃鏡復查患者腫瘤復發的情況。根據復發情況,分為復發組(n=31)和未復發組(n=295)。
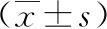
2 結果
2.1 研究組和對照組血清IL-35、PECAM-1水平比較 研究組血清IL-35、PECAM-1水平高于對照組,差異具有統計學意義(P<0.05),見表1。
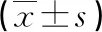
表1 研究組和對照組血清IL-35、PECAM-1水平比較
2.2 復發組和未復發組基本資料比較 復發組和未復發組年齡、性別、BMI、分化程度比較,差異無統計學意義(P>0.05);腫瘤直徑、術前超聲內鏡檢查和浸潤深度比較,差異有統計意義(P<0.05),見表2。
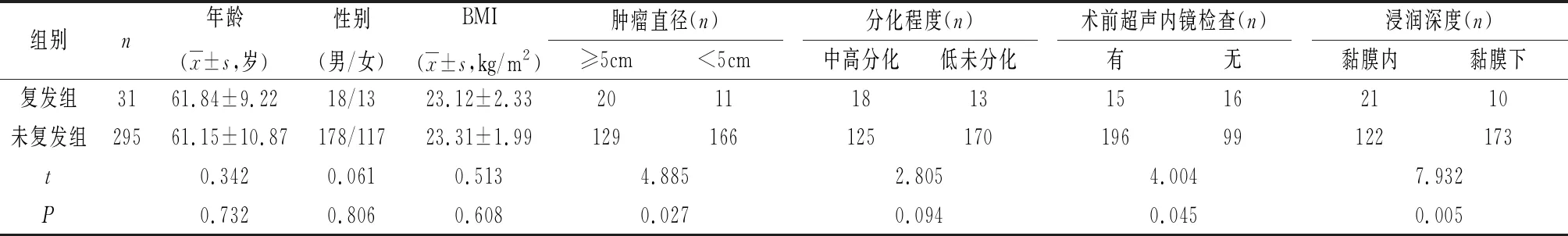
表2 復發組和未復發組基本資料比較(n)
2.3 復發組和未復發組血清IL-35、PECAM-1水平比較 復發組血清IL-35、PECAM-1水平高于未復發組,差異具有統計學意義(P<0.05),見表3。

表3 復發組和未復發組血清IL-35、PECAM-1水平比較
2.4血清IL-35、PECAM-1水平對預后的臨床價值 血清IL-35和PECAM-1對早期胃癌患者ESD術后的預后的曲線下面積(AUC)分別為0.821和0.827,當截斷值分別為13.96pg/ml和57.14ng/ml時,具有較高的靈敏度和特異度;當兩者聯合時臨床價值優于單獨應用,見表4和圖1。經Kaplan Meier曲線分析顯示,IL-35≥13.96pg/ml和PECAM-1≥57.14ng/ml早期胃癌患者ESD術后復發的發生率高于IL-35<13.96pg/ml和PECAM-1<57.14ng/ml患者(P<0.01),見圖2和圖3。
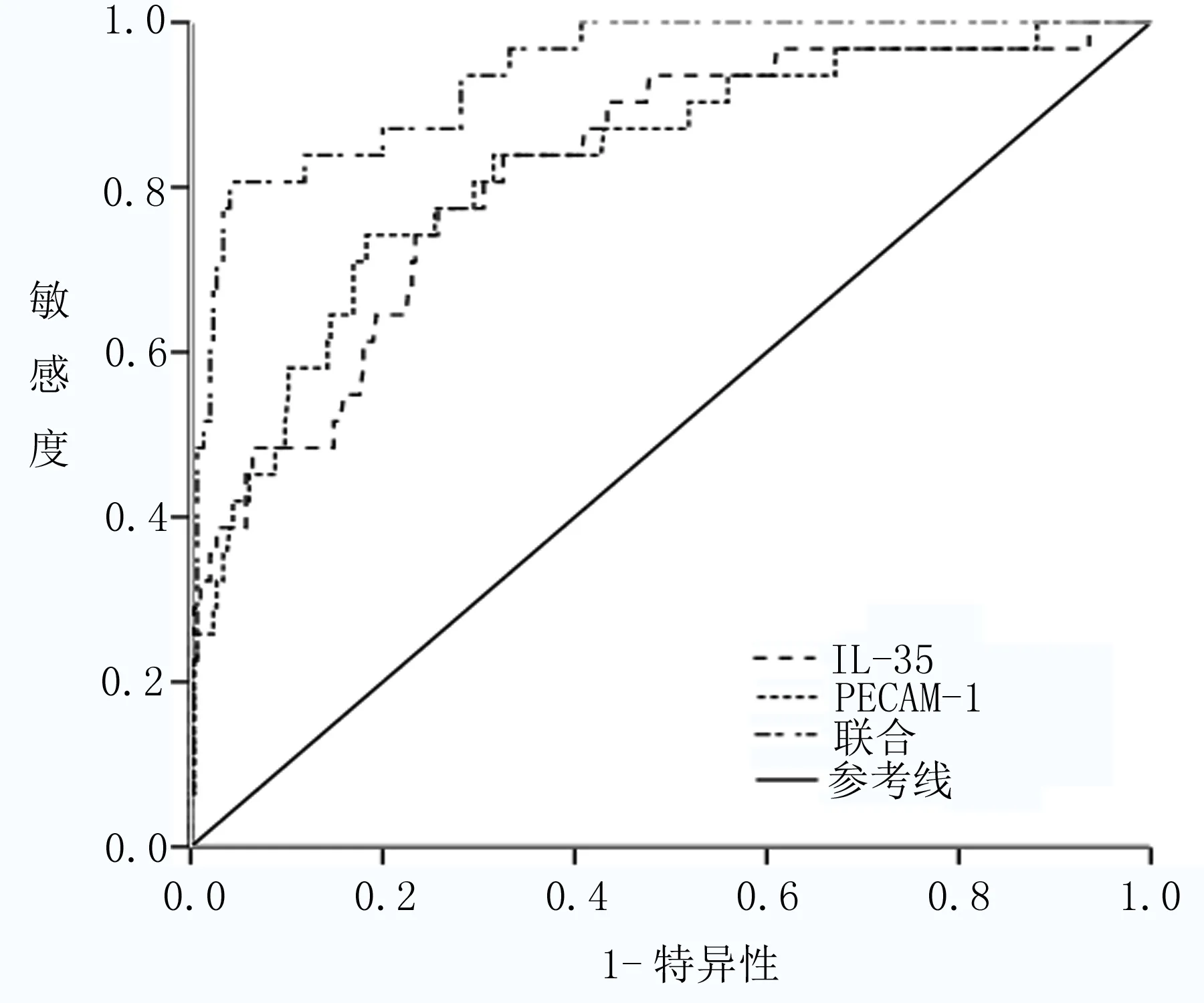
圖1 血清IL-35、PECAM-1水平對早期胃癌ESD術后預后的ROC曲線
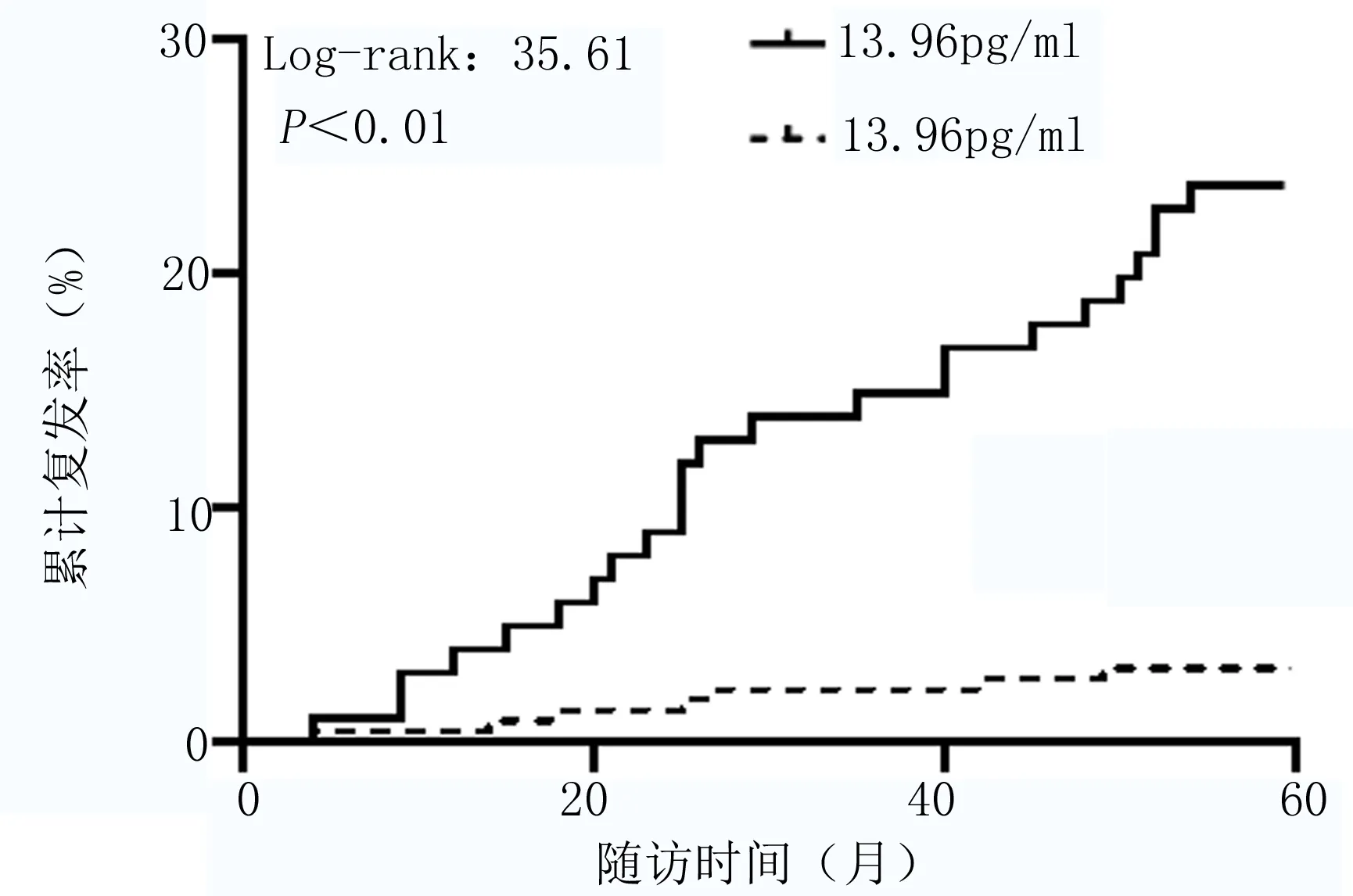
圖2 不同IL-35水平ESD術后患者復發情況

表4 血清IL-35、PECAM-1水平對早期胃癌ESD術后預后的臨床價值
3 討論
胃癌往往與遺傳和環境因素,如男性、年齡、吸煙狀況、胃癌家族史、幽門螺桿菌感染和飲食習慣等密切相關。ESD術作為早期胃癌患者治療的主要方式,具有創傷小、恢復快等優點,但部分患者存在局部復發和異時性癌發生的風險,因此早期預測其復發的風險具有重要的意義。
據報道[4],ESD治療早期胃癌患者的局部復發率為0.13%~1.30%,同時性癌和異時性癌的發生率分別為4.0%~12.9%和2.5%~5.1%,而5年和10年的累積復發率高達9.5%和22.7%。本研究通過對ESD術后治療的早期胃癌患者隨訪5年,結果發現復發率為9.51%(31/326),與既往研究報道結果類似。本文結果顯示,復發患者和未復發患者在腫瘤直徑、浸潤深度和術前超聲檢查方面存在統計學差異(P<0.05)。可能是由于腫瘤直徑越大、病灶組織浸潤程度越深,易出現剝離過深誘發胃穿孔的風險,從而增加術中切除的難度,不能完整剝離病灶,繼而出現病灶殘留增加ESD術后復發的風險;而術前超聲檢查有助于醫生準確評估患者病變的位置、邊界和大小等,掌握病灶的范圍及深度,從而在ESD術過程中最大限度地切除病灶減少殘留,降低ESD術后復發的風險。
研究表明[5],腫瘤患者IL-35水平表達顯著性高于健康人群。本文結果顯示,研究組血清IL-35水平顯著高于對照組,且復發組血清IL-35高于未復發組(P<0.05),與Gu JH等[6]研究結果類似。可能是由于IL-35在腫瘤的免疫微環境中起到重要調控作用,腫瘤細胞能夠分泌IL-35,造成血清IL-35水平升高,而腫瘤源性IL-35可通過正反饋上調IL-35的表達,進一步促進腫瘤免疫逃逸,同時可通過促進髓樣細胞聚集和血管生成促進腫瘤生長,增加復發的風險[3]。既往研究表明[7],PECAM-1表達與非小細胞肺癌分期密切相關,而且PECAM-1表達越高患者總生存率越低,提示可作為非小細胞肺癌患者預后的標志物和治療靶點。本文結果顯示,研究組血清PECAM-1水平顯著高于對照組,且復發組血清PECAM-1水平高于未復發組(P<0.05),提示血清PECAM-1與早期胃癌患者ESD術后的復發有關。可能是由于PECAM-1表達增加,機體基質金屬蛋白酶和相關黏附分子被激活,促使腫瘤細胞增殖,同時通過降解細胞外及血管基膜,致使產生大量生長因子及基質水解酶,破壞機體防御腫瘤浸潤和轉移屏障,促進腫瘤細胞浸潤和轉移,使腫瘤增殖風險增加[8]。
經ROC曲線分析顯示,當血清IL-35和PECAM-1截斷值分別為13.96pg/ml和57.14ng/ml時,對早期胃癌患者ESD術后的預后具有較高的靈敏度和特異度;而且兩者聯合時臨床價值優于單獨應用。經Kaplan Meier曲線分析顯示,IL-35≥13.96pg/ml和PECAM-1≥57.14ng/ml早期胃癌患者ESD術后復發的發生率高于IL-35<13.96pg/ml和PECAM-1<57.14ng/ml患者(P<0.01),進一步提示血清IL-35和PECAM-1可作為早期胃癌患者ESD術后的復發的標志物。
綜上所述,早期胃癌患者血清IL-35和PECAM-1水平上升,而且與ESD術后的復發密切相關,可作為早期胃癌患者ESD術后的復發的標志物。但本研究為單中心研究,樣本量較小存在一定局限性,尚需日后加大樣本量進行多中心前瞻性研究,以進一步探討血清IL-35和PECAM-1在早期胃癌患者ESD術后的復發中的作用機制。

