丙泊酚調控cAMP/PKA-CREB-BDNF通路對大鼠神經元凋亡、坐骨神經阻滯效果的影響
吳幫林 朱榮譽 吳述軒 朱賢林
臨床中的全身麻醉以及于超聲引導下的區域神經阻滯進行結合,能夠有效對手術中的麻醉藥物使用劑量進行降低,以此來減少因麻醉使用過多而產生的不良反應[1]。而局部麻醉對于區域神經阻滯中產生的作用相對較短,并且使用較高劑量極易發生神經毒性[2]。而中樞神經系統內的神經元凋亡過程與手術、麻醉等過程具有緊密關聯,其中麻醉藥物能夠對神經元凋亡產生影響[3]。丙泊酚為臨床廣泛使用的全麻藥物,屬于靜脈麻醉注射的一種[4]。對于神經元凋亡均有相關報道[5]。因此,本研究分析丙泊酚調控cAMP/PKA-CREB-BDNF通路對大鼠神經元凋亡、坐骨神經阻滯效果的影響,為丙泊酚在麻醉手術中的應用提供重要參考。
1 材料與方法
1.1 材料
1.1.1 研究動物:選取40只SPF級Wistar雄性大鼠,體重213~260 g,平均體重(236.50±19.97) g,由山西省疾病預防控制中心提供,動物許可證:SYXK(晉)2020-0005。實驗動物處置嚴格遵守實驗動物管理與保護的有關規定,飼養環境恒溫(21.14±2.06)℃,相對濕度15%左右,攝食及飲水保持自由狀態,連續12 h的循環光照,維持基礎狀態。本試驗操作均參照動物試驗倫理要求的相關規定。
1.1.2 主要試劑:丙泊酚(上海源葉生物科技有限公司);SOD檢測試劑盒(北京伊塔生物科技有限公司);MDA檢測試劑盒(武漢益普生物科技有限公司);HE染色試劑(北京博爾西科技有限公司);cAMP、PKA(深圳市健竹科技有限公司);CREB、BDNF(天津本生健康科技有限公司);GAPDH(北京義翹神州科技股份有限公司);Annexin V-FITC/PI 細胞凋亡檢測試劑盒(上海翌圣生物科技股份有限公司)。
1.1.3 主要儀器:智能熱板測痛儀(上海軟隆科技發展有限公司);光學顯微鏡(上海光學儀器一廠;型號:9J-PC)。
1.2 分組與建模 選取40只健康SD大鼠,隨機分為空白組、假手術組、低劑量組、高劑量組,每組10只,均禁食、禁水12 h,空白組不予任何處理,另外3組按照文獻[6]構建大鼠坐骨神經阻滯模型。3%戊巴比妥麻醉,大鼠仰臥位固定,于股骨偏下0.5 cm處切開皮膚,鈍性分離各層肌肉組織,暴露股二頭肌,充分將坐骨神經暴露。假手術組只行0.9%氯化鈉溶液 10 ml/kg注射。低劑量組注射丙泊酚10 mg/kg,高劑量組注射丙泊酚30 mg/kg。注射完畢后逐層縫合,抗生素消毒傷口,操作過程約10 min。術畢放入飼養籠,分別于大鼠復位反射恢復后按時間點進行指標觀察。
1.3 觀察指標
1.3.1 免疫組化染色:取海馬體神經組織1 cm石蠟包埋切片,厚度為3 μm。脫蠟后用純凈水洗滌,于PBS緩沖液中95℃微波修復10 min。標本中的內源性過氧化物酶用過氧化物酶封閉液予以封閉,分別滴加抗神經元細胞及一抗200 μl,室溫孵育2 h。加入二抗,室溫反應30 min,DAB顯色,常規脫水透明,封片。由我院3名病理科相關高資歷醫師通過雙盲法以電子顯微鏡(青島菲優特檢測有限公司,型號:JEM-2100)×400下隨機選取3個視野觀察神經元凋亡情況。
1.3.2 SOD、MDA水平檢測:①取4組大鼠冷凍血清,解凍后,采用黃嘌呤氧化酶法測定SOD水平,通過取用聚苯乙烯試管,將其分為測量管、對照管。在上清中加入多于上清10倍的蒸餾水,進行稀釋。加入1.0 ml試劑及50 μl樣品至測量管,再加50 μl的蒸餾水至對照管,搖勻,恒溫水浴箱30 min保存。顯色:在兩管內分別加入2 ml顯色劑,室溫放置10 min。比色應在波長550 nm,1 cm光徑條件下,計算SOD水平。②硫代巴比妥酸法測定MDA水平。4個聚苯乙烯試管分別進行標準、標準空白、測量及測量空白管分類,隨后將10 nmol/L四乙氧基丙烷以及試劑盒試劑加入至標準管內,將0.2 ml無水乙醇以及試劑盒試劑加入至標準空白管內,將0.1 ml肌肉組織勻漿以及試劑盒試劑分別加入試管,搖勻。接著將3 ml的硫代巴比妥酸加入至標準管、標準空白管、測量管3管內,再加入1 ml雙蒸水,而測量空白管內加入將3 ml硫代巴比妥酸以及1 ml的50%冰醋酸。隨后搖勻,后使用保鮮膜將其管口進行包裹、扎緊。隨后將4管置于85℃進行水浴40 min。后用冷水進行冷卻,并離心10 min,使用蒸餾水凋零分光光度,計算MDA水平。
1.3.3 海馬神經元凋亡率:將胰蛋白酶-EDTA處理液消化細胞加入至流式細胞儀中,1 500 r/min的速度離心5 min,收集細胞;再用PBS緩沖液洗滌2次,1 500 r/min的離心5 min后行細胞收集。其次將PBS緩沖液吸去,加入110 μl的Bingding Buffer緩沖液對細胞進行重懸。接著將 Annexin V-FITC及PI Staining Solution試劑盒溶液加入5 μl和10 μl,后搖勻,于37℃的避光室溫中反應15 min,后加入Bingding Buffer緩沖液350 μl,搖勻,檢測海馬神經元凋亡率。
1.3.4 各時間點MPE、EPT測量:①MPE測量:采用智能熱板測痛儀于大鼠阻滯后的10、20、30、60、120、180、240、300、360 min時間段內,對大鼠右后肢進行熱踏板試驗,熱踏板溫度為55℃,依照從走至右的先后順序來對后足熱刺激縮足反應潛伏期(paw withdrawal thermal latency,PWTL)進行測定,一后肢進行重復3次的測定,每次之間間隔5 min進行下一次測定,然后其平均值。將監測時間設置為10 s,以此避免對其組織造成損傷。如超過10 s后,大鼠仍未出現縮足反應,則需將刺激進行停止,將其時間記為10 s,來計算MPE,以此來對阻滯程度進行反應。MPE(%)=[(給藥后PWTL-基礎PWTL)/(10-基礎PWTL)]×100%。②EPT測量:將大鼠保持直立狀態進行上提,使其后肢處于伸展狀態,并讓遠端足來支撐體重,隨機放置于電子秤上方位置,大鼠后肢在進行伸展后所顯示出的數值就是EPT值。
1.3.5 cAMP/PKA-CREB-BDNF通路蛋白表達量:Western blot檢測對大鼠肺組織中的cAMP/PKA-CREB-BDNF蛋白相對表達量,取4組大鼠冷凍肺組織,冰上溶解25 min,制作組織勻漿,離心處理,BCA試劑盒對cAMP/PKA-CREB-BDNF蛋白含量進行檢測,提取等量蛋白質,100℃中變性5 min,采用凝膠電泳進行分離,加入一抗,4℃下孵育過夜,漂洗,15 min/次,3次,加二抗,孵育110 min,漂洗,13 min/次,3次,以GAPDH為內參,定量分析蛋白表達情況。試驗重復3次。
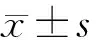
2 結果
2.1 4組神經元SOD活性及MDA含量比較 與空白組相比,假手術、低劑量組、高劑量組SOD活性降低,MDA含量升高,差異有統計學意義(P<0.05);與假手術組相比,低劑量組、高劑量組SOD活性升高,MDA含量降低,差異有統計學意義(P<0.05);與低劑量組相比,高劑量組SOD活性升高,MDA含量降低,差異有統計學意義(P<0.05)。見表1。
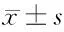
表1 4組神經元SOD活性及MDA含量比較 n=10,
2.2 4組海馬神經元凋亡率對比 與空白組相比,假手術、低劑量組、高劑量組海馬神經元凋亡率升高,差異有統計學意義(P<0.05);與假手術組相比,低劑量組、高劑量組海馬神經元凋亡率降低,差異有統計學意義(P<0.05);與低劑量組相比,高劑量組海馬神經元凋亡率降低(P<0.05)。見表2,圖1。
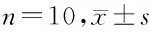
表2 4組海馬神經元凋亡率比較
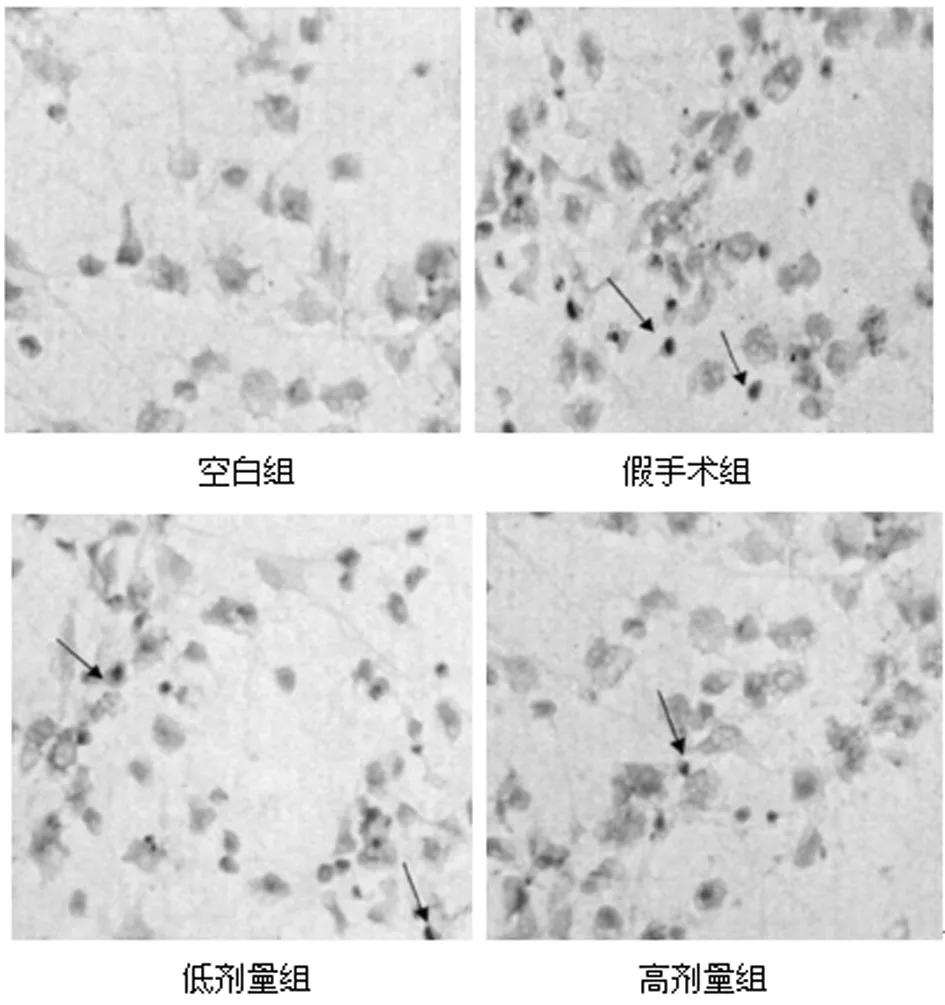
圖1 神經元凋亡比較(HE染色×200)
2.3 4組大鼠各時間點MPE比較 與空白組相比,阻滯后假手術、低劑量組、高劑量組各時間點MPE均升高,差異有統計學意義(P<0.05);與假手術組相比,低劑量組、高劑量組各時間點MPE均升高(P<0.05);與低劑量組相比,高劑量組各時間點MPE均升高,差異有統計學意義(P<0.05)。見表3。
2.4 4組大鼠各時間點EPT比較 與空白組相比,其余3組各時間點MPE均升高,差異有統計學意義(P<0.05);與假手術組相比,低劑量組、高劑量組10、20、30、60、90、120 min時間點EPT均升高;150、180 min時間點EPT均降低(P<0.05);與低劑量組相比,高劑量組10、20、30、60、90、120 min時間點EPT均降低,差異有統計學意義(P<0.05)。150、180 min時間點EPT均升高,差異無統計學意義(P>0.05)。見表4。
2.5 4組大鼠cAMP/PKA-CREB-BDNF信號通路分析 與空白組相比,假手術、低劑量組、高劑量組cAMP、PKA、CREB、BDNF表達均降低,差異有統計學意義(P<0.05);與假手術組相比,低劑量組、高劑量組cAMP、PKA、CREB、BDNF表達均降低,差異有統計學意義(P<0.05);與低劑量組相比,高劑量組cAMP、PKA、CREB、BDNF表達均降低,差異有統計學意義(P<0.05)。見表5,圖2。
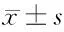
表3 4組大鼠各時間點MPE比較 n=10,
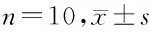
表4 4組大鼠各時間點EPT比較
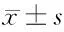
表5 4組大鼠cAMP/PKA-CREB-BDNF信號通路分析 n=10,

圖2 cAMP/PKA-CREB-BDNF信號通路蛋白Western blot圖
3 討論
丙泊酚作為一種新型麻醉藥物,在臨床手術中得到廣泛應用[7]。研究證實,丙泊酚在對于顱腦損傷等患者中,自身具有較為可靠且安全的麻醉效果,并且在進行輸注后,能夠被機體進行快速吸收,并且進行持續性的輸注也不會產生蓄積情況,蘇醒完全[8]。但也有研究指出,丙泊酚可能會導致患者長是其學習、行為以及記憶等功能出現異常情況,以此造成患者中樞神經出現一定損傷,使其腦損傷情況出現[9]。
SOD為抗氧化酶,MDA為脂質氧化產物,對過量氧自由基進行清除,保護神經元,二者能夠指示氧化應激反應[10,11]。本研究結果提示,丙泊酚能夠提升海馬神經元的抗氧化能力,而高劑量的丙泊酚能夠更好的進行提升[12]。相關研究指出,在心肌缺血再灌注大鼠中,其丙泊酚的使用能夠對大鼠心肌細胞產生保護作用,并且還能顯著提升SOD活性,降低MDA含量,從而顯著清楚氧自由基[13]。該研究與本文研究保持一致,表明使用丙泊酚能夠對海馬體神經元的抗氧化能力進行顯著提升,提升氧化應激反應,保護神經元。
本研究結果顯示,高劑量30 mg/kg的丙泊酚能夠發揮出抗神經元凋亡的最佳作用,由此得出,高劑量的丙泊酚能夠抑制海馬神經元凋亡情況,從而對神經元起到保護作用[14]。研究證實,丙泊酚能夠對海馬神經元產生一定的保護作用,對于持續性的癲癇大鼠具有顯著的治療功效,并且減弱機體內相關細胞的凋亡,對細胞自噬產生緩解作用[15]。該研究與本文研究保持一致。
cAMP自身濃度的改變會對多種信號通路產生直接影響,從而對基因和蛋白的表達進行調控,并且能夠直接對PKA蛋白產生影響,并對阻滯效果產生影響[16]。本研究結果顯示,相比于空白組、假手術組和低劑量組,高劑量組各時間點MPE均升高;而10、20、30、60、90、120 min時間點EPT均降低,由此說明,在進行丙泊酚麻醉后,高劑量組成功對坐骨神經的傳導功能進行阻斷。而在神經元間進行信息交流過程中,其突出為其交流的結構基礎,而PKA能夠對下游CREB蛋白進行磷酸化,并且PKA介導的信號通路與突出的形成、信號傳遞起到關鍵作用,起到調節神經的作用[17]。而活化后的CREB能夠對下游BNDF蛋白表達情況進行調控,從而對神經元存活及分化程度進行維持和促進,對神經進行保護[18]。本研究結果顯示,與空白組相比,假手術組、低、高劑量組cAMP、PKA、CREB、BDNF表達均降低,與假手術組相比,低、高劑量組cAMP、PKA、CREB、BDNF表達均降低,與低劑量組相比,高劑量組cAMP、PKA、CREB、BDNF表達均降低。相關研究證實,cAMP/PKA-CREB-BDNF信號通路參與多種腦部損傷中對神經元產生保護作用的調控[19]。還有研究證實,丙泊酚能夠對BDNF蛋白的表達進行降低,從而改善神經病理性疼痛以及神經元損傷,從而降低神經元凋亡,提升阻滯效果[20],這與本研究結果一致。表明丙泊酚能夠加速對cAMP/PKA-CREB-BDNF信號通路的抑制,提示cAMP/PKA-CREB-BDNF信號通路可能參與丙泊酚延長阻滯效果的機制。
綜上所述,丙泊酚能夠對海馬神經元產生一定保護作用,降低神經元凋亡率,減輕對神經的損傷程度。并且還能夠對大鼠坐骨神經組織效果進行延長,該保護作用以及組織效果延長情況可能與丙泊酚調控cAMP/PKA-CREB-BDNF信號通路有關。

