菸花苷對快速上浮脫險致減壓病的預防作用
劉程 方以群 李志勇 張珊珊 王楠 許驥 郭美麗
減壓病(decompression sickness,DCS)是機體暴露在高壓環境下后,由于環境壓力突然降低造成溶解在組織內的惰性氣體逸出形成氣泡導致的一系列病理反應的疾病。DCS主要臨床表現為皮膚瘙癢、大理石斑紋、關節肌肉疼痛、頭暈頭痛、胸悶氣短、呼吸困難,嚴重時可發生偏癱、截癱甚至昏迷[1]。DCS是潛水員常見的一種職業性疾病,也會發生在潛艇部隊人員和從事于航空航天、水下隧道施工、高壓艙等高壓暴露環境的工作人員中。近年來,快速上浮脫險技術由于脫險深度大、操作簡單、安全性高等優勢被廣泛應用于世界各國潛艇脫險逃生中,然而一旦發生操作或調壓不當,高壓暴露時間過長,則會發生嚴重的DCS。目前,DCS的主要治療方式是再加壓吸氧治療[2],但對于DCS的預防措施并沒有明確的方案,預吸氧、運動、潛水習服等措施,都在一定程度上可以降低DCS的發病率[3]。然而,由于操作不便、環境條件要求高、預防效果不穩定等原因,這些措施并不適宜用于在水下作業的潛艇部隊。使用藥物預防DCS操作簡便,無需特殊設備,是潛艇部隊人員預防DCS的最優選擇。因此,研究發現更多效果顯著的DCS預防藥物,已是當務之急。中醫藥對于多系統、多因素損傷疾病有著天然的優勢。菸花苷(Nicotiflorin,Nic)是我國傳統活血化瘀中藥紅花(Flos Carthami)中的黃酮類化合物,是紅花的重要藥效活性成分之一。研究發現,菸花苷具有抗炎、鎮痛、保肝、抗動脈粥樣硬化、抗腫瘤等多種藥理作用[4-7]。課題組自主研發的菸花苷注射液作為治療急性缺血性腦卒中的中藥Ⅰ類新藥,目前已完成Ⅰ期臨床試驗階段。本研究主要探討菸花苷對快速上浮脫險致DCS的預防作用,以期為DCS預防用藥提供依據。
1 材料與方法
1.1 實驗動物 使用雄性Sprague-Dawley(SD)大鼠(體重250~270 g)157只,購買自上海市計劃生育科學研究所實驗動物經營部,在清潔級動物房適應性飼養1周左右,室溫22~25℃,濕度45%~60%,自由進食水,人工照明自動模擬晝夜。本研究所有內容得到了倫理委員會的允許和支持。
1.2 儀器設備 實驗動物快速上浮脫險模擬艙(煙臺宏遠氧業有限公司);752N型紫外可見分光光度計(上海精密科學儀器有限公司);DHG9146-A電熱恒溫鼓風干燥箱(上海精宏實驗儀器);Water 1525型高效液相色譜儀(美國Waters公司);Bio-Gen PRO200型精密勻漿器(美國 Pro Scientific公司);多功能酶標儀(美國 Thermo Fisher Scientific);熒光定量PCR儀(美國 Thermo Fisher Scientific)。
1.3 實驗試劑 大鼠腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)、白介素1β(interleukin-1β,IL-1β)、白介素6(interleukin-6,IL-6)、細胞間黏附因子-1(intercellular cell adhesion molecule-1,ICAM-1)酶聯免疫反應(Elisa)試劑盒(杭州聯科生物技術股份有限公司);RIPA裂解液(上海碧云天生物技術有限公司);UNIQ-10 柱式Trizol總RNA抽提試劑盒(上海生工生物工程有限公司);cDNA合成試劑盒(北京全式金生物技術股份有限公司);Green qPCR SuperMix試劑盒(北京全式金生物技術股份有限公司)。
1.4 藥品準備 菸花苷使用注射液制劑(菸花苷含量為10 mg/ml),由江蘇蘇中藥業集團股份有限公司生產提供(產品批號:20200409)。
1.5 方法
1.5.1 實驗分組:將SD大鼠分為5組,分別為常壓對照組(n=10只)、DCS組(n=30只)、菸花苷高劑量組(n=40只),中劑量組(n=40只),低劑量組(n=37只)。菸花苷注射液規格為10 mg/ml(蘇中藥業集團股份有限公司),給藥組大鼠尾靜脈分別注射菸花苷注射液5 mg/kg、10 mg/kg和20 mg/kg,其中5 mg/kg和10 mg/kg給藥時使用0.9%氯化鈉溶液稀釋藥物,使各菸花苷給藥組給藥體積相等;DCS組大鼠按照2 ml/kg劑量尾靜脈注射0.9%氯化鈉溶液。
1.5.2 減壓造模方案:DCS模型選用快速上浮脫險致DCS動物模型。動物放在使用鐵網封閉的鼠籠中,DCS模型組和菸花苷給藥組同時放入高壓艙內(宏遠,煙臺,中國),通過計算機程序自動進行加壓-減壓過程。28 s內加壓至1.5 MPa后保持242 s,然后以3 m/s的速度減壓至正常大氣壓,減壓時間共50 s。空白對照組大鼠放入高壓艙內,停留320 s后取出,不做加壓、減壓處理。見圖1。
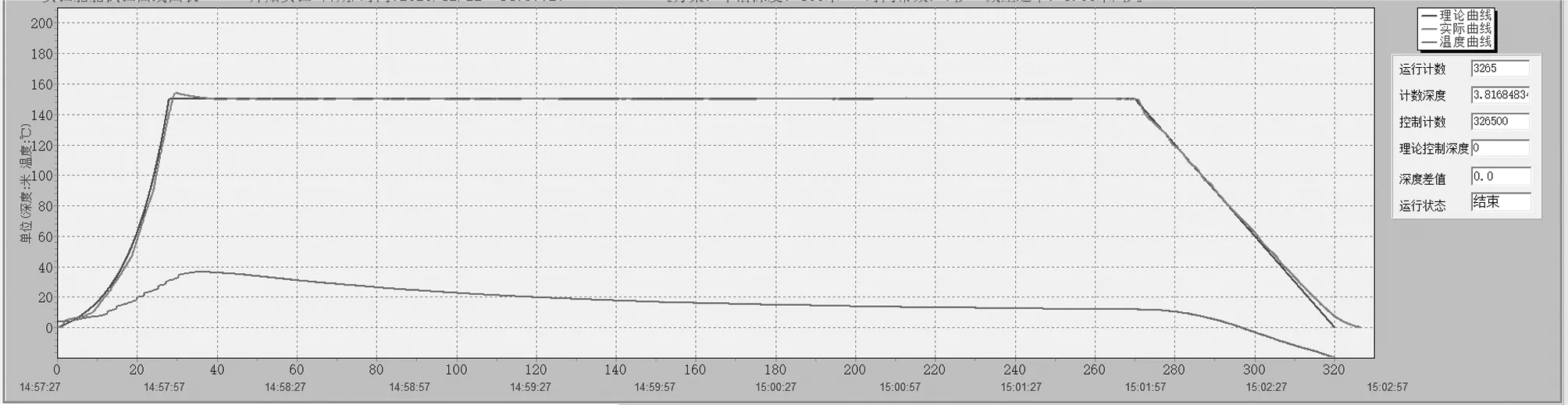
圖1 快速上浮脫險模擬艙計算機自動加減壓曲線
1.5.3 DCS行為學研究:大鼠出艙30 min內,觀察DCS的發病情況,包括以下癥狀:行動障礙、前/后肢癱瘓、抽搐/痙厥、死亡。并根據進行評分,對上述癥狀分別賦予1、2、3、4,出現多種癥狀時,得分相加[8]。
1.5.4 組織學檢查:每組取10只大鼠,腹腔注射戊巴比妥麻醉后脫頸開胸(死亡大鼠直接開胸),取右肺中葉,0.9%氯化鈉溶液沖洗表面殘留血液,濾紙吸干,放置于10%多聚甲醛中固定24 h后,脫水,石蠟包埋,切片成4 μm,放在載玻片上,切片放入Harris蘇木素染3~8 min,自來水洗,1%的鹽酸酒精分化5 s,自來水沖洗,0.6%氨水返藍,流水沖洗,放入伊紅染液中染色1~3 min。顯微鏡下檢查,進行常規組織學分析。每個切片隨機選取10個×200倍視野區域,每個區域根據間質細胞增生、水腫、充血、炎性細胞浸潤程度進行評分[9]:0分,肺血管、間質、肺泡及支氣管正常; 1分,間質及肺泡出血水腫范圍<25%; 2分,間質增寬,肺泡腔出血水腫范圍 25%~50%; 3分,間質明顯增寬,肺泡腔出血水腫范圍 50%~75%; 4分,間質明顯增寬,肺泡腔出血水腫范圍>75%。
1.5.5 肺組織濕干比測定:高壓暴露結束后,每組取7只大鼠,剪取大鼠右肺后葉,0.9%氯化鈉溶液沖洗表面血液,然后在濾紙上吸干組織表面水分,稱重后確定右肺后葉濕;放入真空干燥箱,80℃烘干48 h,取出再次稱重,確定干重。最后計算肺組織濕干重量比(wet/dry weight ratio,W/D)。
1.5.6 促炎細胞因子定量分析:常壓對照組、DCS模型組和菸花苷高劑量組每組取大鼠剩余肺組織,每個樣本剪取合適大小后剪碎,使用x1 PBS溶液沖洗表面殘留血液,吸干表面水分,按重量:體積=1∶9的比例加入RIPA,勻漿,4℃ 12 000/min離心15 min,取上清液。使用Elisa試劑盒(聯科,中國杭州),按照使用說明書,在預被板中加入標準品及肺組織樣品,37℃ 孵育1.5 h;加入生物素抗體,37℃孵育1 h;洗板4次,加入HRP,37℃孵育0.5 h;洗板4次,加入TMB顯色液,37℃孵育20 min,加入終止液;酶標儀450 nm測定OD值。通過標準品制作標準曲線,計算各樣本濃度。
1.5.7 RT-PCR檢測炎性因子mRNA水平表達:使用Trizol試劑(UNIQ-10 柱式Trizol總RNA抽提試劑盒,生工,中國上海)從大鼠肺組織中提取總RNA,使用逆轉錄第一鏈cDNA合成試劑盒(全式金,中國北京)將提取的肺組織總RNA逆轉錄成cDNA。采用RT-PCR檢測肺組織中TNF-α、IL-1β、IL-6、ICAM-1的mRNA表達水平(相對表達量)。使用NCBI Primer Design(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)設計用于RT-PCR檢測的基因引物序列,由生生物工程(上海)股份有限公司合成。見表1。
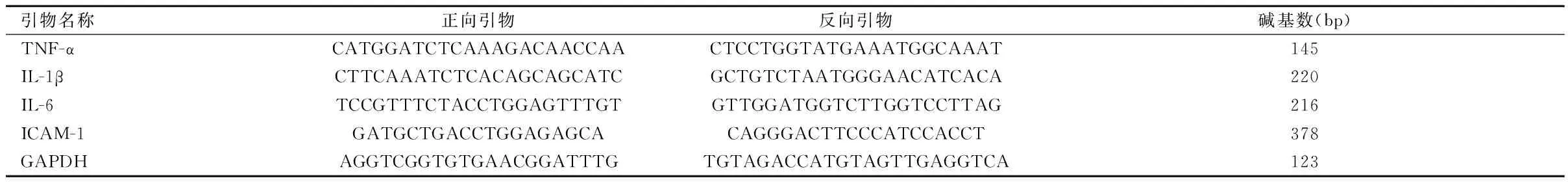
表1 SD大鼠TNF-α、IL-1β、IL-6和ICAM-1的基因引物序列
2 結果
2.1 菸花苷降低減壓病的嚴重程度和死亡率 大鼠出艙后均出現伏地、活動減少和聚集蜷縮的狀態,說明大鼠發生了減壓病。當強迫大鼠活動時,部分大鼠出現行動障礙、前肢或后肢癱瘓、全身癱瘓或痙厥抽搐、原地翻滾等癥狀,根據行為學評分可發現,菸花苷組大鼠評分明顯低于DCS模型組大鼠,可以顯著降低大鼠死亡率,且呈現量效關系(P<0.05)。見表2,圖2。

表2 5組大鼠死亡率和行為學比較
2.2 菸花苷緩解DCS致肺組織損傷 大鼠肺組織病理分析結果顯示,相對于空白組大鼠肺組織,DCS模型組肺組織水腫嚴重,肺間質細胞出現顯著水腫、增生,肺泡結構紊亂、融合,肺泡腔可見紅細胞浸潤。菸花苷給藥組肺組織間質細胞水腫較輕,肺泡腔及肺間質紅細胞浸潤減少,肺組織結構基本完整,且損傷程度呈現量效關系。肺組織病理學評分,說明菸花苷降低了大鼠肺組織損傷程度。與常壓對照組比較,DCS模型組大鼠肺組織W/D、肺組織病理學評分明顯升高,而菸花苷高、中劑量組肺組織W/D、肺組織病理學評分明顯低于DCS組,差異均有統計學意義(P<0.05)。見圖3,表3。
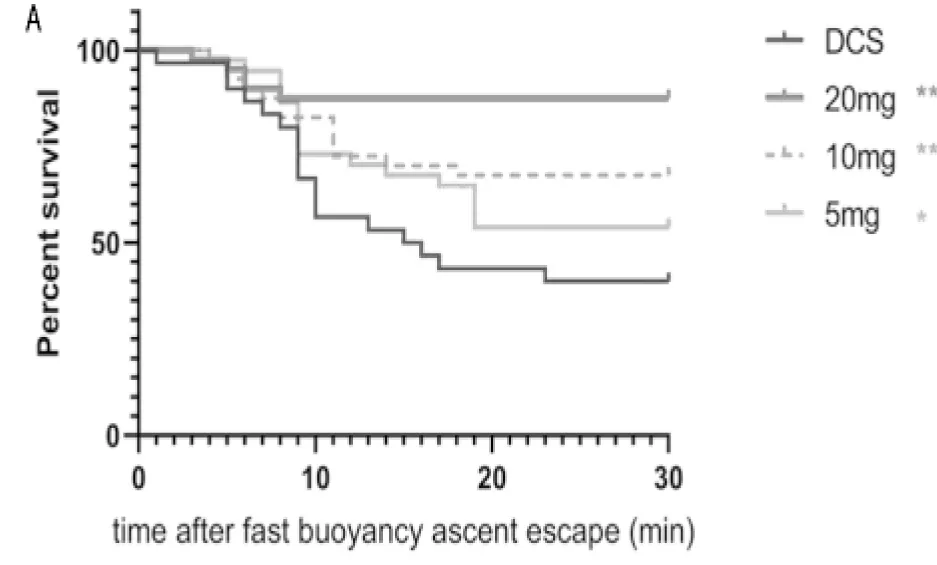
圖2 5組大鼠出艙后30 min生存情況

常壓對照組(HE×200) DCS組(HE×200) DCS組(HE×400)
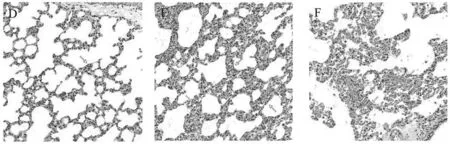
菸花苷高劑量組(HE×200) 菸花苷中劑量組(HE×200) 菸花苷低劑量組(HE×400)
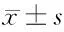
表3 5組大鼠肺濕干比和肺組織病理學評分
2.3 大鼠肺組織炎性因子水平和細胞黏附因子的含量變化 DCS組TNF-α、IL-1β、IL-6、ICAM-1水平高于常壓對照組和菸花苷組,差異均有統計學意義(P<0.05)。菸花苷組TNF-α、IL-6、ICAM-1水平低于常壓對照組,IL-1β高于常壓對照組,差異均有統計學意義(P<0.05)。見表4。
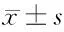
表4 3組大鼠肺組織TNF-α、IL-1β、IL-6和ICAM-1含量 pg/ml,
2.4 大鼠肺組織炎性因子和細胞黏附因子的mRNA水平變化 與常壓對照組相比,DCS組大鼠肺組織中TNF-α、IL-1β、IL-6、ICAM-1在mRNA水平的表達顯著提高,菸花苷預防給藥后,DCS大鼠肺組織中TNF-α、ICAM-1和IL-6的mRNA水平顯著降低,IL-1的mRNA水平也表現出下降趨勢。見表5。
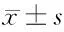
表5 3組大鼠TNF-α、IL-1β、IL-6和ICAM-1 mRNA水平變化
3 討論
DCS的發病原因是當氣壓快速降低時,溶解在機體內的惰性氣體逸出形成氣泡,存在于血液、脂肪和各組織器官中,尤其是在靜脈系統中會產生大量氣泡。氣泡作為外源性物質,其介導的血小板激活凝集、白細胞活化、TNF-α等炎性因子釋放、補體和黏附因子激活、細胞凋亡信號上調等,導致機體一系列免疫、炎性和凝血反應[10],對呼吸系統、循環系統和神經系統等造成損傷[11]。與常規潛水致DCS模型相比,快速上浮脫險致DCS模型由于機體在高壓環境下暴露時間較短,氣泡主要集中在靜脈血液中,可隨血液流動,并可通過吸收不斷溢出的惰性氣體或氣泡間相互融合而擴大,隨循環系統經下腔靜脈到達右心房、右心室、肺動脈進入肺組織,最后經肺泡氣體交換排出體外。因此,快速上浮脫險致DCS模型神經系統損傷較小[12],機體損傷主要涉及循環系統和呼吸系統。在排出氣泡的過程中,大量的氣泡對肺泡、肺動脈造成直接機械刺激,肺是快速上浮脫險致DCS的主要靶器官[9]。當減壓病發生時,不安全減壓在體內產生的大量氣泡,對肺泡、血管內皮細胞等組織可以造成直接的機械系損傷,增加血管通透性,并激活炎性反應系統,促進大量前炎性因子(TNF-α、IL-1β、IL-6等)釋放[13]。正常情況下,ICAM-1在內皮細胞表明表達量較低,由于TNF-α的刺激,激活肺內皮細胞、上皮細胞等細胞的NF-κB通路,上調ICAM-1的表達[14],血管內皮細胞表面的ICAM-1水平可出現明顯增高。ICAM-1與白細胞表面的LFA-1受體相結合,介導白細胞與內皮細胞的黏附作用,釋放炎性介質,引起組織水腫,加重肺組織損傷[15]。由此可推斷,氣泡導致的嚴重炎性反應在重癥DCS發病過程中,尤其是對加重肺損傷起到了重要作用[16]。因此,急性肺損傷導致大鼠呼吸異常、缺氧、窒息可能是快速上浮脫險致DCS大鼠死亡的主要原因。
紅花是我國傳統中藥,具有活血化瘀、活絡通經等功效。現代藥理研究表明,紅花具有優秀的抗炎作用,對肺部炎性反應可以產生抑制作用[17]。以往研究發現,紅花和以紅花為主要成分的中藥、中成藥對減壓病有著一定的防治作用,可以改善脊髓型DCS嚴重程度[18],減輕DCS肺損傷[19]。菸花苷是紅花中的重要單體活性成分之一,具有抗炎、鎮痛、抗氧化損傷、保護神經、抗缺血性腦卒中等作用[20,21],可以通過增強內皮細胞內皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)活性,上調eNOS的mRNA和蛋白表達,改善缺血缺氧導致的內皮細胞損傷[22]。
在本項結果表明菸花苷在減輕大鼠肺組織炎性反應的同時具有改善了肺組織內皮細胞損傷,這也說明損傷在短時間內(<30 min)已經引起了肺組織細胞mRNA水平的變化。因此,DCS大鼠早期肺損傷可能并非單純因為氣泡對于肺組織的機械作用損傷,炎性因子的大量釋放和內皮細胞功能的下降,也是肺組織損傷的重要因素。結合前期研究結果[2],可以推斷,出艙后的短期內大鼠行動障礙、抽搐痙厥等癥狀,不是單純的神經系統損傷所造成,更可能是肺組織損傷引起的急性缺氧所導致。菸花苷對減壓病的預防作用,主要是菸花苷對于通過抑制炎性反應,減輕內皮細胞損傷對肺組織起到保護作用。但是,菸花苷對于肺組織內皮細胞的保護作用,是通過減輕炎性反應或是增加內皮細胞eNOS的活性和表達等其他途徑實現,尚不明確。
綜上所述,菸花苷可以對快速上浮脫險致DCS的大鼠具有預防作用,可以降低大鼠肺組織炎性因子水平,減輕內皮細胞損傷,對DCS大鼠肺組織起到保護作用,可以作為一種具有應用前景的DCS預防藥物做進一步研究。

