早期高脂腸內營養對膿毒癥患者細胞免疫作用的臨床研究
張麗騫 張立民 張玉平
嚴重膿毒癥是危重患者最重要的死亡原因,其發病機制除失控性免疫功能紊亂外,嚴重的能量代謝障礙一直貫穿于整個疾病發展進程[1]。體內營養不足和負氮平衡與血源性感染密切相關,同時也與失控性炎性反應有復雜的相互關系[2,3]。臨床營養支持在膿毒癥的治療過程中越來越受到重視。研究證實,膿毒癥患者通過早期營養支持可顯著減少機械通氣的使用,降低住院時間和病死率[4,5]。并且,從并發癥的產生、住院時間和費用、生活質量及生存率來看,早期腸內營養支持的效果顯著優于腸外營養[6]。但是,目前在膿毒癥患者腸內營養的成分和配比的選擇上,仍不統一。動物研究發現,高脂腸內營養引起腸促胰酶肽(CCK)的分泌,進而通過CCK受體依賴方式活化迷走神經啟動的膽堿能抗炎通路,重建腸道免疫平衡,保護失血性休克大鼠腸屏障功能,減少腸源性損傷因子入血[7]。Tihista等[8]證實,高脂腸內營養可顯著降低ICU燒傷患者膿毒癥、膿毒性休克和腸道損傷的發生率。此外,腸內配方高脂營養可通過改變患病機體內促炎性脂質和抑炎性脂質平衡,調節機體的免疫狀態[8]。本研究從腸道內營養物質對機體免疫功能調控的角度,探討高脂腸內營養對膿毒癥患者干預作用的可能機制,為完善膿毒癥患者的營養治療提供資料。
1 資料與方法
1.1 一般資料 選取河北北方學院附屬第一醫院2018至2019年住院膿毒癥患者60例和同期體檢健康志愿者30例作為研究對象。膿毒癥患者根據腸內營養方案的不同分為:常規腸內營養組和高脂腸內營養組,每組30例。常規腸內營養組男11例,女19例;年齡24~86歲,平均(65.22±14.24)歲;平均病程(25.39±14.53)d。高脂腸內營養組中,男13例,女17例;年齡33~88歲,平均(67.17±16.43)歲;平均病程(18.61±11.73) d。2組性別比、年齡比較差異無統計學意義(P>0.05)。
1.2 納入標準 (1)體溫>38.3℃或<36℃、心率>90/min、呼吸急促、意識改變;(2)白細胞計數>12 000/mm3或<4 000/mm3、白細胞計數正常但未成熟細胞>10%;(3)低血壓:收縮壓(SBP)<90 mm Hg,平均動脈壓(MAP)<70 mm Hg;(4)動脈低氧血癥、急性少尿、凝血功能異常、腸梗阻、血小板減少、高膽紅素血癥;(5)高乳酸血癥、毛細血管充盈受損或皮膚花斑;(6)在內科監護室或外科監護室住院2~3 d;(7)同時伴有≥1個以上器官功能障礙者。
1.3 早期腸內營養支持方案 重癥患者急性應激期應根據“允許性低熱量喂養”原則進行營養支持[9],目標熱量為83.7~104.6 kJ·kg-1·d-1;應激與代謝狀態穩定后可增加至125.5~146.4 kJ·kg-1·d-1。本研究2組患者腸內營養的目標熱卡和氮量相同,熱量為104.6 kJ·kg-1·d-1,氮量為1.2 g·kg-1·d-1。
1.3.1 常規腸內營養組:在確診膿毒癥后24~48 h內置入鼻空腸營養管,并確定其位置準確,在血流動力學穩定后啟動腸內營養。營養制劑采用24 h泵入。若患者胃腸道耐受性尚可,逐漸增加熱量,7~10 d達目標熱卡。營養液的脂肪含量50 g/L。
1.3.2 高脂腸內營養組:高脂腸內營養的實施方案與常規腸內營養組一致。但采用ω3魚油脂肪乳(ω3多不飽和脂肪酸)將腸內營養液的脂肪含量提高到90 g/L,其中,ω6∶ω3脂肪酸的比值調整到2∶1、二十碳五烯酸含量>4 g/L、二十二碳六烯酸含量>2 g/L。膿毒癥患者在治療前及營養支持14 d后收集血液標本,以備后續檢測。
1.4 觀察指標 (1)細胞因子檢測:酶聯免疫吸附法(ELISA)試劑盒(R&D Systems)進行單核細胞源性細胞因子腫瘤壞死因子-α(TNF-α)、白介素-1(IL-1)、IL-6、轉化生長因子β1(TGF-β1)和前列腺素E2(PGE2)以及淋巴細胞源性細胞因子IL-2、γ干擾素(IFNγ)、IL-4和IL-10檢測。(2)單核細胞人白細胞抗原DR(HLA-DR)和淋巴細胞功能檢測:用流式細胞法進行單核細胞數量和功能、淋巴細胞數量和淋巴細胞亞型分布檢測。
2 結果
2.1 單核細胞功能檢測 常規腸內營養組治療14 d HLA-DR水平高于治療0 d,高脂腸內營養組14 d HLA-DR水平高于治療0 d,差異均有統計學意義(P<0.05)。2組治療14 dHLA-DR水平比較,差異無統計學意義(P>0.05)。見表1。
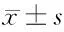
表1 高脂腸內營養對膿毒癥患者單核細胞HLA-DR表達的影響 n=30,
2.2 淋巴細胞數量和亞型檢測 高脂腸內營養支持組CD4+T淋巴細胞和CD4+/CD8+在治療14 d后顯著高于常規營養支持組(P<0.05)。見表2。
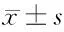
表2 高脂腸內營養對膿毒癥患者總T淋巴細胞、CD4+T淋巴細胞、CD8+T淋巴細胞以及CD4+/CD8+的影響 n=30,
2.3 細胞因子檢測 高脂腸營養支持組患者血清TNF-α、IL-6、PGE2、IFNγ、IL-10表達水平顯著低于常規營養支持組,差異有統計學意義(P<0.05)。見圖1,表3。



圖1 高脂腸內營養對膿毒癥患者血漿細胞因子的影響
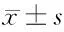
表3 高脂腸內營養對膿毒癥患者血漿細胞因子的影響n=30,pg/ml,
3 討論
危重病患者普遍存在營養不良,會增加患者的病死率,而且使嚴重并發癥發生率、住院時間、醫療支出顯著增加。研究表明,膿毒癥患者早期腸內營養支持可顯著縮短住院時間,改善預后,提高患者的生存質量[10]。但是對膿毒癥患者早期腸內營養支持的時間選擇、成分配比等仍有爭議。本研究發現,膿毒癥早期腸內營養支持顯著減輕患者體內的炎性反應水平,并且高脂腸內營養顯著優于常規腸內營養。
膿毒癥可以認為是一種宿主對感染強烈反應相關的嚴重臨床綜合征。膿毒癥的嚴重程度與自我放大、失控的細胞因子風暴密切相關[11]。細胞因子是機體免疫功能調節的重要效應因子,在機體的生長發育、組織修復和免疫調節中發揮重要作用。根據來源通常可以將體內的細胞因子分為2大類:單核細胞源性細胞因子和淋巴細胞源性細胞因子[12]。這些細胞因子通過相應的受體發揮包括免疫調理、細胞殺傷、清除壞死組織等多樣性的生物學效應,但是過度產生的細胞因子可以引起機體的自我損傷。本研究發現高脂腸內營養支持組TNF-α、IL-6、PGE2、IFNγ、IL-10顯著低于常規腸內營養組(P<0.05)。這些結果表明,與常規的腸內營養支持比較,高脂腸內營養支持可顯著抑制膿毒癥患者體內過度活化的炎性反應。驗證本研究分別檢測了單核細胞的功能和淋巴細胞的亞型。本研究結果顯示無論高脂腸內營養還是常規腸內營養支持治療都可使其逐漸回升,但高脂腸內營養組CD4+T淋巴細胞和CD4+/CD8+淋巴細胞比值在治療14 d后顯著高于常規腸內營養支持組。這些結果表明,高脂腸內營養支持較常規營養支持具有更好的免疫調理作用,對于抑制膿毒癥患者的失控的全身炎性反應具有顯著的益處,其機制有待闡明。
大量的基礎和臨床研究表明,刺激迷走神經活化膽堿能抗炎通路具有顯著的抗炎效應[13,14]。腸道內營養物質與自主神經的相互作用在機體的消化、免疫和代謝功能調節中具有非常重要的作用[15]。Lubbers等[16]進行的動物實驗表明,富含脂質飲食可顯著抑制失血性休克大鼠體內的TNF-α和IL-10水平,減輕腸屏障功能的破壞和細菌內毒素移位;這些效應可被迷走神經傳入纖維阻滯和CCK-1受體拮抗劑所阻斷。膿毒癥患者早期高脂腸內營養支持是否也是由膽堿能抗炎效應實現的,有待進一步證實。
綜上所述,膿毒癥早期腸內營養支持顯著減輕患者體內的炎性反應水平,并且高脂腸內營養顯著優于常規腸內營養。本研究為膿毒癥的治療提供一種除藥物治療以外的新選擇,此外也為完善膿毒癥患者的營養支持提供了新的實驗證據。

