心臟外科術后病人呼吸機相關性肺炎危險因素的Meta分析
吉雙對,張竹英,鄭棟蓮,郭淑萍,白 雪,劉風景,米光麗,*
1.寧夏醫科大學護理學院,寧夏 750004;2.寧夏醫科大學總醫院
呼吸機相關性肺炎(ventilator-associated pneumonia,VAP)是指病人在建立人工氣道及機械通氣48 h后或停止機械通氣48 h以內新發生的醫院獲得性肺炎[1]。VAP的發生可導致病人機械通氣時間延長、醫療費用增加和住院時間延長,甚至增加病人的死亡率[2-3]。研究表明,在接受機械通氣48 h以上的病人中,10%~20%的病人會發生VAP[4]。8%~15%的心臟外科術后病人機械通氣時間超過48 h[5],導致VAP的發生率進一步增加。有研究表明,VAP是心臟術后病人最常見、最嚴重的感染,且已被確定為心臟手術后病人死亡的獨立危險因素[6]。目前,國內外對心臟術后VAP危險因素的研究結果差異較大,納入相同危險因素的結果也存在差異。因此,本研究旨在對國內外關于心臟術后病人發生VAP的危險因素研究進行Meta分析,探討心臟術后發生VAP的危險因素,為臨床識別潛在高危人群和預防VAP提供科學依據。
1 資料與方法
1.1 資料來源與檢索策略
計算機檢索中國知網、中國生物醫學文獻數據庫、萬方數據庫、維普數據庫、PubMed、EMbase、Web of Science等數據庫,收集有關心臟外科術后病人發生VAP危險因素的文獻,檢索時限為建庫至2022年8月30日。采用主題詞與自由詞相結合方式,中文檢索式:(心臟術后 OR 心臟手術 OR 冠狀動脈搭橋術 OR 冠狀動脈旁路移植術 OR 瓣膜置換術 OR 瓣膜手術 OR 體外循環)AND(呼吸機相關性肺炎OR 呼吸機相關肺炎 OR 機械通氣相關性肺炎 OR 機械通氣相關肺炎) AND (危險因素 OR 影響因素 OR 相關因素 OR 病因);英文檢索式:(cardiac surgery OR heart surgery OR coronary artery bypass OR aortocoronary bypasses OR extracorporeal circulation) AND (VAP OR ventilator-associated pneumonia) AND (risk factor OR relevant factors OR influencing factor)。
1.2 文獻納入標準
1)文獻類型:國內外公開發表的關于心臟外科術后VAP危險因素的病例對照研究、隊列研究,文獻語言為中文、英文,發表時間為2000年1月—2022年6月;2)VAP有明確的診斷標準或指南;3)研究對象:心臟外科術后病人機械通氣時間≥48 h,以是否發生VAP為標準分為病例組(VAP組)和對照組(非VAP組),年齡≥18歲;4)結局指標:原始文獻采用多因素Logistic回歸分析,文獻提供VAP危險因素的比值比(OR)值及其95%的置信區間(CI)。
1.3 文獻排除標準
1)非病例對照研究、非隊列研究;2)對VAP沒有明確的診斷標準,或對危險因素的定義與納入的大部分研究不一致;3)未對影響因素進行統計學分析或統計方法不當;4)無法獲取全文或數據不完整的研究;5)會議摘要、文獻綜述、案例報告等。
1.4 資料提取
資料提取由2名研究者獨立完成并交叉核對,不一致時及時核查原始資料。主要提取內容包括作者、發表年份、研究類型、樣本量(病例組/對照組)、心臟手術類型、危險因素、危險因素的OR值及其95%CI等。
1.5 文獻質量評價
參考觀察性研究的文獻質量評價量表——紐卡斯爾-渥太華量表(NOS)[7],對納入文獻研究的人群選擇、組間可比性、暴露因素等3個方面進行質量評價,滿分為9分,評分≥5分為高質量文獻[6]。2名研究者分別按照相應的標準對納入文獻獨立進行評價。若意見出現分歧,則經討論決定,難以達成一致時咨詢第3方。
1.6 統計學方法
采用RevMan 5.3軟件,首先對符合納入標準的文獻進行異質性檢驗,如果P>0.1、I2<50%認為各研究間具有同質性,選用固定效應模型進行分析;如果P<0.1、I2≥50%,采用隨機效應模型進行分析。結果采用OR和95%CI表示,用敏感性分析尋找異質性來源,無法判斷來源者,則采用描述性分析,同時繪制漏斗圖進行發表偏倚評價。
2 結果
2.1 文獻檢索結果
初步檢索獲得相關文獻706篇,通過閱讀題目、摘要、關鍵詞及全文最終納入11篇文獻,其中中文文獻8篇,英文文獻3篇。見圖1。
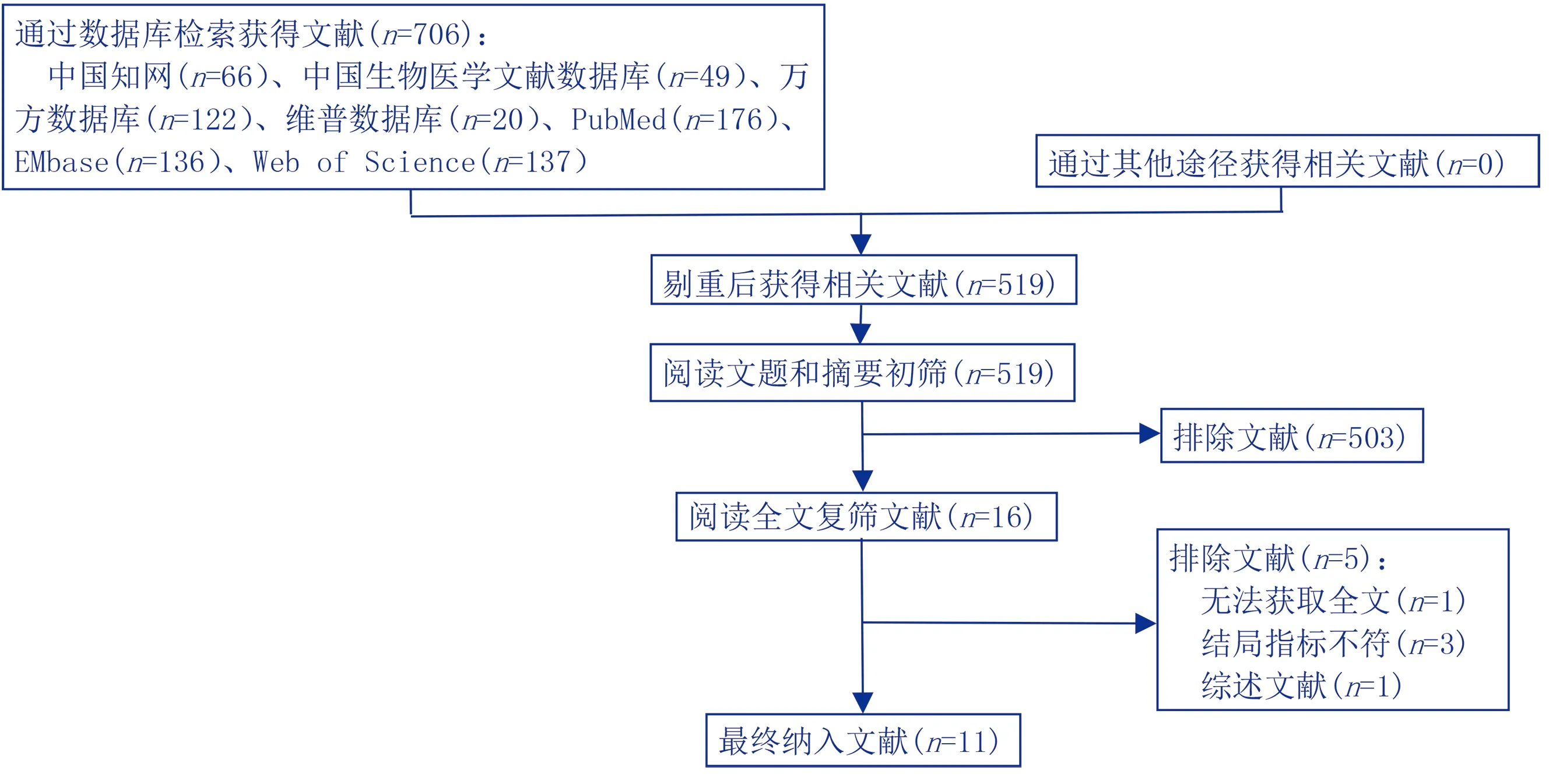
圖1 文獻篩選流程圖
2.2 納入文獻研究的基本特征
納入的11篇文獻發表時間為2009年—2020年,其中10篇為病例對照研究,1篇為隊列研究,樣本量為77~1 688例,累計4 561例,術后發生VAP 697例,發生率為15.28%。納入研究的基本特征見表1。
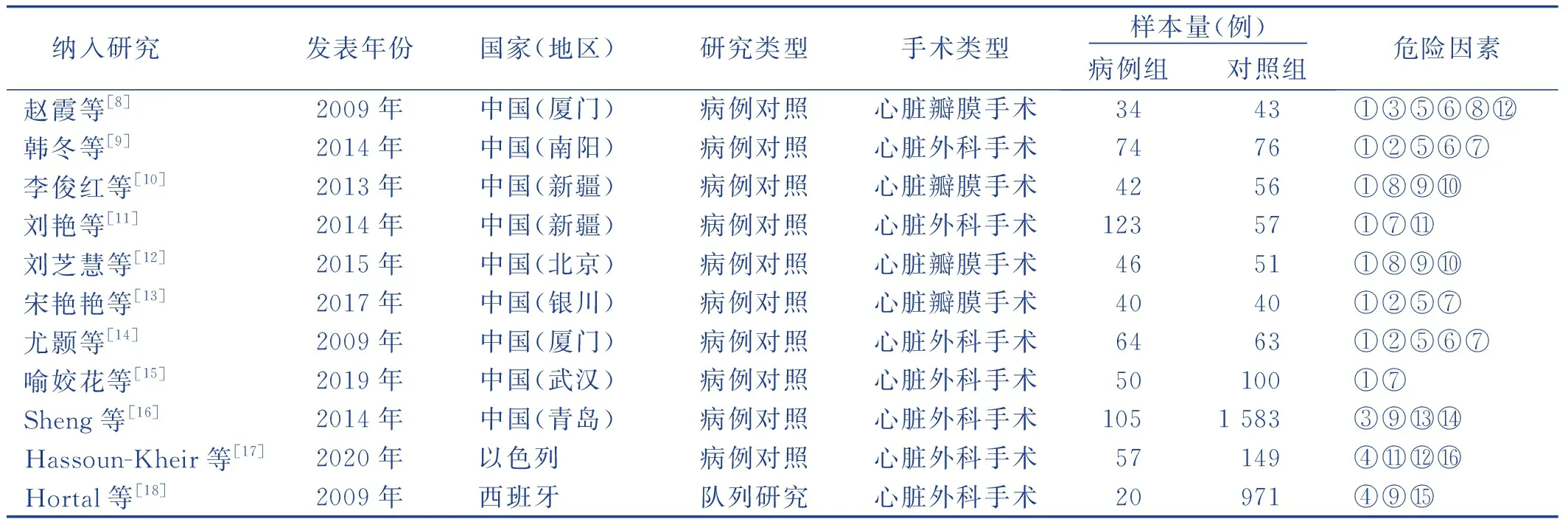
表1 納入文獻基本特征
2.3 納入研究質量評價
所有納入研究均嚴格按照NOS標準進行評分,得分在6~8分,總體質量在中等以上。見表2。
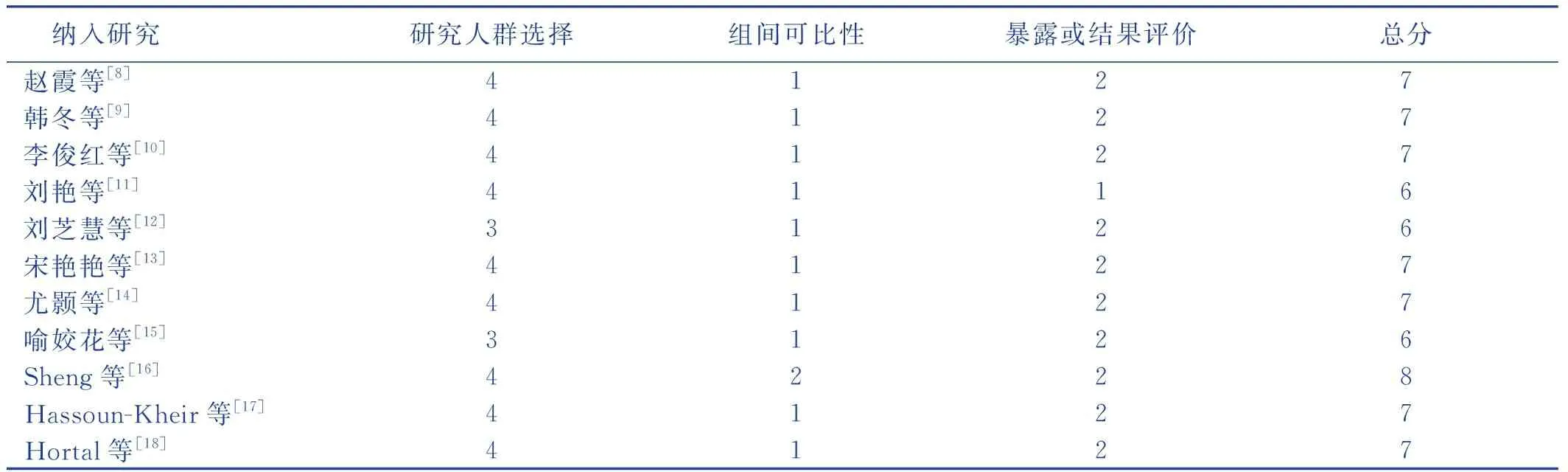
表2 納入文獻質量評價 單位:分
2.4 Meta分析結果
Meta分析結果顯示:體外循環時間≥120 min,輸血量>1 200 mL、術后氧合指數≤300 mmHg、氣管切開、機械通氣時間≥5 d、再次插管、應用抑酸劑、二次開胸、肺動脈高壓是心臟外科術后發生VAP的危險因素,差異均具有統計學意義(P<0.05),見表3。有研究報道,年齡>70歲、急診手術、升主動脈手術、充血性心力衰竭等因素也與心臟外科術后VAP有關,但文獻大多數僅為1篇,故未對此進行Meta分析。
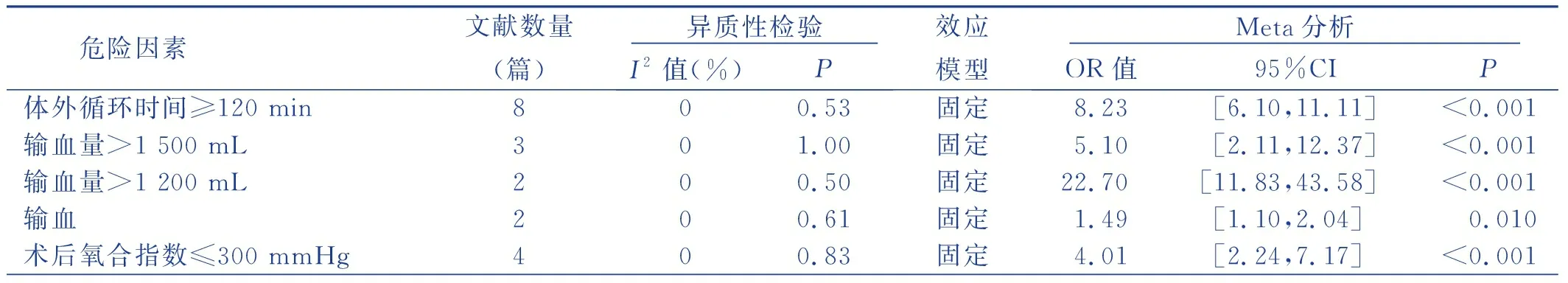
表3 心臟外科手術后發生VAP危險因素的Meta分析結果
2.5 敏感性分析
為檢驗分析結果的穩定性和可靠性,對納入的11項指標分別采用隨機效應模型和固定效應模型計算OR值和95%CI,討論其結果的穩定性。結果表明各危險因素在兩種模型下的合并效應接近,結果較為穩定。見表4。

表4 隨機和固定效應模型的效應量合并結果
2.6 發表偏倚
采用Egger′s檢驗對發表偏倚進行判斷,結果顯示,術后氧合指數≤300 mmHg(P<0.05)存在一定的發表偏倚,其余危險因素未見明顯偏倚。漏斗圖以術后氧合指數≤300 mmHg為例,見圖2。
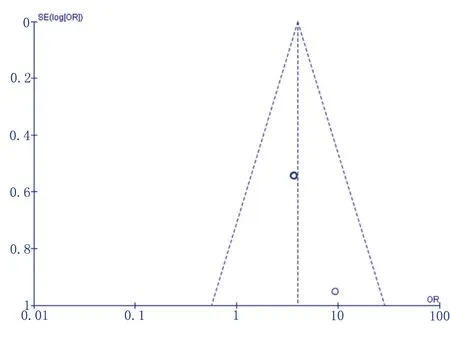
圖2 術后氧合指數≤300 mmHg發表偏倚評價
3 討論
3.1 納入文獻的特征分析
本研究共納入11篇文獻,以病例對照研究為主,研究對象共4 561例,其中9篇來自國內,2篇來自國外。依據NOS質量評分均在6~8分,說明文獻質量在中等以上。所有研究對象均為成年人,避免了因年齡造成的偏倚。所有研究均明確了研究對象的來源、結果的診斷標準,但是未區分心臟手術類型,可能會對結果造成一定的影響。
3.2 心臟外科術后VAP的危險因素分析
3.2.1 體外循環時間≥120 min
本研究表明,體外循環時間≥120 min與病人術后VAP發生密切相關。體外循環時間是術中唯一被證實可影響術后呼吸衰竭的危險因素,且體外循環時間越長,肺部損傷越嚴重[19],主要因為系統性炎癥反應導致白細胞在肺內黏附和聚集、多形核白細胞的激活等造成肺組織損傷和肺臟缺血/再灌注損傷;體外循環時血液稀釋造成低蛋白血癥,血漿膠體滲透壓下降、左心引流不暢等造成的肺功能受損;體外循環機造成血液成分的破壞,釋放組胺、激肽等物質使肺毛細血管通透性增加,出現水腫和出血,在肺內形成透明膜等[11]。體外循環時間延長可并發急性呼吸功能不全、引起機械通氣時間延長,從而導致VAP發生。因此,外科醫師需提高手術水平,加強與麻醉師、體外循環師及器械護士的配合,盡可能縮短體外循環時間,以減輕肺臟損傷。
3.2.2 術后氧合指數≤300 mmHg或機械通氣時間≥5 d
本研究表明,術后氧合指數≤300 mmHg或機械通氣時間≥5 d均為心臟手術后病人發生VAP的危險因素。有研究表明,呼吸機使用時間每延長1 d,VAP發病率增加2.0%~3.8%[20]。主要原因為心臟手術體外循環時間越長,肺組織損傷越嚴重,從而導致氧合指數越低[13];術后機械通氣支持過程中氣管插管可能導致咽喉部損傷,破壞氣道的防御功能;手術本身作為應激源,也可引起局部氣道防御功能減退,細菌易在氣道上皮細胞附著[9],從而增加肺部感染的機會,延長機械通氣輔助時間,增加VAP發生的風險。本研究對納入機械通氣時間≥4 d的3篇文獻[8,10,12]和機械通氣時間≥5 d的5篇文獻[9,11,13-15]進行亞組分析,結果顯示,機械通氣時間≥5 d,VAP的發生風險進一步增加。因此,心臟術后應積極控制原發疾病,早期使用抗生素[21-22],嚴格呼吸道管理,增強病人免疫力,盡快控制病情,在條件允許情況下盡早撤機以降低并發癥發生風險。
3.2.3 輸血量
本研究對輸血量>1 500 mL的3篇文獻[9,13-14]、>1 200 mL的2篇文獻[8,16]、未明確定義輸血量的2篇文獻[17-18]進行亞組分析,輸血量>1 500 mL時,合并OR值及95%CI為[5.10(2.11,12.37)];輸血量>1 200 mL時,合并OR值及95%CI為[22.70(11.83,43.58)],2篇文獻未明確定義輸血量,合并OR值及95%CI為[1.49(1.10,2.04)]。結果顯示,隨著輸血量的增加,VAP的發生風險隨之增加。心臟外科手術長時間的體外循環需消耗大量的血液制品,輸入的血液中常含有與受血者白細胞抗原相應的人類組織相容性抗原或抗粒細胞抗體,進而發生抗原抗體反應[23],引起肺損傷或病人免疫功能抑制,從而延長機械通氣時間,導致VAP發生風險增加。
3.2.4 氣管切開
氣管切開病人氣道正常組織結構和保護屏障遭到破壞,吞咽、咳嗽反射減弱或消失,也導致氣管內部暴露在空氣中[14],從而增加了病原菌侵入氣管的風險,加上病人免疫功能低下,從而增加了病人病原菌感染風險,最終導致機械輔助通氣時間延長,增加病人術后VAP的發生風險。
3.2.5 再次插管
再次插管主要是由于病人拔管后病情惡化、氣管套管脫出等原因引起,不僅延長了機械通氣時間,還增加了感染的風險[14];同時侵入性操作導致病人機體再次受到損傷,產生應激反應,導致免疫力下降,增加感染風險[9];再次插管時還會使口咽部潛在的致病菌被吸入[24]。因此,再次插管不僅可增加VAP的發生風險,還會增加死亡的風險[25]。
3.2.6 應用抑酸劑
本研究表明,應用抑酸藥可增加VAP發生的風險。抑酸藥是心臟外科術后通過降低胃液酸度預防應激性潰瘍的常用藥物,但胃酸降低可使胃內細菌大量繁殖,而胃食管反流過程中大量細菌隨反流液進入肺內引起肺部感染,進而發生VAP[12]。因此,在心臟術后應用抑酸劑時應將病人床頭抬高30°~45°或取半臥位,以減少胃內容物反流,或使用胃黏膜保護劑,如硫糖鋁等代替抑酸劑治療[10,26]。
3.2.7 二次開胸
心臟手術病人本身承受巨大的手術創傷,二次開胸術使病人再次經歷創傷,創傷導致機體免疫功能減弱[27],手術鎮靜時間延長、呼吸機使用時間延長等,進而發生VAP的風險增加。術中應嚴格止血并觀察各項指標,術后應密切觀察病人病情變化,及時檢測凝血功能,嚴格掌握輸血適應證等以減少二次開胸的機會。
3.2.8 肺動脈高壓
肺動脈高壓是一類以肺動脈內壓力異常升高,伴或不伴有小肺動脈病變為特征的疾病或病理生理綜合征,存在肺循環障礙和右心高負荷,可導致病人心力衰竭甚至死亡[28]。肺動脈高壓時由于肺血管擴張、血管平滑肌張力增加或增殖均可影響小氣道的功能[29],導致肺泡換氣功能受損,氧合指數降低,延長機械通氣輔助時間,從而增加VAP的發生風險。
3.3 研究的局限性及展望
1)本研究納入的文獻數量有限,樣本量較小,可能會導致結果在一定程度上出現偏差;2)由于國內外對心臟術后VAP發生的危險因素研究有限,且大多數為回顧性研究,文獻質量參差不齊,可能存在一定的發表偏倚;3)部分危險因素涉及的文獻數量較少無法進行數據的整合,也會對結果產生不同程度的影響。因此,未來還需開展更多設計嚴謹、大樣本、多中心的前瞻性研究,進一步明確心臟術后病人發生VAP的危險因素。
4 小結
本研究結果顯示:心臟外科術后VAP的危險因素共計9項,即體外循環時間≥120 min、輸血量>1 200 mL、術后氧合指數≤300 mmHg、氣管切開、機械通氣時間≥5 d、再次插管、應用抑酸劑、二次開胸、肺動脈高壓等。醫護人員應關注這些危險因素,早期識別心臟術后VAP高發人群,采取科學、有效的預防措施,減少心臟手術后VAP的發生。

