冷害對多茸毛型線辣椒幼苗生理水平的影響
陳 艷,黃璐瑤,鄧昌蓉,張彥君,侯全剛,邵登魁
(青海大學農林科學院/青海省蔬菜遺傳與生理重點實驗室,西寧 810016)
0 引 言
【研究意義】辣椒(CapsicumannuumL.),屬茄科辣椒屬植物[1],青海省為高原溫帶、高原亞寒帶和高原寒帶[2],其辣椒生產主要依靠日光溫室,尤其是冬春季生產100%依靠設施。辣椒受到低溫脅迫后,會出現生理生化代謝紊亂、形態發育失調、生活力降低乃至凋亡、植株發育遲緩和生殖生長嚴重失調[3]等。有研究將辣椒分為4個種,其中茸毛辣椒(CapsicumPubessensKeep.)是在安底斯山區廣泛栽培的高原種[4]。茸毛作為一種天然的屏障,可以減少植物與病原物的接觸。植物茸毛性狀與植物的抗逆性相關,除了抗蟲、抗病外,茸毛性狀也被認為具有保溫和防紫外線的作用[5-8]。研究特色辣椒種質資源,對于選育適宜當地設施栽培的辣椒品種具有重要意義。青線椒2號高花果率高、抗病性強、抗寒性較高,是青海特色種質資源,綜合評價青線椒2號,對于新種質的認知和高效利用具有重要意義。【前人研究進展】在西北地區具有茸毛性狀的植物可能擁有更好的抗寒性。多數辣椒栽培品種一般不具茸毛[9],而多茸毛型線辣椒青線椒2號是由少茸毛的“循化線辣椒”群體中的天然變異株經選育而成的新品種,其莖、葉柄密著白色茸毛[10]。【本研究切入點】辣椒對溫度的要求介于茄子和番茄之間,其生長的最適溫度為24~28℃,低于15℃生長發育就會受到阻礙,低于10~12℃就會受到冷害,而且在整個生育期都易受冷害[11, 12]。需研究茸毛型線辣椒種質資源的抗寒性以及對低溫的適應性。【擬解決的關鍵問題】以多茸毛型線辣椒品種青線椒2號為材料,對其進行不同溫度、不同周期長度的低溫脅迫處理,測定其幼苗在溫度梯度處理及時間梯度處理下的SOD活性、可溶性糖含量、可溶性蛋白質含量、丙二醛含量等生理指標的變化,進行顯著性分析,為茸毛型種質資源利用提供參考。
1 材料與方法
1.1 材 料
選用多茸毛型線辣椒品種青線椒2號,由青海農林科學院提供。
1.2 方 法
1.2.1 試驗設計
田間試驗地點在青海省農林科學院園藝創新基地。采用72孔穴盤進行育苗,待幼苗在溫室中長至4葉1心時,取長勢一致的壯苗移入光照培養箱中進行低溫處理,試驗共設置4個處理,3次重復,每個重復30株。表1
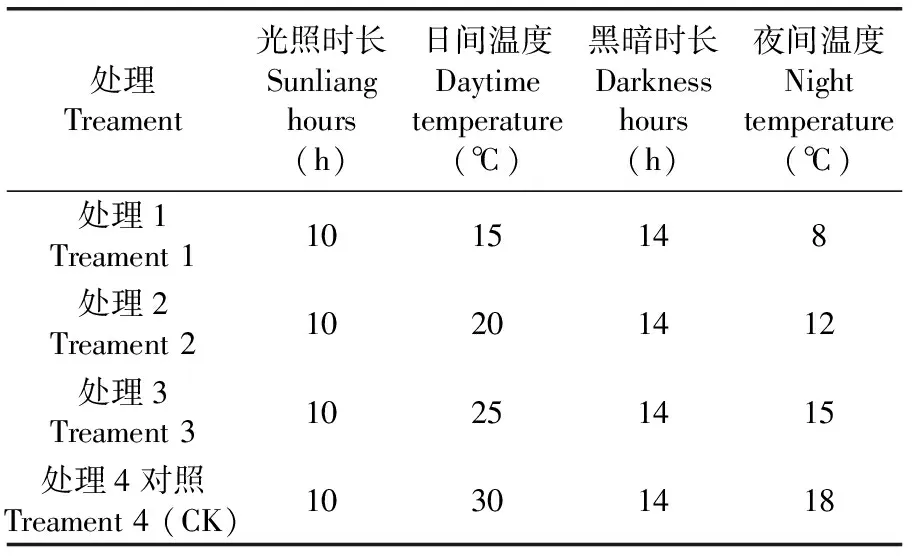
表1 試驗設計
1.2.2 測定指標
各組在分別處理15、30、45、60 d后,在各處理時間段取樣,用于測定不同處理下的生理指標。
超氧化物歧化酶(SOD)活性采用氮藍四唑法[13]測定。
可溶性糖含量測定采用蒽酮比色法[14],以蔗糖溶液制作標準曲線。
可溶性蛋白含量測定采用考馬斯亮藍染色法[15],可溶性蛋白質的提取同SOD酶液提取方法,以牛血清白蛋白制作標準曲線。
丙二醛(MDA)含量采用硫代巴比妥酸比色法[16]測定。
1.3 數據處理
利用Excel 2010進行數據處理,Origin 2019制圖,利用SPSS 22.0進行差異顯著性分析與相關性分析。
2 結果與分析
2.1 超氧化物歧化酶(SOD)活性的變化
2.1.1 同一處理天數不同處理間SOD活性比較
研究表明,4個處理的SOD活性在處理60 d時整體上達到最低水平,4個處理的平均值為90.42 μ/g,最小值為處理4,為90.4 μ/g;4個處理的SOD活性峰值出現在處理30 d時,平均值為122.25 μ/g,最大值為處理2,達到138.64 μ/g;與處理15 d時SOD活性最小值相比,增加了16.61%。圖1
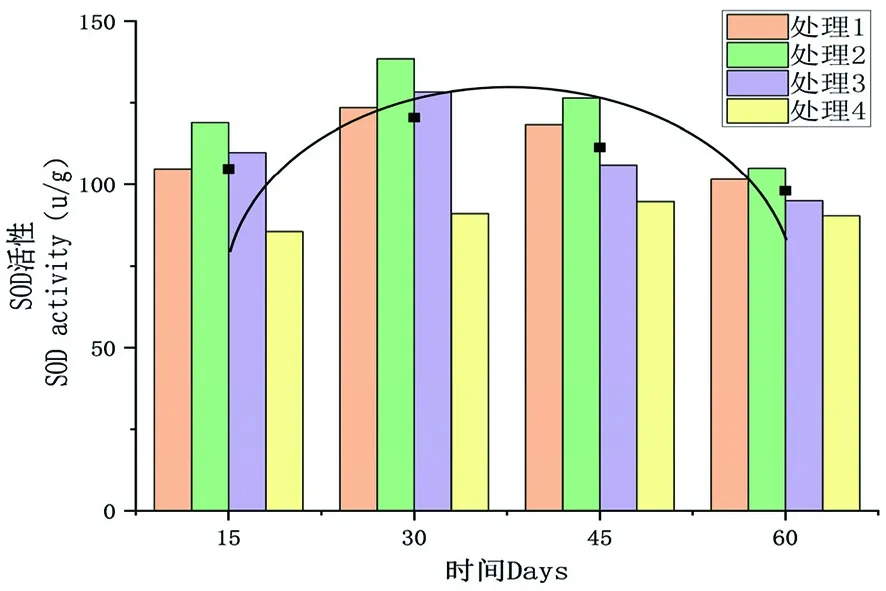
圖1 不同時間下各處理組SOD活性的變化
2.1.2 全周期不同處理間SOD活性比較
研究表明,除了對照組變化不明顯外,其它3個處理均是先升高后降低趨勢,其中最大值為處理2,峰值出現在處理30 d時,而對照處理的峰值出現在處理45 d時。處理15 d時,各處理組之間SOD活性均存在顯著性差異。處理30 d時,各處理與對照間均存在顯著差異;處理1和處理2、處理3間存在顯著差異;。處理45 d時,各處理和對照間存在顯著差異;處理1、處理2與處理3間在顯著性差異。處理60 d時,處理1、處理2與對照間存在顯著差異。表2,圖1

表2 不同溫度強度下SOD活性差異性比較
2.2 可溶性糖含量的變化
2.2.1 同一處理天數不同處理間可溶性糖含量比較
研究表明,隨低溫處理時間延長,可溶性糖含量呈先升高后降低趨勢,4個處理可溶性糖含量最低為處理60 d時,平均值為6.08 mg/g,最小值為處理4,為3.5 mg/g;4個處理SOD活性最高為處理處理45 d時,平均值為10.43 μ/g,最大值為處理3,為13.05 mg/g,相較于處理15 d,可溶性糖含量增加66.97%。圖2
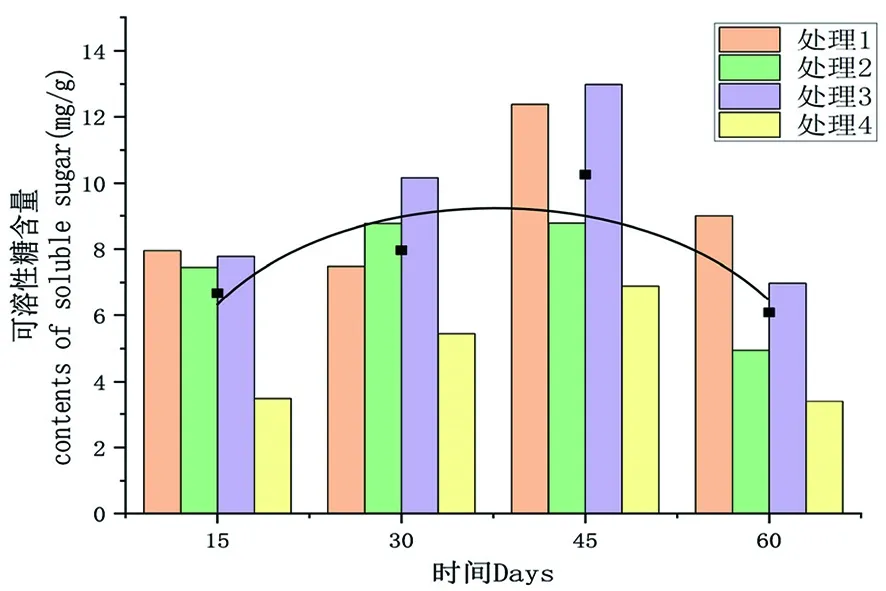
圖2 不同時間下各處理組可溶性糖含量變化
2.2.2 全周期不同處理間可溶性糖含量比較
研究表明,除了處理2可溶性糖含量變化相對較小,其他3個個處理的變化趨勢均為先上升后下降。其中最大值為處理3,峰值出現在處理45 d時,而對照組的峰值出現在處理45 d時。處理間顯著性檢驗結果表明,在處理15 d時,各處理與對照間均存在顯著差異。處理30 d時,各處理與對照間存在顯著差異;處理1、處理2與處理3間存在顯著差異。處理45 d時,各處理和對照間存在顯著差異;處理1、處理3和處理2間存在顯著差異。處理60 d時,各處理組之間可溶性糖含量均存在顯著性差異。表3,圖2
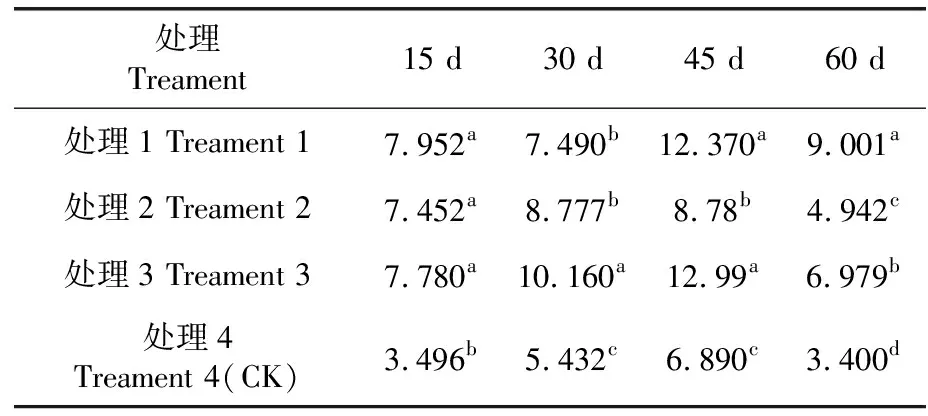
表3 不同溫度強度下可溶性糖含量差異性比較
2.3 可溶性蛋白質含量的變化
2.3.1 同一天數下不同處理間可溶性蛋白質含量比較
研究表明,隨低溫處理時間延長,可溶性蛋白質含量呈先升高后降低趨勢,4個處理組可溶性糖含量最低出現在處理60 d時,平均值為12.62 mg/g,最小值為處理2,含量為11.05 mg/g;4個處理組可溶性糖含量最高為處理30 d時,平均值為45.11 mg/g,最大值為處理4,為64.68 mg/g,相較于處理15 d時,可溶性蛋白含量增加330.00%。圖3
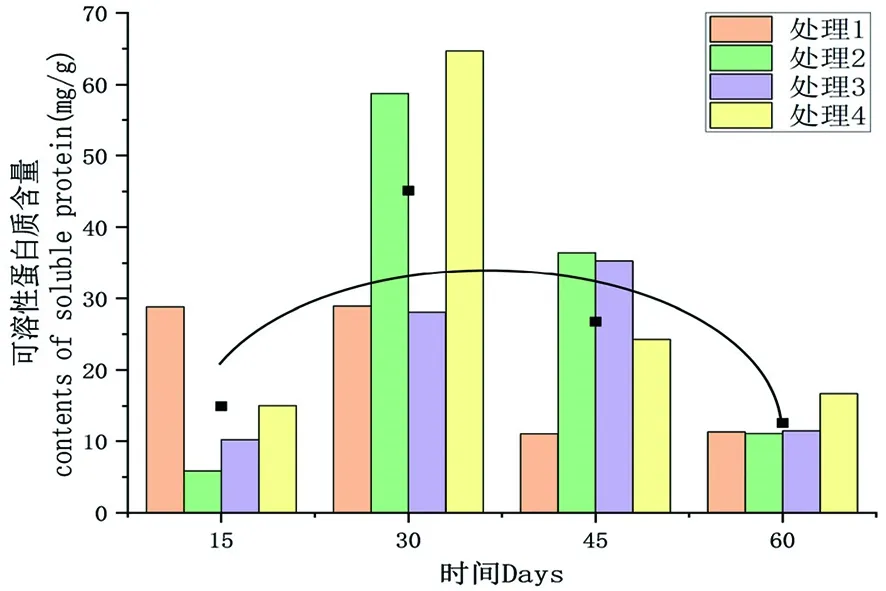
圖3 不同時間下各處理組可溶性蛋白質含量變化
2.3.2 不同處理間可溶性蛋白質含量比較
研究表明,各處理均是先升高后降低趨勢,其中最大值為對照組處理4,峰值出現在處理30 d時。在處理15 d時,各處理組之間可溶性蛋白質含量均存在顯著差異。處理30 d時,處理1、處理3與對照間存在顯著差異;處理1、處理3和處理2間存在顯著差異。在處理45 d時,處理1與對照組間存在顯著差異;處理1與處理2、處理3間存在顯著差異。到處理60 d時,處理1、處理2、處理3與對照間存在顯著差異。表4,圖3
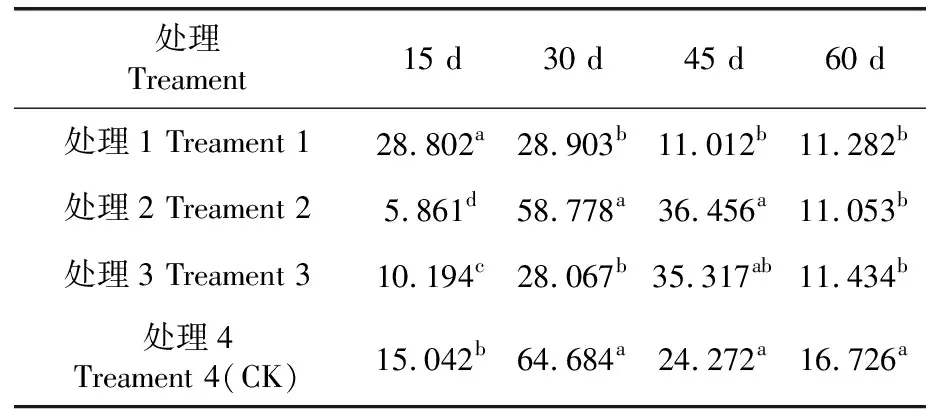
表4 不同溫度強度下可溶性蛋白質含量差異性比較
2.4 MDA含量的變化
2.4.1 同一天數下不同處理間MDA含量比較
研究表明,隨低溫處理時間延長,丙二醛含量呈先上升后下降的變化趨勢,整體上4個處理丙二醛含量最低值出現在處理60 d,平均值為1.78 mol/L,最小值出現在處理4,為1.62 mol/L;4個處理丙二醛含量最高值出現在處理30 d,平均值為2.63 mol/L,最大值出現在處理3,為3.19 mol/L,相較于處理15 d時,MDA含量增加60.32%。圖4
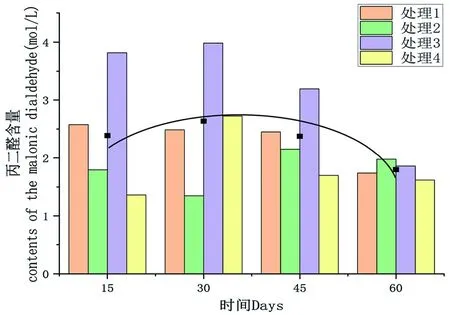
圖4 不同時間下丙二醛含量變化
2.4.2 不同處理間丙二醛含量比較
研究表明,處理1、處理2丙二醛含量變化趨勢為先下降后上升再下降;處理3、處理4丙二醛含量變化趨勢為先上升后下降。在處理15 d時,處理1、處理3與對照組間存在顯著差異;處理1和處理3間存在顯著差異。在處理30 d時,處理2、處理3與對照組間存在顯著差異;處理1、處理2和處理3各處理間存在顯著差異。處理45 d時,對照組與其他3組存在顯著差異;處理1、處理2和處理3間存在顯著差異。到處理60 d時,處理2與對照組間存在顯著差異;處理1和處理2之間存在顯著差異,處理2與處理3存在顯著差異。表5,圖4
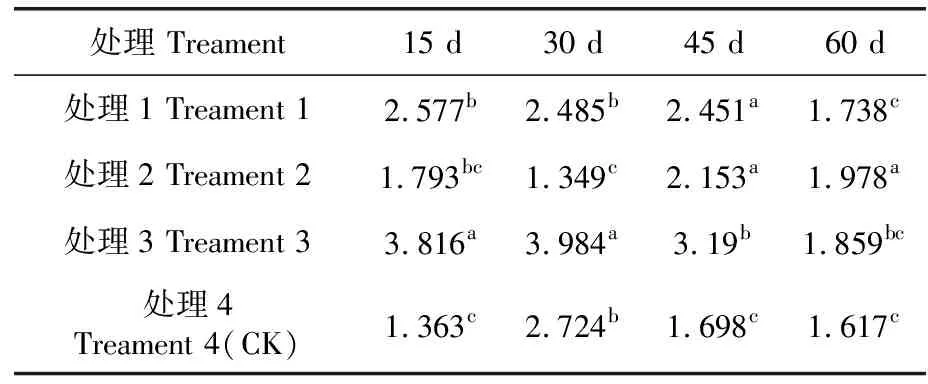
表5 不同溫度強度下丙二醛差異性比較
3 討論
3.1 SOD活性反映出材料對高低溫度響應的差異性
SOD酶活性的變化可以作為評價植物耐熱抗寒性的重要指標[17]。試驗結果表現為各處理組SOD活性變化趨勢為先升高后下降。SOD含量變化幅度最小的是處理4,變化幅度最大的處理2,其變量絕對數值約為處理4的3.7倍。SOD酶活性對植物的抗逆性影響是有一定的閾值的[18]。隨著脅迫時間的延長,處理4 SOD活性的變化并不是很大,SOD活性整體水平比較低、啟動慢或未啟動應激反應,而其他3組峰值的數值與處理15 d時相比增幅均在16%以上,最高接近于18%,在處理60 d時,3組的SOD活性均低于各組在處理15 d時的數值。當植物受到脅迫時,會產生氧化應激反應,造成體內大量ROS積累,引起膜脂過氧化,影響植物體內生理代謝平衡,此時SOD作為重要抗氧化酶協同其他功能蛋白清除活性氧,緩解對植物的傷害。3個處理組的處理溫度均低于試驗材料的最適宜生長溫度,SOD活性的升高可以及時清除低溫脅迫下植物體內積累的過氧化物質,但過低的溫度又會抑制SOD酶的活性,導致植物體內的ROS大量積累,造成不可逆的損傷[19],隨著處理時間的延長,SOD的活性又大幅下降。試驗總處理時長為60 d,其中處理4的白天處理溫度為30℃,屬于長時間稍高溫度更傾向于產生對植物的間接傷害。可能是由于持續高溫破壞了植物體內的酶結構或酶系統,也可能是隨著時間的延長,并不是過于極端的較高溫使得植物出現抗逆性,表現出植物在SOD活性水平上的高溫適應性。
3.2 可溶性糖變化反映了材料在低溫和常溫的一致性
研究中各組的可溶性糖含量變化趨勢均表現為“升高-降低”,且各組峰值均出現在處理45 d時,處理1和處理3水平相當,處理3的日間處理溫度為25℃,是最接近于試材最適宜生長溫度的處理,低溫造成的水解作用不明顯,低溫沒有引起茸毛型種質資源青線椒2號的糖代謝紊亂,表現為更好的抗寒性,與趙一航等[20]的研究結果相同。處理溫度的略高或略低都導致了可溶性糖含量的降低:處理4的可溶性糖水平比較低,原因可能是由于暗處理溫度較高,呼吸作用太強,消耗掉了大量的可溶性糖。較低的膜透性是植物耐高溫的生理基礎[21],隨著脅迫時間的延長,導致了在處理4中可溶性糖含量整體水平較低,處理2作為略低溫處理,相對于處理4,其可溶性糖含量較高,也更接近于處理3的可溶性糖含量水平。茸毛型品種可能具有更優良的的抗寒性以及對低溫脅迫的適應性。
3.3 可溶性蛋白質變化反映出材料在低溫下無明顯膜氧化
可溶性蛋白為重要的滲透調節物質和營養物質,其含量增加和積累能提高細胞的保水能力,對細胞的生命物質及生物膜起到保護作用,經常用作篩選抗性的指標之一。與可溶性糖含量變化一致,試驗可溶性蛋白質含量的變化趨勢為先升高后降低。研究中處理1(低溫)和處理3(常溫)可溶性蛋白質含量水平與變化趨勢一致,無顯著差異,在這2種處理中蛋白質主要以儲存方式存在,溶解性較低,不是以滲透調節和膜過氧化保護形態存在,證明了青線椒2號耐低溫性優良。處理4水平較高,受到了高溫脅迫,可能是該材料來源于青藏高原冷涼氣候條件下的個體變異,對高溫的耐受度比較低,也因此較高的光暗處理溫度引起其代謝失調,表現出較高的可溶性糖水平,試驗結果表明可溶性糖與可溶性蛋白質含量呈極顯著負相關,二者同樣作為滲透調節物質,均可反應植物對非生物脅迫的耐受力,但可溶性蛋白質含量峰值出現的時間要早于可溶性糖,并且其變化幅度也較大,可溶性蛋白質對于溫度脅迫相應更敏感,可溶性蛋白質的快速響應也可以提高植物對非生物脅迫的適應性。
3.4 丙二醛變化反映材料在低溫下氧化產物積累不明顯
丙二醛作為氧化終極產物,其含量高低代表著受損細胞膜氧化還原反應的水平。處理1變化幅度不大,低溫對青線椒2號細胞中的氧化產物積累作用不大,也就間接證明了其抗寒性較強,與前人研究結果一致[20, 22]。而處理3條件下,其溫度處理在4各處理間為最適宜的,但其丙二醛水平卻是最高,原因為試材受到水鹽脅迫,由于在試驗處理過程中,每日澆水量以及施肥量均為人工控制,不能做到控制唯一變量從而導致產生誤差;試材受到病害或受其他植物影響,試驗各處理組分別配置獨立低溫培養箱,處理3可能在處理過程中受到病害侵染從而產生試驗誤差。到處理45 d時,丙二醛含量都維持著較高的水平,SOD活性、可溶性蛋白質的含量也較高,植物體內的生理代謝較為旺盛,隨著脅迫時間的延長每個指標水平都趨于下降,可能是由于試材經過低溫鍛煉對低溫環境的適應性有所提高。
3.5 材料具有較強抗寒性
溫度對于植物的整個生長階段都有影響,除了影響作物的品質產量外,低溫還極大地限制了植物的地理分布,尤其是野生植物[23],了解植物在低溫脅迫下的反應機制以及選育抗寒性強的植物種質資源新品種變得尤為重要。
李紅霞等[24]認為植物在長期進化的過程中形成了復雜高效的分子調控機制,引起植物細胞形成在生理和生化水平上的適應性調整,對于植物抗寒性的評定還應結合多方面進行分析評價,綜合評定植物抗寒性。
4 結 論
4.1隨著脅迫時間的延長,各生理指標整體變化趨勢為先增加后降低,其中可溶性蛋白質含量的變化幅度最大。在處理的最后1 d,即處理第60 d,不同處理溫度下的各指標含量(活性)均低于第15 d時的含量(活性)。而在處理2、處理3中,即處理溫度分別為20、25℃的處理組中,在大部分時間下各指標含量要顯著高于處理4(CK),表現出更高的生理活性與代謝能力,青線椒2號苗期適宜生長溫度范圍為20~25℃。在處理第60 d時與處理15 d相比,SOD作為保護物質,以及MDA含量均有所下降,并且可溶性蛋白含量與可溶性糖含量、丙二醛含量具有顯著相關性,在線辣椒抗寒性分析時可將其作為評價指標。
4.2青線椒2號各指標都表現出了較高水平,多茸毛型辣椒具有較好的耐低溫性,隨著脅迫時間的延長,對低溫環境的較強適應性,多茸毛材料對低溫逆境具有一定抗性,在誘導抗性表現也比較強。

