微小RNA-335-5p靶向軸突導向因子3B對子宮內膜癌細胞增殖、凋亡的影響
王秋菊,鄭麗雅,申 巖,王園園
(1.保定市第一中心醫院,河北 保定 071000;2.保定市安國市醫院,河北 保定 071200)
子宮內膜癌是女性生殖系統最常見的惡性腫瘤,近年來該病的發病率持續上升,并且呈現年輕化趨勢[1]。微小RNA(microRNA,miRNA)是一類可調控胞內基因表達的非編碼RNA,許多研究表明miRNA對細胞增殖、分化、凋亡等過程具有重要影響[1-2]。目前已報道子宮內膜癌中存在多種miRNA表達異常,例如miR-195的下調[3],miR-107-5p的上調[4]等。miR-335-5p被發現在宮頸癌[5]、前列腺癌[6]、甲狀腺癌[7]等多種癌癥中表達異常,對癌癥的發生發展存在一定影響。軸突導向因子3B(Semaphorin3B,SEMA3B)屬于信號素蛋白3(Semaphorins3,SEMA3)亞家族成員,研究表明SEMA3B與抗腫瘤關系密切。Zhong等[8]研究發現,在肝癌組織中存在SEMA3B的表達下調,過表達SEMA3B可降低肝癌細胞增殖率,另外低水平的SEMA3B與生存期差密切相關。Guo等[9]研究報道,在胃賁門腺癌組織和胃癌細胞中檢測到SEMA3B的表達下調,啟動子區異常高甲基化具有更強的腫瘤特異性,且與SEMA3B的表達水平呈負相關,過表達SEMA3B可以抑制胃癌細胞的增殖、遷移和侵襲。本研究通過體外細胞實驗,探究miR-335-5p對子宮內膜癌細胞增殖、凋亡的影響,以期尋找新的子宮內膜癌治療靶點。
1 材料與方法
1.1 實驗材料 人子宮內膜上皮細胞ESC、人子宮內膜癌細胞Ishikawa,上海ATCC細胞庫;收集本院2020年1-12月收診的20例子宮內膜癌患者子宮內膜癌組織及其癌旁組織,患者均簽署知情同意書;miR-335-5p陰性對照(miR-335-5p NC)、miR-335-5p模擬物(miR-335-5p mimics)、miR-335-5p抑制物(miR-335-5p inhibitor)、過表達空載體(pcDNA)、SEMA3B過表達重組載體(pcDNA-SEMA3B)、RNA干擾陰性對照(si NC)、RNA干擾SEMA3B(si SEMA3B)以及miR-335-5p、SEMA3B、U6、GAPDH引物,上海生工生物有限公司;Lipofectamine 2000轉染試劑盒、BCA蛋白定量分析試劑盒,賽默飛世爾科技(中國)有限公司;總RNA提取純化一體試劑盒,美國ZYMO RESEARCH公司;Annexin V-FITC/PI細胞凋亡檢測試劑盒,美國BD公司;雙熒光素酶報告基因檢測試劑盒,上海碧云天生物技術有限公司;羊抗兔IgG(HRP)抗體、兔抗人SEMA3B抗體,艾博抗(上海)貿易有限公司。
1.2 實驗方法
1.2.1 實驗分組及細胞轉染:將Ishikawa細胞隨機分為:對照組(未轉染)、miR-335-5p NC組(轉染miR-335-5p NC)、miR-335-5p inhibitor組(轉染miR-335-5p inhibitor)、pcDNA組(轉染pcDNA)、pcDNA-SEMA3B組(轉染pcDNA-SEMA3B)、miR-335-5p NC+si NC組(轉染miR-335-5p NC和si NC)、miR-335-5p inhibitor+si NC組(轉染miR-335-5p inhibitor和si NC)、miR-335-5p NC+si SEMA3B組(轉染miR-335-5p NC和si SEMA3B)、miR-335-5p inhibitor+si SEMA3B組(轉染miR-335-5p inhibitor和si SEMA3B)。在6孔板中接種2 ml/孔的Ishikawa單細胞懸液(1×105/ml),37 ℃、5% CO2條件下培養約24 h,待細胞達到80%匯合度時,棄去6孔板中培養基,PBS洗滌去除雜質,加入2 ml/孔的新鮮無雙抗細胞培養基,按照Lipofectamine 2000試劑盒說明書步驟進行細胞轉染,隨后37 ℃、5% CO2條件下培養36 h。
1.2.2 雙熒光素酶法驗證miR-335-5p和SEMA3B靶向關系:通過Target Scan網站(http://www.targetscan.org/mmu_72/)在線預測miR-335-5p靶基因,選定SEMA3B進行驗證。雙熒光素酶實驗分為:SEMA3B-WT+miR-335-5p mimics組、SEMA3B-WT+miR-NC組、SEMA3B-MUT+miR-335-5p mimics組、SEMA3B-MUT+miR-NC組,每組設置6個復孔,使用Lipofectamine 2000試劑盒進行細胞共轉染,細胞轉染24 h后,使用雙熒光素酶檢測試劑盒檢測細胞熒光強度。
1.2.3 qRT-PCR檢測miR-335-5p和SEMA3B表達:取癌組織和癌旁組織,剪碎放入研缽,加適量液氮迅速研磨至粉末,收集于離心管。Ishikawa細胞和ESC細胞經胰酶消化,收集于離心管。向離心管中加入1 ml細胞裂解液,冰上裂解10 min。根據細胞總RNA提取試劑盒說明書操作,提取細胞總RNA,反轉錄合成cDNA模板,隨后進行qRT-PCR。qRT-PCR反應條件:95 ℃、30 s預變性;95 ℃、5 s變性;60 ℃、30 s退火;40個循環;4 ℃保存。將U6和GAPDH設置為內參,2-ΔΔCt法計算結果。引物見表1。

表1 引物序列
1.2.4 蛋白質免疫印跡(WB)檢測SEMA3B蛋白表達:研磨癌組織和癌旁組織,胰酶消化并收集ESC細胞和Ishikawa細胞,均經過細胞裂解液裂解后,12 000 r/min、4 ℃低溫離心10 min,吸取上清液通過BCA法定量蛋白。取等量蛋白,與上樣緩沖液充分混勻,沸水浴10 min,上樣至凝膠孔中進行電泳。電泳結束后取出凝膠,通過電轉儀將蛋白轉至PVDF膜上,將膜浸入5%脫脂奶溶液中封閉2 h,再浸入一抗(SEMA3B抗體)稀釋溶液在4 ℃搖床中孵育過夜,洗滌后浸入二抗(羊抗兔IgG抗體)稀釋溶液室溫搖床中孵育1 h,洗滌后顯色并拍照,Image J系統分析結果。
1.2.5 MTT法檢測細胞增殖:收集1.2.1中轉染后細胞移至96孔板,待細胞貼壁后每孔加入10 μl MTT溶液,細胞培養箱中孵育4 h,棄去孔中廢液,每孔加入150 μl DMSO,避光震蕩混勻10 min,測定每孔細胞在570 nm處的吸光度(A)值。細胞增殖率(%)=(A實驗組或對照組-A空白組)/(A對照組-A空白組)×100%,A空白組表示150 μl DMSO的A570 nm值,排除本底對結果的影響。
1.2.6 流式細胞術檢測細胞凋亡:取1.2.1中細胞,棄培養基,PBS洗滌,胰酶消化,離心收集細胞。用凋亡試劑盒中的緩沖液重懸細胞,將細胞密度調整為1×106個/ml。取100 μl細胞加入流式管,再向其中加入5 μl Annexin V-PI抗體和5 μl Annexin V-FITC抗體,混勻,黑暗孵育15 min,加入400 μl緩沖液混勻后上樣流式細胞儀檢測細胞凋亡。
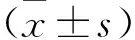
2 結 果
2.1 miR-335-5p與SEMA3B靶向關系 預測結果顯示,SEMA3B和miR-335-5p間存在連續的結合位點(圖1)。與SEMA3B-WT+miR-NC組比較,SEMA3B-WT+miR-335-5p mimics組的熒光素酶活性明顯下降(P<0.05);SEMA3B-WT+miR-NC組、SEMA3B-MUT+miR-NC組、SEMA3B-MUT+miR-335-5p三組之間比較差異無統計學意義(均P>0.05),見表2。

注:WT為野生型,MUT為突變型圖1 miR-335-5p和SEMA3B 3’UTR結合位點
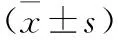
表2 各組細胞熒光素酶活性
2.2 子宮內膜癌組織和癌旁組織以及ESC細胞和Ishikawa細胞中miR-335-5p和SEMA3B的表達 與癌旁組織比較,子宮內膜癌組織miR-335-5p表達顯著升高,SEMA3B mRNA和蛋白表達顯著降低(均P<0.05)。與ESC細胞比較,Ishikawa細胞miR-335-5p表達顯著升高,SEMA3B mRNA和蛋白表達顯著降低(均P<0.05)。見表3、4。
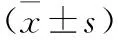
表3 子宮內膜癌組織和癌旁組織中miR-335-5p和SEMA3B的表達
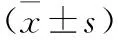
表4 ESC細胞和Ishikawa細胞中miR-335-5p和SEMA3B的表達
2.3 抑制miR-335-5p對Ishikawa細胞增殖、凋亡的影響 與對照組比較,miR-335-5p inhibitor組細胞增殖率顯著降低、細胞凋亡率顯著升高(均P<0.05),與miR-335-5p NC組比較差異無統計學意義(P>0.05);與miR-335-5p NC組比較,miR-335-5p inhibitor組細胞增殖率顯著降低,細胞凋亡率顯著升高(均P<0.05)。見表5。

表5 抑制miR-335-5p對Ishikawa細胞增殖、凋亡的影響(%)
2.4 過表達SEMA3B對Ishikawa細胞增殖、凋亡的影響 與對照組比較,pcDNA-SEMA3B組細胞增殖率顯著降低、細胞凋亡率顯著升高(均P<0.05),與pcDNA組比較差異無統計學意義(P>0.05);與pcDNA組比較,pcDNA-SEMA3B組細胞增殖率顯著降低、細胞凋亡率顯著升高,差異有統計學意義(均P<0.05)。見表6。

表6 抑制SEMA3B對Ishikawa細胞增殖、凋亡的影響(%)
2.5 抑制miR-335-5p和干擾SEMA3B對Ishikawa細胞增殖、凋亡的影響 與miR-335-5p NC+si NC組比較,miR-335-5p inhibitor+si NC組細胞增殖率降低、細胞凋亡率升高(均P<0.05),與miR-335-5p NC+si SEMA3B組比較細胞增殖率升高,細胞凋亡率降低(均P<0.05)。與miR-335-5p NC+si SEMA3B組比較,miR-335-5p inhibitor+si SEMA3B組細胞增殖率降低、細胞凋亡率升高(均P<0.05)。與miR-335-5p inhibitor+si NC組比較,miR-335-5p inhibitor+si SEMA3B組細胞增殖率升高、細胞凋亡率降低,差異有統計學意義(均P<0.05)。見表7。

表7 抑制miR-335-5p和干擾SEMA3B對Ishikawa細胞增殖、凋亡的影響(%)
3 討 論
子宮內膜癌是一種常見的女性惡性腫瘤,近年來發病率不斷攀升,其主要危險因素包括遺傳、糖尿病、肥胖、初潮早、絕經晚等[10-11]。傳統觀點認為子宮內膜癌分為兩種病理類型:Ⅰ型和Ⅱ型,90%左右的患者為Ⅰ型,即子宮內膜樣腺癌。該型子宮內膜癌的分級低、預后好,5年生存率超過80%,因此患者及時接受治療,能較好的改善生存質量。本研究以子宮內膜癌發生發展所涉及的關鍵分子為切入口進行研究,以期為其診斷和治療提供新的靶標。
miRNA為內源性非編碼RNA,可通過結合靶mRNA的3’-非翻譯區來調控基因的表達。miRNA表達異常通常涉及癌癥和代謝疾病[12]等。Zhang等[13]研究報道,胃癌組織中miR-335-5p表達下調,上調miR-335-5p對胃癌細胞的增殖和侵襲起到抑制作用。Wang等[14]利用星狀細胞來源的外囊泡裝載miR-335-5p,在體內、體外均可被肝癌細胞吸收,向受體肝癌細胞提供miR-335-5p,體外抑制肝癌細胞增殖和侵襲,體內誘導肝癌細胞收縮。冉偉等[15]對72例宮頸癌患者進行檢測后發現,宮頸癌組織中存在miR-335-5p的高表達。由此推測,在不同癌癥中miR-335-5p存在異質性,對癌癥的發生發展起著截然不同的作用。在本研究中,子宮內膜癌組織和Ishikawa細胞中存在miR-335-5p的高表達,抑制miR-335-5p表達后,Ishikawa細胞的增殖率顯著降低,凋亡率顯著升高。提示miR-335-5p可促進子宮內膜癌細胞增殖,抑制癌細胞凋亡,對子宮內膜癌的發生發展起到推動作用。
SEMA3B屬于Semaphorins家族,該家族最早發現于對神經系統胚胎時期軸向發育的研究中。SEMA3B是抑癌基因[16],可作為可溶性配體介導細胞凋亡,在抑制腫瘤新生血管和腫瘤發生發展過程中起到重要的抑制作用[17-18]。多個研究表明,SEMA3B在黏液表皮樣癌[19]、食管癌[20]、子宮內膜癌[21]等癌癥中存在缺失或下調。本研究結果顯示,子宮內膜癌組織和Ishikawa細胞中存在SEMA3B的低表達,而過表達SEMA3B后,Ishikawa細胞的增殖率顯著降低,凋亡率顯著升高。提示SEMA3B在子宮內膜癌細胞增殖過程中起抑制作用。本研究通過雙熒光素酶法驗證了miR-335-5p和SEMA3B的靶向關系。另外,進一步發現干擾SEMA3B可逆轉miR-335-5p inhibitor的抑癌作用。
綜上所述,抑制miR-335-5p可靶向上調SEMA3B表達,進而抑制子宮內膜癌細胞增殖,促進其凋亡。本研究結果有助于篩選子宮內膜癌治療靶點,后續將開展體內動物實驗進一步探究miR-335-5p對子宮內膜癌細胞惡性生物學行為的影響。

