三七總皂苷對短暫性前腦缺血大鼠海馬區神經元的修復作用實驗研究
楊 濤,劉 勇,曹興華,梁艷山,柯雪茹,陳 杰,馬曉媛
(新疆醫科大學附屬中醫醫院手術麻醉科,新疆 烏魯木齊 830000)
腦卒中是由大腦供血動脈狹窄、閉塞、破裂引起的,是嚴重危害人類健康的難治性疾病,已成為世界第二大致殘、致死疾病,大大降低了患者的生活自理能力,嚴重危害了患者的生活及健康[1]。近年來,隨著人們生活水平的上升,高能量、高脂肪過量攝入,腦卒中發病率逐年上升,其已成為引起人類死亡的主要原因。在腦卒中的疾病發病過程中,缺血性腦卒中占比約為80%,目前對于腦卒中后出現的神經元損傷機制尚不明確,臨床上缺乏理想的治療手段[2]。不同腦缺血對于缺血損傷敏感度差別較大,與其他腦區相比,海馬區對缺血損傷更為敏感,因此其常用于腦缺血的機制研究中[3]。海馬是中樞神經系統中一個重要的大腦區,生理功能復雜,同時會參與多種中樞神經系統疾病的發生、發展,與學習、記憶、情緒密切相關,海馬中的各種神經成分相對獨立分離,為有高度有序化的被層結構[4],因此海馬結構多用于研究神經元可塑性、神經系統發育、學習記憶的生理機制、中風、癲癇等疾病[5]。三七是五加科人參屬植物,主產于廣西、云南、四川等地,具有消腫止痛、止血化瘀的功效[6]。三七的主要成分包括三七素、三七總皂苷、黃酮、揮發油、糖類、氨基酸、各類微量元素等,其中七總皂苷是三七的主要活性組成成分,對腦神經細胞損傷具有保護作用,對腦血流功能具有改善作用[7],而其對海馬神經元的作用研究較少。因此,本文分析三七總皂苷對短暫性前腦缺血大鼠海馬區神經元的作用,以為短暫性前腦缺血大鼠選擇有效的治療方法提供依據。
1 材料與方法
1.1 實驗材料
1.1.1 試劑與藥物:三七總皂苷購自揚子江藥業集團有限公司,多聚賴氨酸購自Sigma公司。
1.1.2 實驗動物:選擇健康的SD大鼠由新疆醫科大學實驗動物中心,SPF級,每只250~300 g。
1.2 實驗方法
1.2.1 動物分組及造模:選擇30只SD大鼠,隨機分為三七總皂苷組、模型組、假手術組,每組10只。模型組與三七總皂苷組造模:使用四血管閉塞建立短暫性前腦缺血大鼠動物模型。室溫(22 ℃)下,使用10%水合氯醛對大鼠進行腹腔麻醉,劑量為300 mg/kg。將大鼠仰臥位固定在手術臺上,用碘伏對頸部進行消毒,在頸部正中偏右0.5 cm處做一縱向切口,長度為2 cm,之后將右側的頸外動脈、頸總動脈、頸內動脈分離,在動脈血流不中斷情況,將非創傷性卡環置于每個頸動脈周圍,同時在第一個頸椎處用電灼永久性閉塞椎動脈。動物從麻醉中恢復24 h,在此階段中,通過腦電圖、行為學、病理學標準不能將其與正常對照組分開,在24 h恢復期時,扣留食物,之后用手握住清醒大鼠,收緊頸動脈卡環,形成閉塞,扣環收緊后3~6 s內無反應,且在頸動脈閉塞期無反應的動物需排除。閉塞10、20、30 min后,將頸動脈卡環松開,以恢復頸動脈血流,使用直腸熱敏電阻、加熱燈將體溫維持在37 ℃,直至熱穩態恢復。待將缺血或缺血后抽搐大鼠排除后,剔除大鼠,之后隨機補足。維持每組10只。在四支血管阻斷20 min后,預計80%大腦半球h1、旁正中海馬體出現2~3級損傷,40%~50%大腦半球出現第3、5、6層新皮層神經元,或兩者兼有,以及1/3半球小紋狀體神經元。缺血時間持續延長至30 min,中小型紋狀神經元2~3級損傷的半球數量從35%增至93%,損傷行為增加會影響新皮質層、海馬h3~5區。假手術組:手術方式同三七總皂苷組,不做卡環夾閉、電灼永久性閉塞,僅將右側頸總動脈、頸內動脈、頸外動脈暴露,之后逐層縫合。
1.2.2 給藥方式:三七總皂苷組造模后灌胃給予50 mg/kg三七總皂苷,每天2次,每次間隔12 h。假手術組與模型組灌胃給予等量的0.5%羥甲基纖維素鈉。
1.2.3 海馬神經細胞凋亡、新生神經元數量檢測:干預7、14、28 d后評估,評估后將大鼠處死,行海馬神經細胞凋亡、新生神經元數量檢測。
1.2.4 學習記憶能力評估:使用大鼠跳臺實驗法、八臂電迷宮法進行檢測[8-9]。①大鼠跳臺實驗法:將大鼠置于反應箱中適應3 min,之后通電24 V交流電。動物收到電擊,正常反應為跳回平臺、躲避傷害性刺激,多數動物可以再次、多次跳至電柵上,電擊后迅速跳回平臺,訓練5 min,記錄每只大鼠電擊的錯誤次數,24 h后重做測試,即為記憶保持時間。手術第7天開始測試,每天測量時間固定在上午10:00~12:00,將大鼠置于平臺上,通電后記時,記錄5 min內跳下平臺的錯誤次數;②八臂電迷宮法:測試前讓大鼠適應八臂迷宮全景數分鐘,首先讓大鼠頭對著1號臂光源,放置設置為安全區,之后通50 V鋸齒波型交流電,適應3 min,第2部切換安全區至3號臂,同時記憶,記錄大鼠錯誤的選擇次數(四肢進入非安全區臂記錄為一次錯誤),進入安全區后停留1 min,鞏固大鼠記憶。連續測量5 d,每天1次。讓大鼠記憶達到穩態,達標標準為次數低于2次。每天訓練固定于12:00~17:00。具體測試方法:手術第7天開始行連續5 d八臂迷宮測試,前5 d測試適應時間為30 s,鞏固時間為1 min,其余訓練方法保持一致。第5天測試完畢后1 h目標安全區由3臂換至7臂行第2次測試,適應時間為30 s,同一記錄錯誤選擇次數。對比三組第1天、第5天換臂后錯誤選擇次數。
1.2.5 病理組織取材、制備:大鼠水合氯醛麻醉后仰臥固定,保證牽拉肢體無反應,將大鼠胸腔、心臟充分暴露后,在心尖處剪一小口,將灌流針從心尖處刺入左心室,進入升主動脈,使用止血鉗固定,將右心耳剪開,使用200~300 ml0.9%氯化鈉溶液灌注,將組織中血液充分沖洗出來,待腹腔內臟器由血紅色轉為蒼白色,左心房流出無色0.9%氯化鈉溶液時,使用200~300 ml 4%多聚甲醛溶液灌注,將腦組織固定,灌注時可觀察到大鼠肌肉震顫。待大鼠四肢完全變硬后停止灌注,由枕骨大孔處進行斷頭取腦,將腦膜及其周圍結構剝離,將整個腦組織取出,置于4%多聚甲醛中固定4 h,浸入20%蔗糖溶液中3 h,之后在30%蔗糖溶液中在4 ℃冰箱中過夜,待腦組織沉底后取出鼠腦做2 mm冠狀切片,行常規石蠟包埋,制成4 μm石蠟切片。
1.2.6 干預7、14、28 d后測量大鼠腦梗死體積及含水量:三七總皂苷組、對照組中隨機取3只大鼠,待腦功能評估后將大鼠斷頭處死,之后取出腦組織,將低位腦干、小腦、嗅球去除,稱重,在-20 ℃下冷凍10 min,冠狀位1 mm厚度將腦切為6片,避光置于37 ℃及1% 2,3,5-氯化三苯基四氮唑(TTC)中進行染色,腦梗死組織呈現白色,正常為紅色時取出,用4%多聚甲醛進行固定,時間為1 h,之后將腦片根據大腦結構排列,微距離拍攝,使用Image-Pro Plus 5.0圖像分析軟件對腦片的梗死面積進行測量,梗死體積為每片腦片正反面梗死面積均數乘以腦片厚度,各腦片梗死體積和為大鼠的腦梗死體積。腦水腫程度為腦片置于110 ℃烘箱烘干后/之前大腦重量。
1.2.7 缺血損傷后誘導的新生神經元數量檢測:余下腦組織標本進行免疫熒光染色(DCX/NeuN):腦片破膜30 min,羊血清封閉2 h后,分別加入兔抗DCX/NeuN(1∶200),4 ℃冰箱過夜;第2天加熒光二抗(1∶2200),室溫孵育2 h;含DAPI封片劑封片;正置熒光顯微鏡觀察拍照:每只動物選取3張切片,每張切片選取相同部位皮質梗死半暗帶,在100倍鏡下拍照,選取DCX/NeuN染色陽性的細胞,計算每個視野下陽性細胞數量。以上實驗均重復3次。
1.3 統計學方法 采用SPSS 17.0統計學軟件進行分析。計量資料用(x±s)表示,組間比較采用單因素方差分析,組間兩兩對比使用SNK檢驗法;P<0.05為差異有統計學意義。
2 結 果
2.1 三組大鼠干預7、14、28 d后海馬神經細胞凋亡、新生神經元數量比較 模型組干預7、14、28 d后的海馬神經細胞凋亡明顯較三七總皂苷組、假手術組高(均P<0.05);三七總皂苷組干預7、14、28 d后的海馬神經細胞凋亡明顯較假手術組高(均P<0.05);三七總皂苷組干預7、14、28 d后的海馬新生神經元明顯較模型組、假手術組高(均P<0.05);干預7、14、28 d后的模型組新生神經元明顯較假手術組高(均P<0.05);三七總皂苷組中,隨著干預時間延長,海馬神經細胞凋亡明顯降低,新生神經元明顯升高(均P<0.05)。見表1。
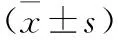
表1 三組大鼠干預7、14、28 d后海馬神經細胞凋亡、新生神經元數量比較
2.2 三組大鼠學習記憶能力比較 模型組大鼠的潛伏期、錯誤次數、第1天記憶錯誤次數、第1天學習錯誤次數、第5天記憶錯誤次數、第5天學習錯誤次數明顯較三七總皂苷組、假手術組高,三七總皂苷組大鼠的潛伏期、錯誤次數、第1天記憶錯誤次數、第1天學習錯誤次數、第5天記憶錯誤次數、第5天學習錯誤次數明顯較假手術組高(均P<0.05)。三七總皂苷組中,隨著干預時間延長,第1天記憶錯誤次數、第1天學習錯誤次數、第5天記憶錯誤次數、第5天學習錯誤次數明顯降低(均P<0.05)。見表2。
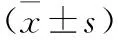
表2 三組大鼠學習記憶能力比較
2.3 三組大鼠干預7、14、28 d后測量大鼠腦梗死體積及含水量比較 模型組的腦梗死體積、含水量明顯較三七總皂苷組、假手術組高(均P<0.05)。三七總皂苷組的腦梗死體積、含水量明顯較假手術組高(均P<0.05)。三七總皂苷組中,隨著干預時間延長,腦梗死體積、含水量明顯降低(均P<0.05)。見表3。
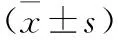
表3 三組大鼠干預7、14、28 d后時測量大鼠腦梗死體積及含水量比較
2.4 三組大鼠DCX/NeuN染色陽性細胞數量比較 三七總皂苷組的DCX/NeuN染色陽性細胞數量[(2.78±0.56)個/mm2]明顯較模型組[(1.31±0.41)個/mm2]、假手術組[(0.52±0.09)個/mm2]高(均P<0.05),模型組明顯較假手術組高(P<0.05)。
3 討 論
海馬是學習、記憶的一個重要中樞,對于缺血等損傷非常敏感,若海馬結構出現缺血等不可逆損傷,大鼠會出現癡呆癥狀[10]。目前海馬是公認的神經再生活性區域,一般只有齒狀回顆粒細胞可以持續發生,占海馬神經細胞總數的92%~95%錐體細胞在正常成年腦中不能被置換,而缺血性損傷會刺激其再生[11]。目前四血管閉塞法模型是常用的研究遲發性神經再生機制采用的一個模型[12]。短暫性前腦缺血會特異性誘發海馬CA1區錐體細胞出現變形,大鼠前腦短暫性缺血的模型中短暫性腦缺血會使得該區CA1區錐體細胞出現遲發死亡,腦缺血再灌2~3 d后光鏡下可見CA1區錐體細胞出現死亡[13],之后會引起內源性神經干細胞增殖、分化為功能性的錐體細胞。因此通過研究CA1區錐體細胞遲發性死亡發生后促進海馬區功能神經再生有效途徑,為改善中風患者恢復期、血管性癡呆、中風后遺癥是腦缺血領域繼續解決的一個重要問題。
缺血性腦血管病大鼠試驗模型制備方法較多,四血管閉塞法是不可再通模型,造模動物存在缺血側尾殼核、背外側皮層梗塞。本研究主要研究中藥對海馬CA1區的影響機制,因此本研究選擇了大鼠前腦短暫性缺血模型,四血管閉塞法模型操作簡單、缺血過程容易掌握,可在大鼠清醒狀態下行缺血再灌注,符合該疾病的臨床發病特征,可以保證較高的成模率,此外也可根據試驗夾閉雙側頸總動脈時間長短對腦缺血程度進行控制,之后再行灌注,因此也是研究腦缺血再關注損傷常用的模型之一,因此本研究選擇了四血管閉塞法制作大鼠短暫性前腦缺血模型[14]。
本研究結果表明,模型組干預7、14、28 d后的海馬神經細胞凋亡明顯較三七總皂苷組、假手術組高;三七總皂苷組干預7、14、28 d后的海馬神經細胞凋亡明顯較假手術組高;三七總皂苷組干預7、14、28 d后的海馬新生神經元明顯較模型組、假手術組高;干預7、14、28 d后的模型組新生神經元明顯較假手術組高;三七總皂苷組中,隨著干預時間延長,海馬神經細胞凋亡明顯降低,新生神經元明顯升高,表明加用三七總皂苷后,短暫性前腦缺血大鼠的海馬神經細胞凋亡明顯改善,新生神經元明顯升高,隨著干預時間的延長,干預效果越好。可能是由于三七總皂苷包括人參皂苷Rg1、人參皂苷Rb1、三七皂苷R1,其對缺血性腦損傷保護作用可能與抗自由基作用、鈣通道阻斷作用有關,三七總皂苷具有降低血液黏稠度、抑制血小板聚集,改善血液高凝狀態及腦梗死區血液供應的情況,防治腦缺血-再灌注期間局部腦血流量降低,抑制再灌注蛋白激酶C激活及鈣超載、減少自由基的釋放,從而起到降低細胞凋亡,促進新生神經元增加的作用。
模型組大鼠的潛伏期、錯誤次數、第1天記憶錯誤次數、第1天學習錯誤次數、第5天記憶錯誤次數、第5天學習錯誤次數明顯較三七總皂苷組、假手術組高,三七總皂苷組大鼠的潛伏期、錯誤次數、第1天記憶錯誤次數、第1天學習錯誤次數、第5天記憶錯誤次數、第5天學習錯誤次數明顯較假手術組高。三七總皂苷組中,隨著干預時間延長,第1天記憶錯誤次數、第1天學習錯誤次數、第5天記憶錯誤次數、第5天學習錯誤次數明顯降低,表明隨著三七總皂苷干預時間的延長,短暫性前腦缺血大鼠的學習記憶能力得到了明顯改善,可能是由于三七總皂苷可能是通過抑制大鼠大腦中乙酰膽堿酯酶活性,減輕大鼠的腦部炎癥,產生較強的抗氧化性,使得大腦細胞免受氧化物損傷,從而保護中樞神經,起到增強其記憶學習能力的作用[15-17]。
TTC是一種脂溶性的光敏感化合物,可與組織中的脫氫酶反應,呈現紅色,腦梗死后腦卒中脫氫酶活性降低,不能與TTC反應呈蒼白色,因此TTC可用于測量梗死范圍,評價腦梗死損害程度[18-19]。模型組的腦梗死體積、含水量明顯較三七總皂苷組、假手術組高。三七總皂苷組的腦梗死體積、含水量明顯較假手術組高。三七總皂苷組中,隨著干預時間延長,腦梗死體積、含水量明顯降低,表明隨著三七總皂苷干預,大鼠的腦梗死、腦水腫情況均改善明顯。
DCX陽性細胞呈卵圓形、球形,多存在于造模術后大鼠的SVZ區,呈鏈狀向梗死灶的周圍遷移,NeuN陽性細胞多呈卵圓形或梭形,存在于造模大鼠的紋狀體區,通過監測DCX/NeuN染色陽性細胞數量可以預測短暫性前腦缺血大鼠海馬區的新生神經細胞。三七總皂苷組的DCX/NeuN染色陽性細胞數量明顯較模型組[(1.31±0.41)個/mm2]、假手術組高,模型組明顯較假手術組高,表明加用三七總皂苷后提高了三七總皂苷大鼠的新生神經細胞,促進了海馬區神經元的修復。綜上所述,三七總皂苷可促進短暫性前腦缺血大鼠海馬區神經元的修復。

