動脈灌注分數聯合轉化生長因子-β及上皮細胞鈣黏蛋白檢測對原發性卵巢癌的診斷價值研究
王 靜,張虹宇,張 磊,趙仰光,王 健
(1.天津市腫瘤醫院,天津 300060;2.秦皇島市第四醫院婦瘤科,河北 秦皇島 066000;3.秦皇島市第四醫院介入科,河北 秦皇島 066000;4.河北醫科大學第三醫院婦產科,河北 秦皇島 050000)
卵巢癌癥(Ovarian cancer,OC)是女性最致命的惡性腫瘤之一。盡管1976年至2022年間病死率下降了33%,發病率也有所下降,但五年生存率仍低至47%。卵巢癌的常用血清標志物是CA-125,但一些研究表明其敏感性較低,對卵巢癌的診斷有一定限制[1]。轉化生長因子-β(Tubuloglomerular feedback β,TGF-β)和上皮細胞鈣黏蛋白(E-cadherin antibody,E-cadherin)是一種多功能細胞因子,位于染色體19q13上,由七個外顯子組成,主要由星狀細胞產生[2]。它在體內發揮多種生理作用,可以調節細胞遷移、增殖和外部機制的形成,還可以促進傷口愈合和疤痕減少[3]。TGF-β和E-cadherin對機體的細胞免疫功能有很強的抑制作用。在腫瘤細胞的發生和發展中,它可以通過抑制免疫細胞來促進腫瘤細胞的生長,并具有促瘤作用[4]。一些研究表明,血清TGF-β和E-cadherin在非小細胞肺癌癌癥患者中具有較高水平,并且隨著化療后其水平的降低,TGF-β是一種有價值的腫瘤生物標志物[5]。
磁共振成像(MRI)、多普勒超聲、數字減影血管造影和計算機斷層掃描(CT)通常用于診斷卵巢癌[6]。MRI昂貴且耗時,對患者來說可能是巨大的經濟負擔[7]。多普勒超聲對操作者有很高的技術要求,由于組織重疊,檢測往往有很多盲點,因此在疾病檢測中存在一些局限性[8]。目前,CT灌注成像技術發展良好,最新的CT灌注成像為臨床檢測提供了更準確、清晰、穩定的成像基礎。它可以詳細檢測癌癥的特征、定位和分期,并顯示腫瘤的位置和大小,而且易于操作和推廣[9]。CT灌注成像反映了單位時間內每個體素或像素的造影劑濃度的變化,促進了疾病的快速診斷。其數學模型可以以簡單和直接的方式檢測組織和器官,并可以提供非常有價值的診斷信息[10]。
目前,對卵巢癌早期診斷的研究很少。因此,本研究分析了HAF與TGF-β和E-cadherin在卵巢癌中的診斷和鑒別價值,以找到一種準確、方便的卵巢癌診斷方法,為臨床實踐提供參考。
1 資料與方法
1.1 一般資料 以秦皇島市第四醫院128例卵巢癌根治術患者的臨床資料為研究組,平均年齡(50.59±12.80)歲。本組患者均在秦皇島市第四醫院經手術或穿刺活檢病理證實為卵巢癌。同時,收集74例健康志愿者作為對照組,平均年齡(51.73±12.58)歲。所有患者都簽署了知情同意書。該研究獲得了秦皇島市第四醫院倫理委員會的批準。研究組與對照組在年齡、體重指數(BMI)、心率、腎功能、血清肌酐、吸煙、空腹血糖、血紅蛋白(HB)、紅細胞(RBC)、血小板(PLT)等比較方面無統計學差異(均P>0.05),具有可比性,見表1。病例納入標準:年齡20~70歲;具有完整臨床記錄或醫學檢查數據的患者;入院前未接受放療、化療或射頻消融術的患者。排除標準:因復發入院的患者;患有嚴重心臟、腦血管和其他疾病的患者;糖尿病、腎功能不全、甲亢患者;有器官移植史的患者。

表1 兩組患者一般資料比較
1.2 研究方法
1.2.1 主要試劑和儀器:螺旋CT機(64層)(GE Healthcare,芝加哥,伊利諾伊州,美國,型號:光速VCT);TGF-β和E-cadherinELISA試劑盒(中國有限公司金一白生物科技有限公司,目錄號JEB-10723);自動定量微量板讀取器(奧地利薩爾茨堡Anthos Labtec Instruments GmbH,型號:anthons2020);紫外可見分光光度計(中國有限公司潤基儀器技術有限公司,型號:UV1700)。
1.2.2 血清采集:禁食超過8 h后,早上從所有參與者中抽取6 ml肘外靜脈血,置于真空容器中并儲存在冰箱中。取出樣品并在室溫下放置約30 min,然后在4 ℃下以3000 g離心15~20 min以分離血清。離心后,仔細使用轉移器(美國馬薩諸塞州沃爾瑟姆的賽默飛世爾科學公司)吸收350 μl上清液。將其放置在四個EP管中,冷凍在液氮中,并在-80 ℃下儲存,以便進一步檢測。所有上述操作均在無菌環境中進行。
1.2.3 TGF-β和E-cadherin的檢測方法:采用雙抗體夾心酶聯免疫吸附試驗(ELISA)檢測研究組和對照組血清TGF-β和E-cadherin的表達。
將待測樣品和試劑盒從冰箱中取出,并在30 ℃的室溫下重新溶化。取出酶標記板;將50 μl標準樣品倒入標準樣品孔中;向樣品中加入10 μl待測樣品和40 μl樣品稀釋劑;并向除空白孔外的每個孔中加入100 μl顯色抗體。37 ℃水浴60 min后,取下酶標記板,向每個孔中加入50 μl洗滌液。靜置1 min后,將孔中的液體干燥,并將板洗滌5次。將酶(50 μl)標記溶液添加到每個孔中(空白對照孔除外)。在37 ℃的振動水槽(美國加利福尼亞州Hercules的Bio-Read Laboratories,Inc.)中水浴15 min后,添加顯色劑,在黑暗中觀察15 min。取下酶標簽板,用終止溶液停止反應。終止后10 min,在450 nm波長下測量每個孔的吸光度。根據標準樣品濃度對應的吸光度值計算其與樣品吸光度的比值,當比值大于99%時,產品合格。通過自動微量板讀數器計算線性回歸方程,并根據測量的吸光度計算樣品濃度。
1.2.4 CT掃描方法:所有受試者在檢查前均需禁食8 h,并在CT掃描前20 min給予1000 ml溫水,以填充胃、小腸和十二指腸。在進入CT室之前,初級護士詳細解釋了檢查過程和注意事項,以獲得患者的充分合作,消除他們的不安,訓練他們根據儀器的語音提示吸氣、呼氣和屏息,以實現順利掃描。受試者采取仰臥姿勢并舉起雙手以減少掃描偽影。掃描范圍從橫膈膜水平到腎下極。研究組患者的明顯實體增強區域進行了掃描,管電壓為120 kV,自動毫秒管電流,旋轉速度為0.7 s/r,節距為0.884,截面厚度和交叉間隙為5 mm,探測器準直度為64×0.625,以進行掃描。

2 結 果
2.1 研究組血清TGF-β和E-cadherin相對表達與臨床病理比較 見表2。ELISA檢測結果顯示,研究組血清TGF-β和E-cadherin的表達水平與總膽紅素、腹水、TNM分期、凝血酶原時間、腫瘤直徑、淋巴結轉移和遠處轉移相關,比較差異具有統計學意義(均P<0.05)。
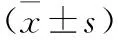
表2 研究組血清TGF-β和E-cadherin相對表達與臨床病理比較
2.2 研究組與對照組CT灌注參數的比較 結果表明,研究組血流量(BF)[(212.55±42.24)ml/(min·100 g)]高于對照組[(128.25±23.59)ml/(min·100g)],差異有統計學意義(t=15.620,P<0.02);研究組血容量(BV)[(41.73±10.2 )ml/100 g]高于對照組[(28.76±7.53)ml/100 g],差異有統計學意義(t=9.514,P<0.02);研究組[(9.53±3.29)s]與對照組[(10.73±5.72)s]平均通過時間(MTT)比較無統計學差異(t=1.833,P=0.055);研究組滲透參數(PS) [(27.52±9.23)ml/(min·100 g)]高于對照組[(19.55±7.25)ml/(min·100 g)],差異有統計學意義(t=6.202,P<0.02);研究組HAF(0.63±0.15)高于對照組(0.54±0.09),具有統計學差異(t=30.67,P<0.02)。見圖1。

注:與對照組比較*P<0.05圖1 研究組和對照組灌注參數比較
2.3 HAF參數和TGF-β、E-cadherin表達對卵巢癌的診斷價值 將研究組和對照組的HAF參數和TGF-β、E-cadherin表達繪制為卵巢癌診斷的ROC曲線。結果表明,卵巢癌中TGF-β和E-cadherin表達的AUC值為0.7699(95%CI:0.7221~0.8178);特異性74%;靈敏度為93%,最佳截止點為191.20 ng/L。卵巢癌中HAF參數的AUC值為0.7858(95%CI:0.7364~0.8352);特異性74%;靈敏度為100%,最佳截止點為0.5150。采用Logistic回歸分析兩組TGF-β和E-cadherin和HAF參數的表達水平,并將回歸數據與HAF參數和TGF-β、E-cadherin表達進一步結合,繪制ROC曲線,用于卵巢癌診斷。結果表明,HAF參數與TGF-β和E-cadherin表達在卵巢癌中的AUC值為0.8277(95%CI:0.7892~0.8662);特異性為84%;靈敏度為100%,最佳截止點為0.2098。見圖2。

圖2 HAF參數和TGF-β、E-cadherin表達對卵巢癌的診斷價值
3 討 論
卵巢是一個重要的免疫特權器官,在機體的免疫調節中發揮著重要作用。原發性卵巢癌是一種非常常見的卵巢惡性腫瘤,病死率很高,僅次于肺癌。由于診斷晚和治療方案不足,對患者的健康和生活質量造成威脅,病死率逐漸上升[11]。卵巢癌早期無明顯癥狀,這在很大程度上增加了臨床早期準確診斷卵巢癌的難度。絕大多數患者在出現腹痛、黃疸、腹水、僵硬、嗜睡等癥狀時,都患有晚期癌癥,失去了進行徹底治療的機會,例如根治性切除癌癥[12]。卵巢癌的發生與許多因素有關,如飲食,遺傳。不可能在短時間內建立針對卵巢癌的有效預防措施[13],但早期發現和治療往往可以改善患者的治療效果、預后和生存時間。因此,許多學者正在努力尋找一種更準確、更靈敏的診斷方法來治療卵巢癌。
TGF-β是一種多功能細胞生長因子,分子量約為12.5 kDa,其生物學功能主要在炎癥、胚胎發育和組織修復中。已經發現TGF-β和E-cadherin在調節細胞分化、增殖、凋亡和免疫功能中起著重要作用。此外,它可以抑制免疫細胞并刺激細胞外基質的增殖[14]。在多種惡性腫瘤中,TGF-β和E-cadherin的表達不同程度地增加,表明TGF-β和E-cadherin在腫瘤的發生和發展中具有重要意義[15]。一些研究表明,HPV病毒攜帶者中TGF-β和E-cadherin的表達高于健康人[16]。TGF-β和E-cadherin的表達水平與卵巢癌的侵襲和轉移密切相關,可以改變腫瘤的微環境,增加腫瘤侵襲和轉移的可能性,也是卵巢癌的獨立預后因素[17]。
基于CT平掃的CT灌注掃描可以完整直觀地顯示病變,并通過使用不同的數學模型計算各種CT灌注參數,這可以有效地反映局部組織灌注體積的變化。BV是指組織血管結構中的血液體積,其灌注參數受血管大小和毛細血管開口數量的影響。腫瘤中大量不成熟的新生血管形成和通過異常血管的血流增加可導致BV值增加。BF是每單位時間流經卵巢組織的血液量。由于腫瘤的隨機生長,每單位時間流經卵巢組織的血液體積增加,導致BF值增加。HAF是指每單位時間流經動脈的血液體積的平均分數。由于卵巢癌癌癥細胞主要由動脈供血,并含有豐富的毛細血管,卵巢癌中動脈血成分的增加可以打破血液供應比例,導致HAF升高。PS是造影劑從毛細血管到細胞間空間的單向傳輸流速。由于卵巢中大量腫瘤組織中異常微血管壁中的內皮細胞不完整,造影劑容易進出血管和組織空間,從而導致PS值增加。由于動脈是卵巢癌癌癥細胞的主要供血來源,而HAF能清楚地反映動脈的血流,因此HAF參數被用作卵巢癌的診斷標準。
田璐[18]認為TGF-β和E-cadherin的過度表達可能導致癌癥的發生,這與我們的結果類似。本研究比較了卵巢癌患者和正常對照組血清中TGF-β和E-cadherin的表達,進一步研究卵巢癌患者的臨床病理特征和TGF-β、E-cadherin的表達發現,血清TGF-β、E-cadherin表達水平與總膽紅素、腹水、TNM分期、凝血酶原時間、腫瘤直徑、淋巴結轉移和遠處轉移有關(均P<0.05),這與閻紅琳等[19]的結果相似。他們研究了TGF-β和E-cadherin表達與卵巢癌之間的關系,發現TGF-β和E-cadherin的表達與卵巢癌的轉移、組織學分級和穿透深度密切相關。卵巢癌患者的BF、BV、PS、HAF灌注參數高于正常對照組(均P<0.05),結果與馬永剛等[20]的結果相似。在我們的研究中,通過繪制HAF參數和TGF-β、E-cadherin表達水平在卵巢癌診斷中的ROC曲線,發現TGF-β和E-cadherin的表達水平在診斷卵巢癌中的特異性和敏感性分別為74%和93%;HAF參數診斷卵巢癌的特異性和敏感性分別為74%和100%;HAF參數結合TGF-β和E-cadherin表達水平的特異性和敏感性分別為84%和100%。HAF參數、TGF-β和E-cadherin表達與卵巢癌患者其他臨床癥狀之間的相關性尚未深入研究,因此可能存在一些局限性,后續還有待進一步深入研究,并且對患者進行定期隨訪。
TGF-β和E-cadherin在卵巢癌患者血清中高度表達;卵巢癌患者BF、BV、PS、HAF灌注參數高于正常對照組;TGF-β和E-cadherin的表達水平與總膽紅素、腹水、TNM分期、凝血酶原時間、腫瘤直徑、淋巴結轉移和遠處轉移有關;HAF參數結合TGF-β和E-cadherin表達水平可提高特異性和敏感性,對卵巢癌的診斷具有重要價值。

