玉米秸稈溶解性有機質分級組分的分子光譜
周向軍,趙燕娥
(1.天水師范學院生物工程與技術學院,甘肅 天水 741001;2.甘肅省農業固體廢棄物資源化利用重點實驗室,甘肅 天水 741001)
農作物秸稈廢棄物是一種數量極大的可再生生物質資源,富含碳水化合物、纖維素和半纖維素類等有機物。秸稈還田后不僅可以改善土壤孔隙結構,提高土壤有機質含量和微生物活性等,而且其釋放的溶解性有機質(DOM)還會對土壤有機質的結構組成等產生影響[1]。DOM 是指具有多種官能團且能通過0.45 μm濾膜的一類非均質水溶性有機化合物[2]。DOM 作為秸稈的重要有機組分之一,不僅可為土壤微生物提供碳源和能量來源,而且還可作為各種環境污染物的重要載體,對其遷移轉化和最終歸趨等環境行為產生重要影響。Chen 等[3]對不同腐解階段水稻秸稈的DOM 進行表征,結果表明,DOM 的結構和官能團具有高度異質性,芳香性基團為DOM 中最為穩定的部分。余旭芳等[4]對小麥秸稈堆肥過程中DOM 的結構和組成進行研究,結果表明,堆肥前期DOM 降解較為迅速,類蛋白發生顯著降解,類腐殖質逐漸成為DOM 的主要組分。韋夢雪等[5]對川西平原水稻/油菜秸稈DOM 的光譜特征進行研究,結果表明,腐解過程中DOM 組分的光譜學特性差異明顯,其中,芳香性組分主要是在腐解的前10 d 內釋放,難降解性組分則是在腐解后期被釋放。曹瑩菲等[6]對玉米/大豆秸稈腐解過程的結構變化進行表征,結果表明,隨著腐解時間的延長,糖類、酰胺類和脂肪族類等易分解化合物首先被直接分解,而芳香類等難降解化合物則是先形成羧酸酯類或脂肪族類后再逐漸被分解,但整體上秸稈還田后將傾向于轉化為類胡敏酸物質。李艷等[7]通過三維熒光光譜和平行因子分析法,研究了秸稈和牛糞發酵過程中DOM 的熒光光譜特征,結果顯示,牛糞與秸稈體積比為6∶4 時,堆肥過程中腐殖化效率最高。張海洋等[8]對水環境中水稻和小麥秸稈DOM 的組成和光化學特性進行研究,結果表明,秸稈DOM 釋放過程可分為物理淋溶、易分解組分降解和難分解組分降解3 個階段,并指出了今后秸稈源DOM 在生態環境領域的重點研究方向。
雖然已有學者對秸稈源DOM 進行了相關研究,但大多局限于DOM 混合組分的化學組成和結構特性等,缺少DOM 分級組分的光譜學特性和熒光組分解析等研究。而闡明DOM 分級組分的光譜學特性和熒光組分等,對深入了解秸稈DOM 在農田土壤系統中的腐解過程等具有重要意義。玉米秸稈DOM 組分的結構復雜多樣,在不同腐解階段釋放的疏水酸性組分(HOA)、疏水堿性組分(HOB)、親水性組分(HIM)、酸不溶組分(AIM)和疏水中性組分(HON)的光譜學特性及熒光組分尚不明確。近年來發展的DAX-8樹脂法及光譜學技術為分離與解析DOM 組分的化學結構提供了一種可能,也有助于評估DOM 組分對抗生素的吸附行為等[9]。DAX-8 樹脂具有選擇性強、效率高等優點[10],是DOM 分級分離的有效手段之一。光譜分析可以獲得DOM 的分子結構特性,與傳統的化學分析以及色譜、質譜和核磁共振等分析手段相比,具有簡便快捷、靈敏度高、選擇性強、不破壞樣品等優點,可迅速實現DOM 組分的定性表征和定量分析[11]。其中,紫外光譜用于分析和揭示DOM 中不飽和化合物的結構組成和性質[12];三維熒光光譜可通過普通尋峰法獲得DOM 的熒光組分等[13];同步熒光光譜雖然容易受到拉曼散射的影響,但是能獲得較清晰、獨特的波譜信息和結構信息[14]。本研究利用DAX-8 樹脂分級分離得到玉米秸稈不同腐解階段的5 種DOM 組分,并采用紫外光譜、三維熒光光譜和同步熒光光譜進行光譜分析及熒光組分解析,以期為秸稈還田后用于降低抗生素類新興污染物的遷移等提供理論基礎。
1 材料與方法
1.1 試驗材料
1.1.1 玉米秸稈 玉米秸稈取自天水市郊區農田。將秸稈在陰涼處風干,粉碎后過20 目篩,粒徑約1 mm,備用。
1.1.2 試劑 甲醇、HCl、NaOH 等試劑,均為國產分析純;Supelite DAX-8 樹脂,購自Sigma 公司。
1.1.3 儀器 主要儀器有UV-2600 紫外分光光度計〔島津(中國)有限公司〕、F-7000 熒光分光光度計〔日立(中國)有限公司〕、Centrifuge 5810R 離心機(德國艾本德公司)和YZ1515x 蠕動泵(蘭格恒流泵有限公司)。
1.2 試驗方法
1.2.1 腐解菌液的制備 2021 年7 月28 日在天水市秦州區農田,采用五點取樣法采集黃綿土,棄去雜物后過20 目篩,密封后低溫保存,備用。
稱取15.00 g 新鮮土壤3 份置于錐形瓶中,加入蒸餾水100 mL,在25 ℃下振蕩5 h。取上清液4 000 r/min離心10 min,上清液即為腐解菌液。
1.2.2 玉米秸稈的腐解 稱取玉米秸稈粉5.00 g 置于錐形瓶中,加入石英砂30 g、蒸餾水50 mL 和腐解菌液8 mL,用保鮮膜封口,頂部用針扎孔。在25 ℃下120 r/min 恒溫避光振蕩。分別在第0、5、10、15、25、35 和50 天取樣,取樣量均為15 mL,取樣后及時補充相應體積的蒸餾水。在15 mL 樣液中加入蒸餾水15 mL,混勻后用8 層紗布過濾,然后8 000 r/min 離心10 min,上清液經0.45 μm 濾膜過濾后即為DOM[15]。
1.2.3 DOM 組分的提取
1.2.3.1 DAX-8 樹脂預處理。將DAX-8 樹脂用0.1 mol/L NaOH 浸泡24 h,期間換液5 次,用蒸餾水清洗3 次,每次30 min。加入少量甲醇,65 ℃索氏抽提24 h,用蒸餾水清洗10 次。依次用8 倍柱體積的0.1 mol/L NaOH 淋洗柱子、100 mL 蒸餾水過柱、3 倍柱體積的0.1 mol/L HCl 洗柱、200 mL 蒸餾水淋洗過柱,重復3 次[16]。DAX-8 樹脂使用3 次后需進行再生處理。
1.2.3.2 DOM 分級分離。利用恒流泵和層析柱,將DOM 樣品在1 mL/min 下上樣,用40 mL 蒸餾水淋洗。用10 mL 0.01 mol/L HCl 和30 mL 0.01 mol/L HCl 反洗,收集液為HOB。將非吸附成分調至pH 值2.0,4 000 r/min 離心10 min,將沉淀物用0.1 mol/L NaOH 溶解,即為AIM;將上清液過柱后利用20 mL 0.01 mol/L HCl 淋洗,收集液為HIM;用10 mL 0.1 mol/L NaOH 和30 mL 蒸餾水反洗,收集反洗液為HOA。將DAX-8 樹脂用甲醇浸泡過夜,即為HON。每個階段過柱后,均依次用40 mL 0.1 mol/L NaOH、超純水、0.01 mol/L HCl、超純水淋洗層析柱[17]。
1.2.4 DOM 組分的解析
1.2.4.1 紫外光譜。利用紫外分光光度計進行測定。當波長<250 nm 時,DOM 組分易受硝酸鹽、亞硝酸鹽和溴化物等無機離子的干擾,同時還受大量生色團重疊吸收現象的影響[18],其紫外光譜不易識別。本研究以超純水為空白進行調零,同時在250~600 nm 波長范圍內測定5 種DOM 組分的紫外光譜,波長間隔為0.5 nm。
1.2.4.2 同步熒光光譜。利用熒光分光光度計進行測定。設定條件:光源為150 W 氙燈,PMT 電壓700 V,固定波長差(Δλ)為60 nm,掃描速度1 200 nm/min。以超純水為空白進行調零,同時在250~500 nm 波長范圍內掃描5 種DOM 組分的同光熒光光譜。
1.2.4.3 三維熒光光譜。利用熒光分光光度計進行測定。設定條件:Ex 為220~400 nm,Em 為250~550 nm,波長步長10 nm,狹縫5 nm,掃描速度1 200 nm/min,光電倍增管電壓700 V。樣品稀釋以避免高濃度DOM組分內濾效應的干擾,同時以超純水做空白調零并去除拉曼散射[19]。
2 結果與分析
2.1 DOM 的紫外光譜及特性指標
2.1.1 DOM 的紫外光譜 基于DOM 的疏水性和電荷特性,利用DAX-8 樹脂將不同腐解階段玉米秸稈的DOM 進行分級分離,得到HOA、HOB、HIM、AIM和HON 計5 種組分。從不同腐解階段5 種DOM 分級組分的紫外光譜(圖1~7)可以看出,除腐解第0 天的HOA 組分出現雙峰外,其余階段5 種DOM 組分的紫外吸收值幾乎均隨波長的增加而降低,表明HOA組分中具有較為豐富的共軛化合物;5 種DOM 組分在500~600 nm 顯著降低并進入平臺期,表明多芳環類物質含量相對較低;不同腐解階段同一DOM 組分的吸收光譜形狀較為相似,表明相同DOM 組分主要化學官能團較為接近。腐解第0 天時,HOA 組分在300~307 nm 和323~335 nm 存在吸收峰,歸屬為含不飽和基團較多的類胡敏酸物質[19];腐解第5 天時,HOA 組分僅在278~290 nm 出現新吸收峰,歸屬為木質素及其衍生物的特征性吸收[20];隨后,該峰逐漸減弱甚至趨于消失,表明木質素及其衍生物被不斷分解并生成了難降解性的芳香類化合物。HOA 組分的吸收值均高于其它4 種組分,表明DOM 組分中大分子芳香類化合物主要來自HOA。腐解的50 d 內,HON 組分的最大吸收峰基本位于273~283 nm,但峰形存在一定程度的變化,其中腐解第0~5 天時吸收峰較窄、腐解第10~50 天時吸收峰較寬,表明腐解中后期HON 組分進一步被衍生而復雜化。腐解第0 天時,HIM 和HOB組分在262~273 nm 有較弱的吸收峰,歸屬為含C=C和芳環類化合物;但隨后,該吸收峰幾乎完全消失,表明2 種組分被進一步降解或轉化。腐解第0~5 天時,AIM 組分無明顯的吸收峰;但隨后,在275~285 nm 出現極弱的吸收峰。

圖1 腐解第0 天時不同DOM 組分的紫外光譜Fig.1 UV spectra of different DOM fractions after 0 day of decomposition

圖2 腐解第5 天時不同DOM 組分的紫外光譜Fig.2 UV spectra of different DOM fractions after 5 days of decomposition
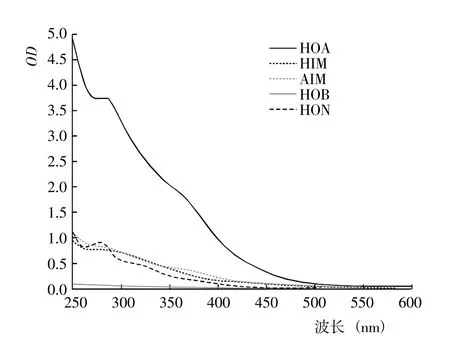
圖3 腐解第10 天時不同DOM 組分的紫外光譜Fig.3 UV spectra of of different DOM fractions after 10 days of decomposition

圖4 腐解第15 天時不同DOM 組分的紫外光譜Fig.4 UV spectra of different DOM fractions after 15 days of decomposition
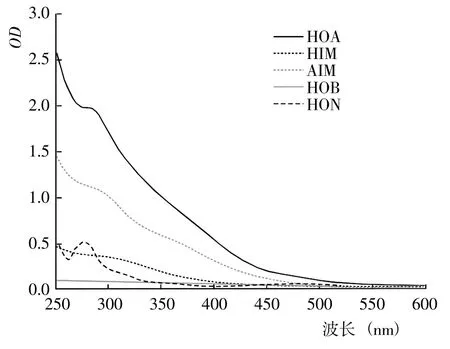
圖5 腐解第25 天時不同DOM 組分的紫外光譜Fig.5 UV spectra of different DOM fractions after 25 days of decomposition
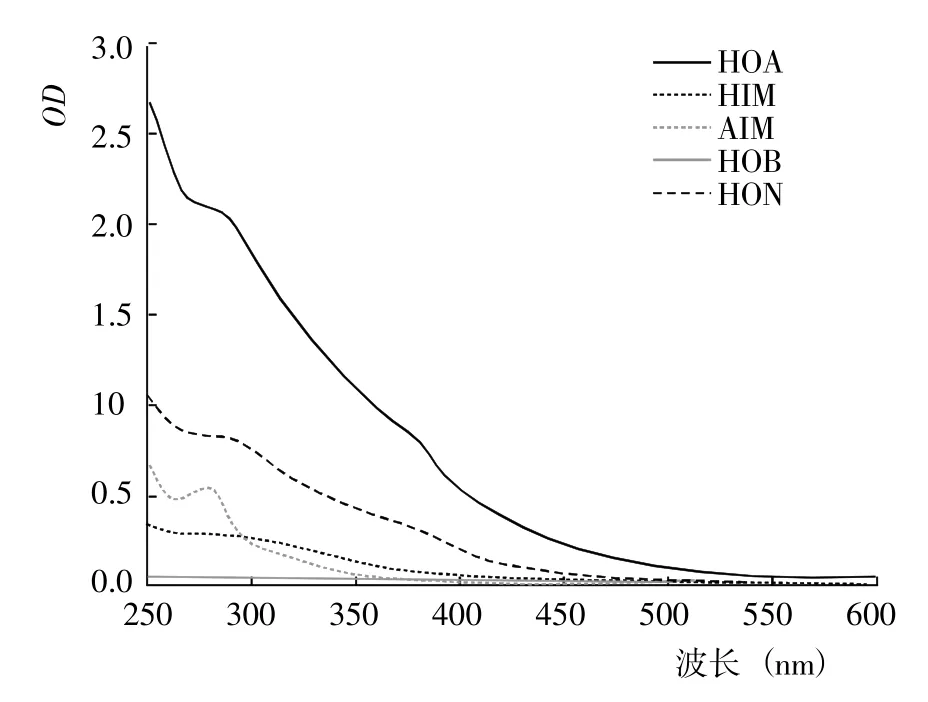
圖6 腐解第35 天時不同DOM 組分的紫外光譜Fig.6 UV spectra of different DOM fractions after 35 days of decomposition
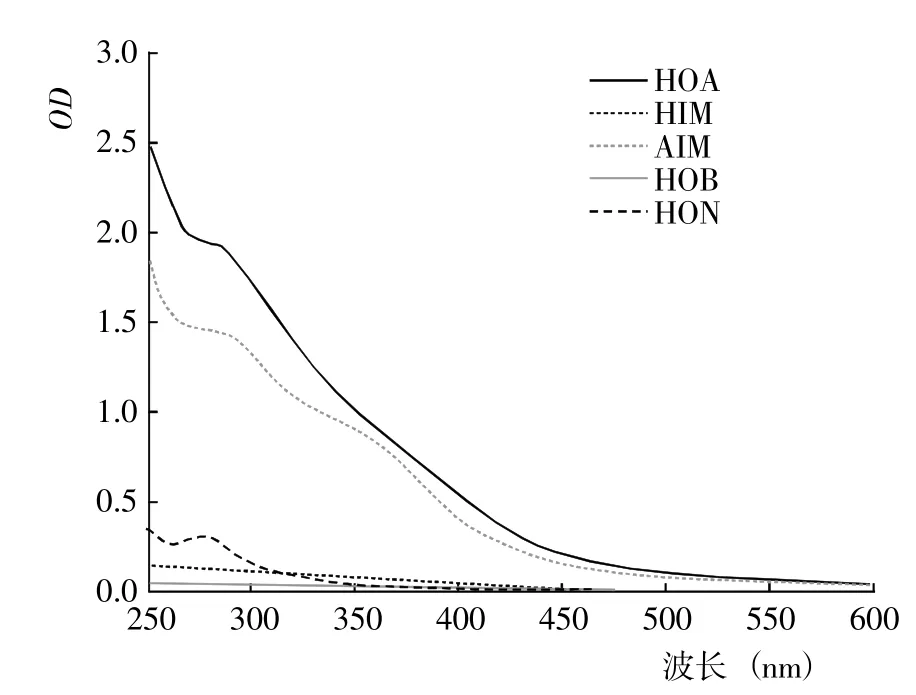
圖7 腐解第50 天時不同DOM 組分的紫外光譜Fig.7 UV spectra of different DOM fractions after 50 days of decomposition
2.1.2 DOM 的光譜特性指標E1(E250/E203) 反映了DOM 取代基的狀況,與DOM 芳環中-C=O、-COOH、-OH 和-COOR 等的取代數量呈正相關[21],與脂肪鏈的取代數量呈負相關;E2(E250/E365)與芳香性程度呈負相關[22];E3(E240/E420) 與團聚化程度呈負相關[23];E4(E300/E400)與腐殖化程度呈負相關[24]。
隨著腐解時間的延長,5 種DOM 組分的光譜特性指標值變化規律不盡相同(表1)。對E1而言,HOA組分的E1呈先增加后降低并趨于穩定的變化趨勢,且均高于腐解第0 天時的指標值;HON 組分的E1呈逐漸降低趨勢,且均低于腐解第0 天時的指標值;AIM組分的E1呈先增加后趨于穩定的趨勢變化,且均高于腐解第0 天時的指標值;HOB 和HIM 組分的E1呈波動變化趨勢。對E2而言,HOA 組分的E2呈先增加后趨于穩定的趨勢變化;HOB 和HON 組分的E2呈波動變化趨勢;AIM 和HIM 組分的E2基本呈先降低后趨于穩定的趨勢變化。對E3和E4而言,HOA、AIM 和HIM 組分的E3和E4均基本呈先降低后趨于穩定的趨勢變化;HOB 和HON 組分的E3和E4均呈波動變化趨勢。綜上所述,HOA、AIM 和HIM 組分的芳環取代基以C=O、COOH、OH 或酯基為主,HON 組分以脂肪鏈為主,HOB 組分則兩者兼有;HOA 組分的芳香性先降低后趨于穩定,HOB 和HON 組分處于動態趨勢,AIM 和HIM 組分則先增加后趨于穩定;HOA、AIM 和HIM 組分的團聚化、腐殖化程度先增加后趨于穩定,HOB 和HON 組分則呈動態變化。
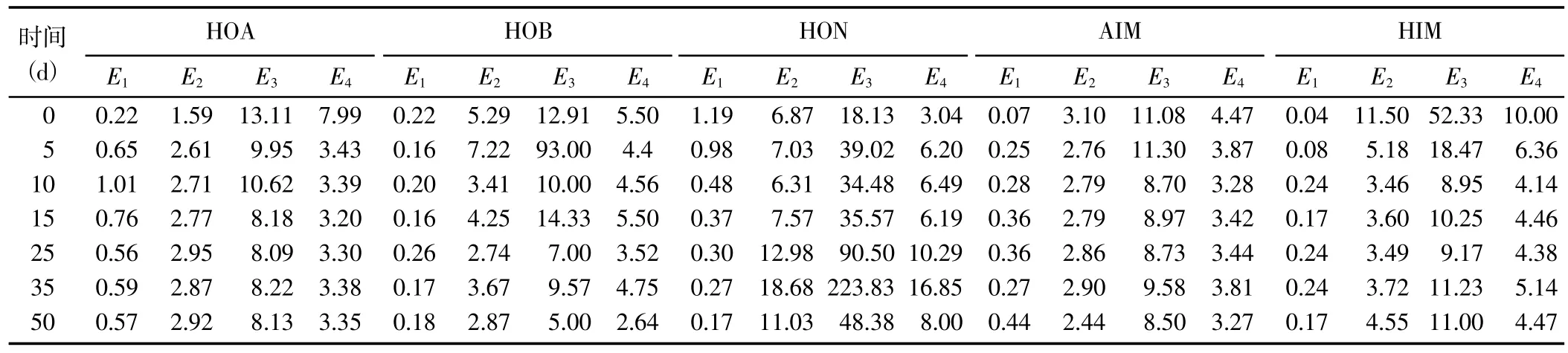
表1 腐解過程中不同DOM 組分光譜特性指標的變化Table 1 Changes in spectral characteristics of different DOM fractions during the decomposition
2.2 DOM 的三維熒光光譜
熒光峰更多反映的是DOM 組分在組成和結構上的差異。DOM 的熒光發色團通常具有π 電子共軛體系,其化學結構、空間構型和化學環境的不同,均會對三維熒光光譜會產生一定的影響[25]。根據熒光峰位置和前人研究[26,27],DOM 分級組分的三維熒光光譜分為5 個區域:類酪氨酸蛋白質(Ex/Em=220~250 nm/280~330 nm)、類色氨酸蛋白質(Ex/Em=220~250 nm/330~380 nm)、類富里酸(Ex/Em=220~250 nm/380~550 nm)、可溶性微生物代謝產物(Ex/Em=250~400 nm/280~380 nm)和類胡敏酸(Ex/Em=>250 nm/380~600 nm)。
經分析,HIM 組分未檢測到明顯的三維熒光峰。從腐解過程中不同DOM 分級組分的熒光峰類型(表2)可以看出,腐解15 d 后,4 種DOM 組分幾乎均以類胡敏酸為主,表明腐解中后期DOM 逐漸團聚化并形成分子量較大的胡敏酸類物質。腐解第0 天時,HOA 組分以類胡敏酸為主;腐解5 d 后,HOA 組分被土壤微生物分解轉變為類富里酸物質;隨后,類富里酸或其分解產物與其它組分發生團聚作用,進一步形成比較穩定的類胡敏酸物質。腐解第0 天時,HOB組分以類胡敏酸和類富里酸為主;隨后,類富里酸被土壤微生物降解生成可溶性微生物代謝產物,當腐解至第10~25 天時類胡敏酸和可溶性微生物代謝產物被進一步降解,HOB 組分的熒光峰消失,當腐解至第35~50 天時類富里酸和類胡敏酸先形成后又消失。腐解第0~5 天時HON 組分以可溶性微生物代謝產物為主,腐解至第10~50 天時HON 組分以類胡敏酸為主,這與HON 組分在上述2 個腐解階段中紫外吸收峰形先窄后寬的結果相一致。腐解第0~10 天時,AIM 組分未檢測到明顯的熒光峰;之后,AIM 組分以類胡敏酸為主。
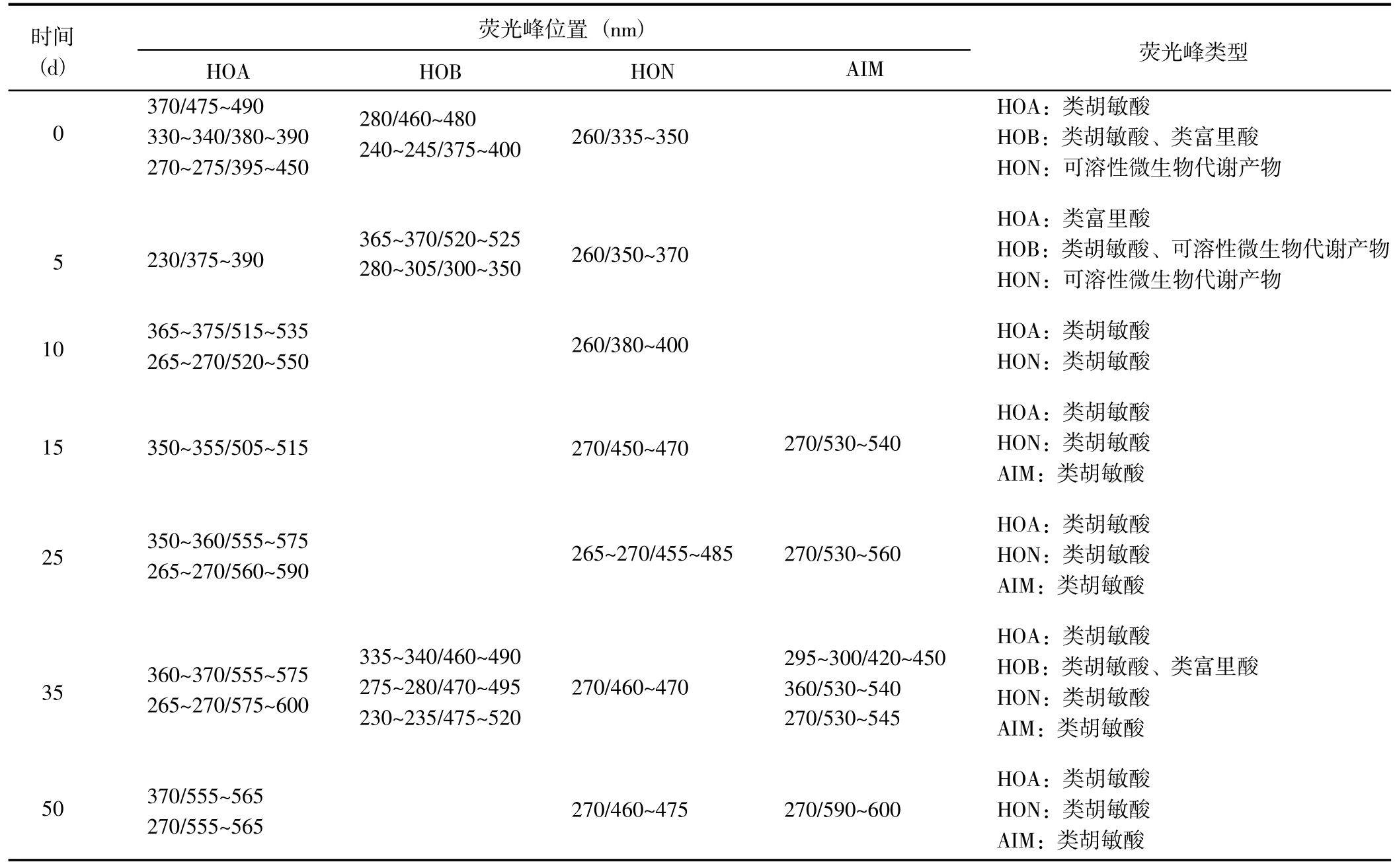
表2 腐解過程中不同DOM 組分熒光峰位置(λEx/λEm)和熒光類型的變化Table 2 Changes of fluorescence peak position (λEx/λEm) and type of different DOM fractions during decomposition
2.3 DOM 的同步熒光光譜
與傳統的熒光光譜相比,同步熒光光譜的峰形、峰寬和峰位等均可隨激發波長和發射波長的偏差大小而發生變化,因而選擇合適的波長差就能提供較多的DOM 結構信息。研究表明,當波長差約為60 nm 時,大多數熒光峰能夠得以呈現[28],因此本試驗選擇波長差為60 nm 進行同步熒光光譜的測定。根據Liu 等[29]的觀點,發射波長260~300 nm 歸屬為類蛋白質物質,主要為類酪氨酸和類色氨酸物質;300~355 nm 歸屬為微生物源類腐殖質,與微生物代謝活動有關;355~420 nm 歸屬為類富里酸,通常含3~4 個苯環結構或更高共軛度的多環芳烴;420~550 nm 歸屬為類胡敏酸,通常含5~7 個苯環結構的多環芳烴。
從5 種DOM 組分的同步熒光光譜結果(圖8~12)可以看出,HIM、AIM 和HOB 組分幾乎均在285~295 nm出現熒光峰,HOA、HIM 和AIM 組分幾乎均在505~513 nm 存在熒光峰。腐解第0 天時,HOA 組分的熒光峰位于340~345 nm、425~429 nm 和505~513 nm,歸屬為微生物源類腐殖質和類胡敏酸物質;之后,340~345 nm 的熒光峰逐漸藍移至349~351 nm,而425~429 nm 的熒光峰則先紅移至456~465 nm,隨后藍移至431~453 nm 并形成較寬的熒光峰。腐解第0 天時,HIM 組分的熒光峰位于338~341 nm 和394~404 nm,歸屬為微生物源類腐殖質和類富里酸;之后,338~341nm的熒光峰輕微紅移至339~343 nm,而394~404 nm 的熒光峰則幾乎變化不大。腐解第0天時,AIM 組分的熒光峰位于341~344 nm 和394~400 nm,歸屬為微生物源類腐殖質和類富里酸;之后,341~344 nm 和394~400 nm的熒光峰分別逐漸紅移至344~349 nm 和436~444 nm。表明隨腐解進行,AIM 組分逐漸形成分子量更大、共軛性更強的腐殖質類物質。腐解第0 天時,HOB 組分的熒光峰主要位于337~342 nm 和420~433 nm,歸屬為微生物源類腐殖質和類胡敏酸物質;之后,337~342 nm和418~433 nm 的熒光峰發生不同程度的紅移。研究還發現,腐解第5 天和第35天時,HOB 組分分別在502~512 nm 和397~401 nm 出現新熒光峰,歸屬為類富里酸和類胡敏酸物質。腐解第0 天時,HON 組分的熒光峰位于316~320 nm,歸屬為微生物源類腐殖質;之后,熒光強度逐漸降低,熒光峰位置逐漸紅移至355~358 nm,說明HON 組分逐漸形成類胡敏酸物質。
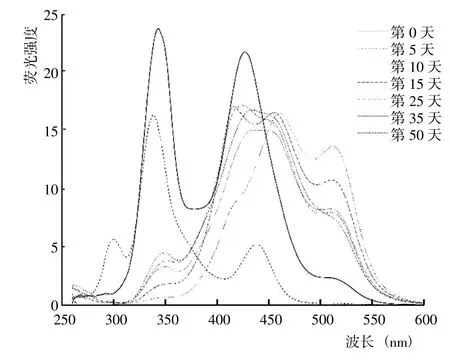
圖8 腐解過程中HOA 組分同步熒光光譜的變化Fig.8 Changes of synchronized fluorescence spectrum from HOA fractions during decomposition
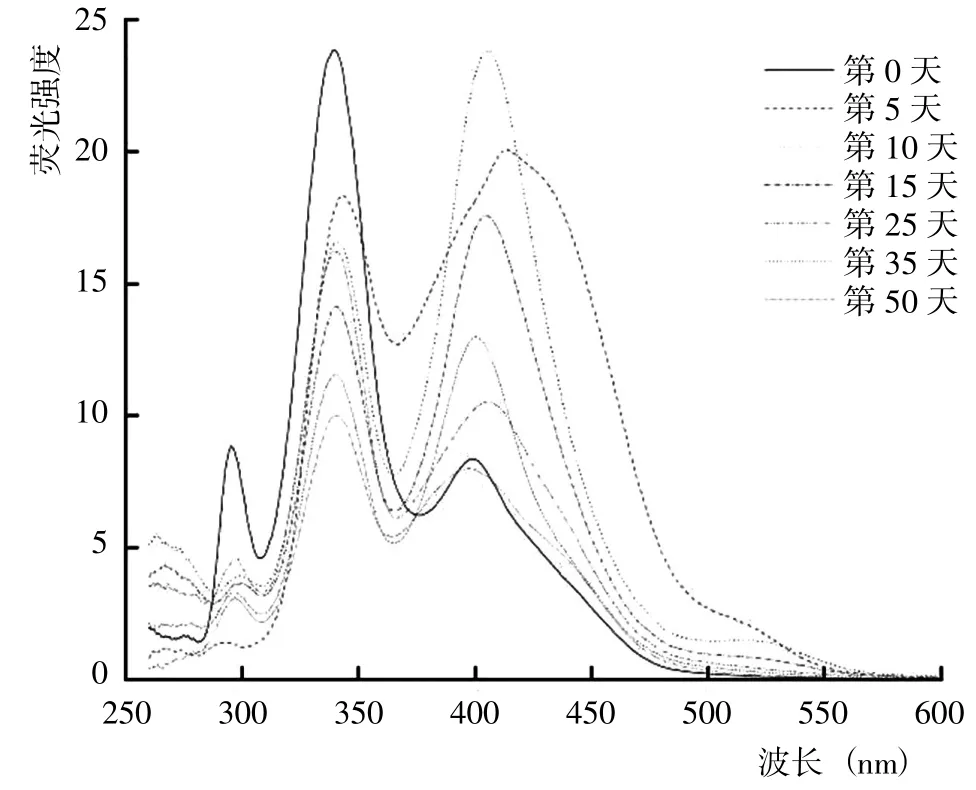
圖9 腐解過程中HIM 組分同步熒光光譜的變化Fig.9 Changes of synchronized fluorescence spectrum from HIM fractions during decomposition

圖10 腐解過程中AIM 組分同步熒光光譜的變化Fig.10 Changes of synchronized fluorescence spectrum from AIM fractions during decomposition
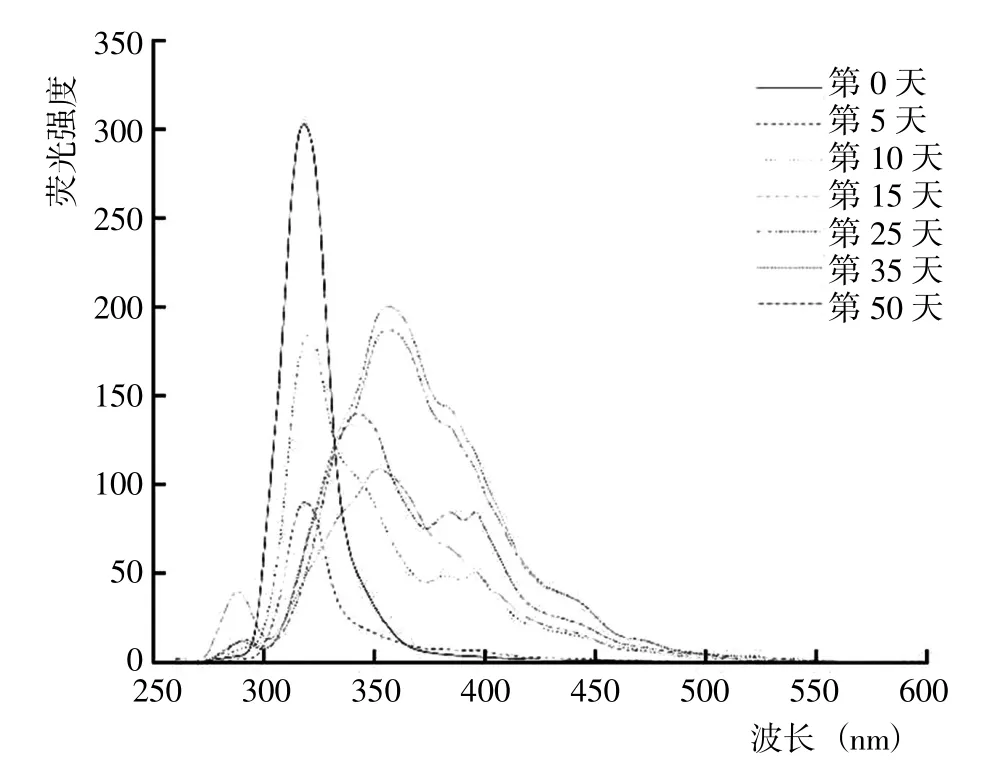
圖11 腐解過程中HON 組分同步熒光光譜的變化Fig.11 Changes of synchronized fluorescence spectrum from HON fractions during decomposition

圖12 腐解過程中HOB 組分同步熒光光譜的變化Fig.12 Changes of synchronized fluorescence spectrum from HOB fractions during decomposition
3 結論與討論
3.1 討論
本研究結果顯示,在不同腐解階段,5 種DOM 組分在某些波長范圍內存在差異,說明DAX-8 樹脂法可用于玉米秸稈DOM 的分級分離;同時5 種DOM 組分的吸收光譜較為相似性,表明其含有相似的化學結構和官能團。郭杏妹等[30]研究表明,5 種DOM 組分僅在紫外短波末端出現較強的“末端吸收”,原因與芳環或與芳環共軛的不飽和結構上π 電子流動性增加有關。本研究條件下,除腐解第0 天的HOA 組分外,5 種DOM 組分的紫外吸收值幾乎均隨波長的增加而降低,這與余旭芳等[4]關于小麥秸稈DOM 組分的紫外光譜相一致。紫外光譜特性發現,HOA、AIM 和HIM 組分芳環取代以C=O、COOH、OH 或酯基為主,HON 組分以脂肪鏈為主,HOB 組分則兩者兼有,說明腐解過程中HOA、AIM 和HIM 組分芳環被氧化程度占優勢,HON 組分芳環被還原程度占優勢;HOA 組分的芳香性先降低后趨于穩定,HOB 和HON 組分的芳香性則處于動態變化,AIM 和HIM 組分的芳香性先增加后趨于穩定;HOA、AIM、HIM 組分的團聚化和腐殖化程度均表現為先增加后趨于穩定,HOB 和HON 組分的團聚化和腐殖化程度呈波動趨勢。
本研究結果顯示,與腐解第0 天相比,4 種DOM組分在腐解后期部分熒光峰消失,原因與4 種DOM 組分和其它化合物發生相互作用引起的熒光猝滅有關[31]。腐解10 d 后,4 種DOM 組分的熒光峰類型幾乎均以類胡敏酸為主,表明此時其化學組成和結構較為穩定,這也與腐解10 d 后其紫外光譜峰形基本保持不變的結果相一致。研究還發現,與腐解第0 天相比,HOA 的熒光峰先藍移后紅移,HOB 組分的熒光峰既有紅移也有藍移且最終徹底消失,HON 組分的熒光峰明顯紅移,AIM 組分則在腐解中后期出現類胡敏酸熒光峰。由于C=O、COOH、-OH、-OR 等給電子基團通常使DOM 組分熒光峰發生紅移并形成分子量較大的類胡敏酸物質,而芳環共軛雙鍵被破壞或上述官能團減少等因素則使熒光峰發生藍移,通常轉化形成小分子量化合物[32]。因此,可認為HOA、HON 和AIM組分最終傾向于形成分子量較大的類胡敏酸物質。
本研究結果顯示,在三維熒光光譜中難以分辨的部分熒光峰可在同步熒光光譜中得以識別,如HOA、HIM 和AIM 組分幾乎均在285~295 nm 存在較弱的熒光峰,但其在三維熒光光譜中均未檢測到明顯的類蛋白質峰;再如,在同步熒光光譜中發現HIM 組分可產生2 個熒光峰,但在三維熒光光譜中未檢測到明顯的熒光峰。這表明同步熒光光譜可以提供三維熒光光譜難以提供的DOM 結構信息。研究還發現,HOA 組分以及腐解第5 天時的HOB 組分均在505~513 nm 存在較強的熒光峰,表明HOA 組分和腐解第5 天時的HOB 組分均以類胡敏酸物質為主,這也與三維熒光光譜熒光峰類型的結果相一致。
3.2 結論
(1)通過紫外光譜可知,采用DAX-8 樹脂可將玉米秸稈DOM 組分進行分級分離,得到HOA、HOB、HIM、HON 和AIM 共5 個組分。HOA、HON 和AIM組分逐漸在280 nm 附近形成吸收峰,HIM 和HOB 組分則無明顯的特征性吸收峰。
(2)HOA、AIM 和HIM 組分中芳環被氧化程度逐漸占優,HON 組分中芳環被還原程度逐漸占優。HOA組分的芳香性先降低后趨于穩定,AIM 和HIM 組分與之相反,HOB 和HON 組分的芳香性則處于動態變化。HOA、AIM 和HIM 組分的團聚化、腐殖化程度均表現為先增加后趨于穩定,HOB 和HON 組分的團聚化、腐殖化程度呈波動趨勢。
(3)通過三維熒光和同步熒光圖譜可知,在玉米秸稈腐解中后期,HOA、HON 和AIM 組分主要向類胡敏酸物質轉化,HOB 組分則無明顯的變化規律。

