不同升溫模式對北京鴨肉肌球蛋白熱凝膠特性的影響
周銀娜 魏相茹 張德權 王振宇

(1.寧夏大學食品與葡萄酒學院,寧夏 銀川 750021;
2.中國農業科學院農產品加工研究所,農業農村部農產品質量安全收貯運管控重點實驗室,北京 100193)
摘 要:以北京鴨肉肌球蛋白為原料,采用圓二色譜和低場核磁共振等技術手段,研究升溫速率(1.0、1.5、2.0、2.5 ℃/min)和加熱終點溫度(80、90、100 ℃)對北京鴨肉肌球蛋白凝膠特性的影響。結果表明:在加熱過程中隨著溫度的升高,鴨肉肌球蛋白二級結構α-螺旋結構轉變成β-折疊,α-螺旋結構的含量逐漸降低,β-折疊含量逐漸增加,促進蛋白凝膠化;在傳統掛爐烤制的升溫模式下,北京鴨肉肌球蛋白凝膠硬度、強度和凝膠體中的自由水含量在終點溫度為80 ℃時顯著低于90 ℃和100 ℃(P<0.05);在線性升溫模式下,升溫速率增加,肌球蛋白凝膠保水性和強度下降,肌球蛋白凝膠特性降低;與傳統掛爐烤制的升溫模式相比,較低升溫速率(1.0、1.5 ℃/min)下凝膠保水性升高,2.5 ℃/min升溫速率下肌球蛋白凝膠保水性顯著降低。
關鍵詞:北京鴨;肌球蛋白;升溫速率;凝膠強度;水分狀態
Effects of Different Heating Modes on Gel Properties of Beijing Duck Myosin
ZHOU Yinna1,2, WEI Xiangru2, ZHANG Dequan2, WANG Zhenyu2,*
(1.School of Food and Wine, Ningxia University, Yinchuan 750021, China; 2.Key Laboratory of Agro-Products Processing,
Ministry of Agriculture and Rural Affairs, Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract: The effects of heating rate (1.0, 1.5, 2.0 and 2.5 ℃/min) and end point temperature (80, 90 and 100 ℃) on the gel characteristics of Beijing duck myosin were studied by circular dichroism (CD) and low-field nuclear magnetic resonance (LF-NMR). The results showed that the α-helix structure of duck myosin was transformed into β-sheet with increasing temperature during the heating process; the proportion of α-helix gradually decreased, while the proportion of β-sheet gradually increased, which promoted the gelation of myosin. Under the traditional hanging oven heating mode, the hardness, strength and free water content of Beijing duck myosin gel were significantly lower at end point temperature of 80 ℃ than at 90 and 100 ℃ (P < 0.05). In the linear heating mode, the gel water-holding capacity (WHC) and strength of myosin decreased with increasing heating rate. Compared with the traditional hanging oven heating mode, the gel WHC increased at heating rates of 1.0 and 1.5 ℃/min, but decreased significantly at 2.5 ℃/min.
Keywords: Beijing duck; myosin; heating rate; gel strength; moisture state
DOI:10.7506/rlyj1001-8123-20230307-019
中圖分類號:TS251.1? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼:A 文章編號:1001-8123(2023)06-0008-07
引文格式:
周銀娜, 魏相茹, 張德權, 等. 不同升溫模式對北京鴨肉肌球蛋白熱凝膠特性的影響[J]. 肉類研究, 2023, 37(6): 8-14. DOI:10.7506/rlyj1001-8123-20230307-019.? ? http://www.rlyj.net.cn
ZHOU Yinna, WEI Xiangru, ZHANG Dequan, et al. Effects of different heating modes on gel properties of Beijing duck myosin[J]. Meat Research, 2023, 37(6): 8-14. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20230307-019.? ? http://www.rlyj.net.cn
北京鴨具有肌間脂肪含量高、皮脂率高的特點,常被用作北京烤鴨的原料鴨[1]。北京烤鴨作為我國傳統的烤肉制品,具有皮脆、肉嫩的特點[2]。嫩度與肌肉中的肌原纖維蛋白功能特性緊密相關[3],肌原纖維蛋白的凝膠性能直接影響肉制品的質量、口感等特性[3-4]。肌球蛋白是肌肉蛋白中含量最豐富的蛋白質,約占肌肉總蛋白質的近1/4,占肌原纖維蛋白的50%~60%,具有形成凝膠的作用[5-6]。肌球蛋白是唯一經單獨熱誘導就可以形成凝膠的蛋白質,是形成凝膠的關鍵[7]。肌球蛋白經熱誘導形成凝膠的過程可分為:1)蛋白質分子受熱發生變性,蛋白質分子的結構展開;2)被破壞的蛋白質分子之間相互作用發生聚集;3)最后形成凝膠網絡3 個步驟[5]。
蛋白凝膠的質構特性和凝膠特性受不同加熱方式的影響[8-10]。例如,微波加熱由于其加熱速度快能顯著提高魚糜凝膠硬度、持水性及凝膠強度[10]。升溫速率的增加可以提高魚糜凝膠的剪切力和持水性,改善凝膠網絡結構,但降低了凝膠的硬度[11-12]。因此,升溫速率會直接影響凝膠制品的凝膠特性和質構特性。
前人研究結果發現相較于傳統恒溫加熱所得到的凝膠,程序升溫更有利于形成有序的三維網絡結構,使得凝膠強度和持水性提高[13]。傳統恒溫加熱時,熱量由外向內迅速傳遞至蛋白溶液,蛋白分子內部運動不規則,導致凝膠網絡結構雜亂無序;而在線性升溫模式下,蛋白溶液有足夠的時間吸收熱量,蛋白分子定向有序聚集,更利于蛋白凝膠的形成[14]。柳艷霞等[15]采用模型擬合傳統掛爐烤制下的北京烤鴨中心溫度變化,發現在傳統烤制過程中,其中心溫度以二次函數的形式增長,烤制結束時烤鴨肉質細嫩,有助于提高鴨肉的嫩度。而升溫模式對鴨肉肌球蛋白熱凝膠特性的影響研究較為缺乏。
因此,本研究以北京烤鴨的傳統掛爐烤制為對照,研究線性升溫模式對北京鴨肉肌球蛋白在不同加熱終點溫度下凝膠的質構特性、保水性、凝膠強度和水分遷移的影響,明確升溫速率對北京鴨肉肌球蛋白凝膠特性的影響,為鴨肉加工工藝提供理論依據。
1 材料與方法
1.1 材料與試劑
原料肉均購于東風鴨業養殖基地(河北),隨機選取12 只飼養方式和生長環境相同且經檢疫合格的38 日齡北京鴨,經屠宰后立即取鴨胸肉與腿肉,去除鴨皮及皮下脂肪,剔除表面可見的筋膜與結締組織。
乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA) 上海源葉生物科技有限公司;三羥基甲基氨基甲烷(Tris) 北京百旺通達科技有限公司;鹽酸(HCl)、氯化鉀(KCl)、氯化鎂(MgCl2) 上海麥克林生化科技有限公司;β-巰基乙醇 上海吉至生化科技有限公司;乙酸鎂、磷酸二氫鉀(KH2PO4)、磷酸氫二鉀(K2HPO4) 北京索萊寶科技有限公司;乙二醇雙(2-氨基乙基醚)四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA) 北京金鋇生物科技有限公司;順丁烯二酸 上海阿拉丁生化科技股份有限公司;腺苷-5-三磷酸二鈉鹽水合物(ATP·Na2) 生工生物工程(上海)股份有限公司;所有試劑均為分析純。
1.2 儀器與設備
Ultra TurraxDisperser S25分散器 德國IKA公司;EMS-19磁力攪拌器 天津歐諾儀器股份有限公司;DK-S28電熱恒溫水浴鍋 上海精宏實驗設備有限公司;ML 204/02電子天平 梅特勒-托利多(上海)有限公司;FCR1000-UF-E超純水機 青島富勒姆科技有限公司;TA-XT2i Plus質構儀 英國Stable Micro Syetem公司;5430R低溫高速離心機 德國Eppendorf公司;CM3500徠卡冷凍切片機 德國Leica公司;NMR-NMI20低場核磁共振(low field nuclear magnetic resonance,LF-NMR)分析儀 上海紐邁集團。
1.3 方法
1.3.1 肌球蛋白提取
根據Han Minyi[16]、婁愛華[17]等的研究方法,稍加修改。以北京鴨胸肉和腿肉為原料,從中提取肌球蛋白。為防止蛋白變性和水解,所有提取步驟均在4 ℃下進行。將鴨肉快速攪碎,取100 g鴨肉加入500 mL緩沖液(含20 mmoL/L EDTA和0.1 mol/L Tris-HCl,pH 7.0),磁力攪拌10 min。3 000×g條件下離心10 min,取沉淀并加入400 mL溶液A(0.1 mol/L KCl、0.1 mol/L KH2PO4/K2HPO4、10 mmol/L Na4P2O7、1 mmol/L MgCl2、2 mmol/L EGTA,pH 6.4)中,混合,并用磁力攪拌10 min。5 000×g離心10 min,取上清,加入9 倍體積預冷超純水稀釋,靜置12 h。虹吸出上清部分,沉淀物以12 000×g離心12 min,取沉淀,加入300 mL溶液B(0.1 mol/L KCl,pH 7.0),使用磁力攪拌器攪拌提取,1 500×g離心10 min,取沉淀,加入300 mL溶液C(0.3 mol/L KCl、0.15 mol/L KH2PO4/K2HPO4、5 mmol/L?Na4P2O7、5 mmol/L MgCl2、1 mmol/L EGTA、2 mmol/L?ATP·Na2,pH 6.5),攪拌提取30 min。隨后,緩慢加入粉末狀的硫酸銨固體,飽和濃度達到35%,10 000×g條件下離心25 min,取上清液;并再次加入粉末狀的硫酸銨固體,飽和濃度達到48%,攪拌10 min后,10 000×g條件下離心25 min,取沉淀。
將所得沉淀溶于磷酸鹽緩沖液(0.6 mol/L KCl、0.2 mol/L KH2PO4/K2HPO4,pH 6.5)透析24 h,透析液為肌球蛋白提取液,每6 h換1 次透析液,4 ℃貯藏備用。
1.3.2 肌球蛋白凝膠的制備
使用磷酸鹽緩沖液(0.6 mol/L KCl、0.2 mol/L KH2PO4/K2HPO4,pH 6.5)將從鴨胸肉中提取的肌球蛋白質量濃度調至15 mg/mL,加入至燒杯中,封口后置于水浴鍋中加熱處理,按照不同的升溫模式制備凝膠,用于其質構特性、凝膠強度、保水性及水分分布分析。
傳統掛爐烤制升溫模式制備凝膠:參考柳艷霞等[15]的傳統掛爐烤制升溫模式,控制升溫時間,以二次函數(T=19.824+1.807t-0.882t2),從25 ℃開始程序升溫,終點溫度為80、90、100 ℃,保溫20 min,取出置于冰盒中預冷,隨后轉入4 ℃冰箱過夜平衡。
線性升溫模式制備凝膠:以特定的升溫速率(1.0、1.5、2.0、2.5 ℃/min)從25 ℃開始程序升溫,終點溫度為80、90、100 ℃,保溫20 min,取出置于冰盒中預冷,隨后轉入4 ℃冰箱過夜平衡。
1.3.3 蛋白質的二級結構測定
采用圓二色譜測定肌球蛋白的二級結構。根據魏相茹[14]研究中的測定方法,稍作修改.將提取的肌球蛋白質量濃度用0.6 mol/L KCl-磷酸鹽緩沖液調至0.25 mg/mL。
將肌球蛋白樣品轉移至光程為1 cm的石英比色皿中,掃描范圍為190~250 nm,掃描速率為100 nm/min,掃描間隔為0.5 s,樣品池光徑為1 mm,測量溫度為4 ℃,并以KCl-磷酸鹽緩沖液為空白。每個樣品掃描3 次,數據采用DichroWeb 在線分析程序進行處理。
1.3.4 凝膠質構特性測定
根據魏相茹[14]的研究方法,稍加修改。將肌球蛋白凝膠樣品切分為長、寬、高均為1 cm的立方體,采用質構儀進行質地剖面分析(texture profile analysis,TPA)。主要參數:探頭類型為P/50,測前速率2.0 mm/s,測試速率和測后速率1.0 mm/s,形變率50%,感應力0.05 N。
1.3.5 凝膠強度測定
參考陳雪珂[18]通過質構儀進行測定。主要參數:探頭采用P/0.5,測試速率1.0 mm/s,觸發力5 g,下壓距離4 mm,凝膠強度單位為g。
1.3.6 凝膠保水性測定
參考Pan Teng[19]、朱宏星[20]等方法,稍作修改。稱取1 g凝膠于離心管中,10 000×g離心10 min,除去離心后的水分,再稱質量,記錄離心管質量和離心前后離心管與凝膠的質量,保水性按下式計算。
式中:m1為離心管+離心后除去水分后的凝膠總質量/g;m2為離心管+未除去水分的凝膠總質量/g;m為離心管的質量/g。
1.3.7 凝膠水分分布測定
根據馮雪平[21]的方法,稍作修改。采用LF-NMR分析儀測定自旋-自旋橫向弛豫時間T2。稱取1 g樣品放入核磁測定專用無信號玻璃管中,置于LF-NMR分析儀中進行測定。自旋-自旋橫向弛豫時間T2用CPMG序列測定,測試條件:測試室溫度32 ℃,質子共振頻率22 MHz,采樣頻率100 Hz,τ值(90°脈沖和180°脈沖之間的時間)300 μs,重復掃描8 次,重復間隔時間6 s,掃描10 000 個回波,得到的圖為指數衰減圖形。
1.4 數據處理
每個實驗均重復3 次,結果表示為平均值±標準差,使用SPSS 23.0軟件進行顯著性分析,各組間的數值進行單因素方差分析和Duncans多重比較分析,P<0.05時具有顯著性差異。使用Microsoft Excel 2016軟件進行數據處理,并使用Origin 2022軟件繪圖。
2 結果與分析
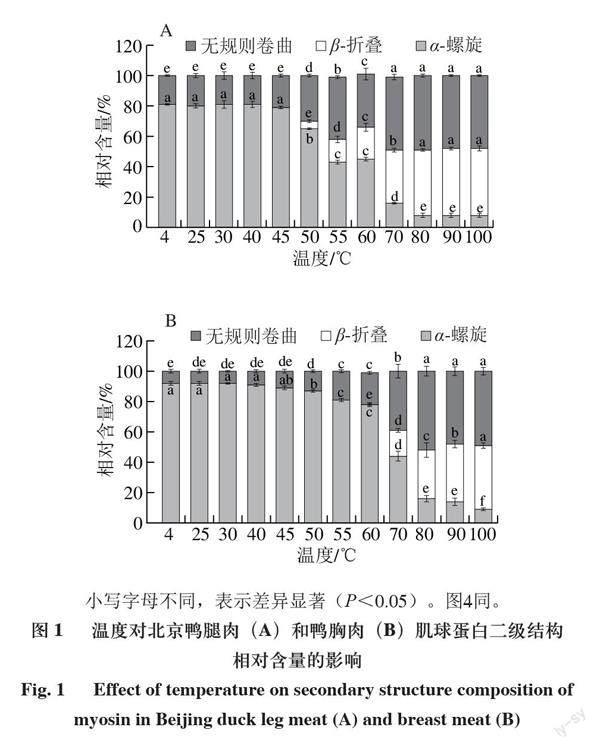
2.1 加熱過程中北京鴨肉肌球蛋白二級結構變化分析
小寫字母不同,表示差異顯著(P<0.05)。圖4同。
蛋白質的二級結構是由蛋白質多肽鏈折疊、彎曲構成的空間結構,主要有α-螺旋、β-折疊、β-轉角和無規則卷曲4 種結構[22]。北京鴨肉肌球蛋白是以α-螺旋結構為主導的蛋白質。由圖1可知,隨著加熱溫度的升高,肌球蛋白的α-螺旋結構相對含量呈現下降的趨勢,β-折疊和無規則卷曲的相對含量呈現上升趨勢。低溫(4~45 ℃)下并未引起蛋白質二級結構的顯著變化,胸肉中肌球蛋白α-螺旋結構相對含量維持在89%~92%,腿肉中的α-螺旋的相對含量維持在79%~100%。加熱溫度至50 ℃時,鴨腿肉肌球蛋白開始形成β-折疊。與低溫相比,當加熱至70 ℃時,鴨腿肉和鴨胸肉中肌球蛋白的α-螺旋結構相對含量分別顯著下降至16%和44%,同時β-折疊的相對含量分別增加35%和17%,無規則卷曲的相對含量分別增加40%和30%,這說明肌球蛋白在此溫度下變性。隨著溫度的升高,α-螺旋結構的相對含量減少,這主要是由于加熱使得肌球蛋白發生變性,破壞了多肽鏈中羰基和氨基之間的氫鍵,使得α-螺旋發生解旋。Li Fangfei等[23]研究表明,多肽鏈中羰基和氨基之間的氫鍵會直接導致
α-螺旋的相對含量發生變化。加熱促進α-螺旋結構發生折疊,導致α-螺旋結構向β-折疊結構轉化,所以隨著溫度的升高,β-折疊結構的相對含量不斷增加[24]。在肌球蛋白通過加熱形成凝膠的過程中,α-螺旋結構的相對含量下降,β-折疊和無規則卷曲結構增加的現象較為普遍[25]。
α-螺旋結構影響肌球蛋白凝膠化,其相對含量降低有利于肌球蛋白發生聚集,從而形成的凝膠結構更為致
密[26]。溫度升高,肌球蛋白尾部結構發生解離變性,肌球蛋白分子之間進行重新排列、連接,并擴大形成更大的網絡結構[27]。α-螺旋相對含量的減少說明肌球蛋白分子展開程度隨著溫度的升高而增加,β-折疊相對含量增加則表示蛋白質分子間聚集程度增加,在升溫過程中,肌球蛋白分子逐漸展開,然后發生聚集[28]。
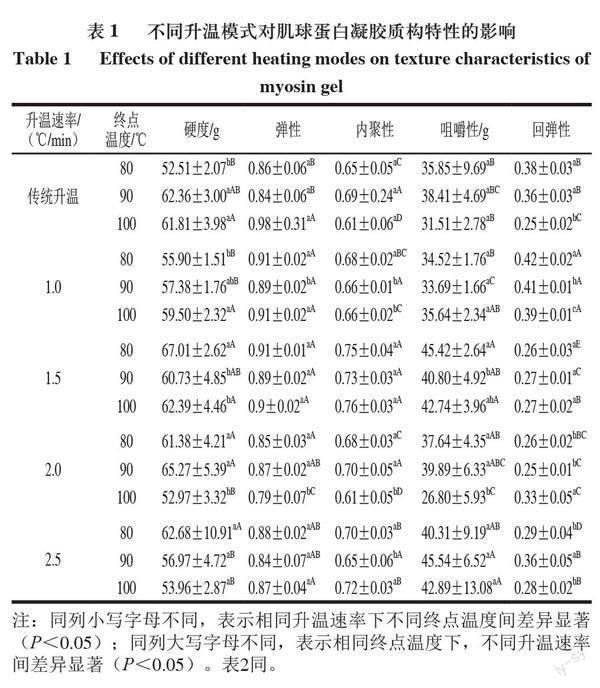
2.2 不同升溫模式對鴨肉肌球蛋白凝膠質構特性的影響
由表1可知,傳統升溫模式下,隨著凝膠終點溫度的升高,鴨肉肌球蛋白凝膠的硬度呈先增加后降低的趨勢,且終點溫度為80 ℃時得到的肌球蛋白凝膠硬度顯著低于90 ℃和100 ℃得到的凝膠硬度(P<0.05)。肌球蛋白凝膠的回彈性呈現降低趨勢,內聚性和咀嚼性變化不顯著。這可能是隨著凝膠終點溫度持續升高,暴露出更多的功能性官能團,肌球蛋白凝膠的質地硬度增加,而當終點溫度升高至100 ℃時,由于溫度過高導致肌球蛋白自身結構被破壞,未能在變性后相互作用而再發生聚合,從而導致凝膠的硬度相對有所降低,回彈性下降[29]。
Liu Fangfang等[30]研究溫度對鱸魚肌球蛋白變性和聚集的影響,發現二硫鍵(S—S)隨著溫度的升高而增加,二硫鍵的形成會導致肌球蛋白分子發生交聯和聚合,從而增強蛋白質的結構,影響蛋白凝膠的硬度、彈性等質構特性。線性升溫模式下,當終點溫度為80 ℃時,隨著升溫速率的升高,肌球蛋白凝膠的硬度和咀嚼性先增大后趨于穩定,回彈性呈現下降的趨勢。隨著凝膠終點溫度的升高,1 ℃/min升溫速率下得到的肌球蛋白凝膠的硬度有增加趨勢,回彈性與內聚性呈現下降的趨勢,而1.5、2.0、2.5 ℃/min升溫速率下得到的肌球蛋白凝膠硬度和咀嚼性隨著終點溫度的升高具有下降趨勢,這可能是由于較低的升溫速率下肌球蛋白可以獲得相對更長的變性、折疊及聚集時間,更有利于肌球蛋白分子結構的展開,導致更大程度的蛋白質聚集,從而改善蛋白質分子之間的交聯,且獲得的三維網絡結構更緊密有序[31]。
2.3 不同升溫模式對鴨肉肌球蛋白凝膠保水性的影響
小寫字母不同,表示相同終點溫度下,不同升溫模式間差異顯著(P<0.05);大寫字母不同,表示同一升溫模式下,不同終點溫度間差異顯著(P<0.05)。圖3同。
保水性是肉食用品質評定的重要指標,保水性的高低可直接影響肉的風味、嫩度、質地等多種指標[32]。由圖2可知,傳統掛爐烤制升溫模式下,隨著終點溫度的升高,凝膠保水性呈現先增后降趨勢,但是在3 個終點溫度(80、90、100 ℃)得到的肌球蛋白凝膠保水性無顯著差異。線性升溫模式下,隨著升溫速率增加,肌球蛋白凝膠保水性整體呈現下降的趨勢,這種現象可能是由于較低的升溫速率下,蛋白的展開速率高于聚集速率,使得形成的凝膠特性增強[33]。較低的升溫速率更有利于蛋白質之間的相互作用,從而減少凝膠的水分損失,提高持水性[27]。王月[33]的研究發現,低升溫速率(1 ℃/min)下肌球蛋白凝膠彈性和保水性更高,高升溫速率下凝膠表面粗糙,孔徑變大,凝膠網絡結構松散,保水性差,這與本研究的結果一致。不同升溫模式由于升溫速率不同熱傳導效率發生改變,低升溫速率下熱傳導速度慢,升溫時間長,肌球蛋白分子的結構展開更徹底,進行有序的頭部-頭部、尾部-尾部聚集,從而形成有序的三維網絡結構。
2.4 不同升溫模式對鴨肉肌球蛋白凝膠強度的影響
凝膠強度是用來評估凝膠質地的指標。由圖3可知,傳統掛爐烤制升溫模式下,凝膠強度隨著溫度的升高而增強,加熱至80 ℃得到的肌球蛋白凝膠強度顯著低于其他2 個終點溫度下得到的凝膠強度。這可能是溫度升高,形成的肌球蛋白聚集體進一步發生交聯,從而使得凝膠網絡結構更為緊密[21]。線性升溫模式下,1.0 ℃/min升溫速率下得到的肌球蛋白凝膠強度隨著終點溫度的升高具有增強趨勢,而1.5、2.0、2.5 ℃/min升溫速率下得到的肌球蛋白凝膠強度隨著溫度的升高具有下降趨勢。與傳統升溫模式相比,終點溫度為80 ℃時,線性升溫模式下得到的肌球蛋白凝膠強度升高;升溫速率2.5 ℃/min下,終點溫度為90 ℃時,得到的肌球蛋白凝膠強度顯著低于傳統升溫模式下得到的肌球蛋白凝膠強度(P<0.05)。Wang Limei等[34]研究射頻加熱對草魚肌原纖維蛋白凝膠水分分布及結構的影響,結果顯示,隨著電極間隙越大(升溫速率越低),凝膠強度越大,這與本研究結果一致。加熱升溫時,肌球蛋白發生變性和聚集是一個動態的過程,當蛋白質分子聚集速率大于變性速率時,雜亂地形成三維網絡凝膠結構,其表面粗糙,內部結構疏松,保水性差[33]。Cao Hongwei等[35]
研究微波結合傳統水浴對魚糜品質和形態的影響,發現微波加熱可以抑制蛋白質變性,促進蛋白質聚集,與傳統水浴加熱方式相比,微波結合水浴的加熱方式可以提高魚糜凝膠的凝膠強度和持水性,形成更好的網絡結構。但是較高的加熱速率會導致凝膠表面干燥、收縮,保水性較差。Bertram等[36]研究恒溫加熱和程序升溫對豬肉肌球蛋白凝膠的影響,發現程序升溫下豬肉肌球蛋白凝膠特性更強。因此,低升溫速率下,由于肌球蛋白分子有較長的時間進行變性,其蛋白結構展開更充分,并有序進行聚集,從而形成緊密的三維網絡凝膠結構,凝膠強度更大。
2.5 不同升溫模式對鴨肉肌球蛋白凝膠水分分布的影響
橫向弛豫時間T2可反映肌球蛋白凝膠中的水分與蛋白質分子結合的程度,可以表征蛋白凝膠中的水分狀態和水分遷移。由表2和圖4可知,凝膠弛豫時間T2范圍內相應的3 個峰分別對應凝膠中水的3 種狀態,T21、T22、T23分別為凝膠中結合水、不易流動水和自由水,對應的峰面積分別為S21、S22及S23[37]。S22占比最高,說明肌球蛋白凝膠中不易流動水含量相對較高。傳統升溫模式下,隨著終點溫度的升高,T21和T23整體升高,峰面積(S21和S23)增加,T22整體呈現降低趨勢,其對應的峰面積(S22)減小,說明隨著終點溫度的升高,不易流動水含量降低,凝膠中水的可流動性增強,持水能力下降,從而導致保水性降低,這可能是由于終點溫度升高,肌球蛋白中氫鍵斷裂后再連接聚集后形成的蛋白質空間結構更緊密,間隙變小,水分減少[38]。
線性升溫模式下,隨著終點溫度的升高,1 ℃/min升溫速率下得到的肌球蛋白凝膠,其內部各部分水的含量變化趨勢與傳統升溫模式下得到的凝膠一致。1 ℃/min升溫速率下,隨著終點溫度的升高,T22減小,S22占比下降,肌球蛋白凝膠中的不易流動水含量降低,這可能是由于在較低的升溫速率下,肌球蛋白解離和變性過程中一直有二硫鍵形成,在緩慢升溫過程中,二硫鍵逐漸增多,縮小了凝膠網絡結構中的間隙,使得水分不易發生遷移,從而導致T22下降[39]。相對較高的升溫速率下(1.5、2.0、2.5 ℃/min),隨著終點溫度的升高,T21和T23對應的峰面積S21、S23占比減小,T22對應的峰面積S22占比增加,說明肌球蛋白凝膠中結合水和自由水含量減小,不易流動水含量增加。
3 結 論
傳統升溫模式下,隨著肌球蛋白凝膠終點溫度的升高,肌球蛋白凝膠的硬度呈先增大后減小的趨勢,凝膠強度、自由水含量增加;線性升溫模式下,隨著升溫速率的升高,肌球蛋白凝膠硬度先升高后趨于穩定、回彈性呈現下降趨勢,保水性和凝膠強度具有下降趨勢。表明隨著升溫速率的增大,北京鴨肉肌球蛋白凝膠特性降低。在低升溫速率下,肌球蛋白凝膠有足夠的時間發生變性并展開蛋白質分子的完整結構。蛋白的展開速率高于聚集速率使得形成的凝膠特性增強;與傳統掛爐烤制的升溫模式相比,較低升溫速率(1.0、1.5 ℃/min)下凝膠保水性升高,較高升溫速率(2.0、2.5 ℃/min)下肌球蛋白凝膠保水性顯著降低。因此,較低的加熱速率更有利于肌球蛋白分子結構的展開,從而改善蛋白質分子之間的交聯,使得凝膠特性增強。
參考文獻:
[1] 秦樂蓉, 王欣, 曾池莉, 等. 櫻桃谷鴨與Z型北京鴨原料理化特性的比較分析[J]. 食品科技, 2020, 45(12): 114-121. DOI:10.13684/j.cnki.spkj.2020.12.018.
[2] 劉歡, 張德權, 王振宇, 等. 北京烤鴨腿皮與腿肉關鍵揮發性風味物質解析[J]. 中國食品學報, 2021, 21(2): 308-318. DOI:10.16429/j.1009-7848.2021.02.037.
[3] 王正雯, 田宏偉, 周富裕, 等. 加熱溫度對麻鴨肌原纖維蛋白結構與凝膠特性的影響[J]. 食品科學, 2020, 41(13): 61-68. DOI:10.7506/spkx1002-6630-20191128-280.
[4] LE Huisheng, LI Ting, CHEN Jun, et al. Gelling properties of myofibrillar protein from abalone (Haliotis discus Hannai Ino) muscle[J]. International Journal of Food Properties, 2018, 21(1): 277-288. DOI:10.1080/10942912.2018.1454463.
[5] 梁雯雯, 楊天, 郭建, 等. 升溫方式對鰱魚肌球蛋白結構和理化性質的影響[J]. 食品科學, 2021, 42(21): 24-31. DOI:10.7506/spkx1002-6630-20201012-086.
[6] XUN Siwen, YANG Huijuan, WANG Huhua, et al. High-pressure effects on the molecular aggregation and physicochemical properties of myosin in relation to heat gelation[J]. Food Research International, 2017, 99: 413. DOI:10.1016/j.foodres.2017.06.014.
[7] 胡忠良. 雞胸肉肌原纖維蛋白質氧化對其熱誘導凝膠和理化特性的影響[D]. 南京: 南京農業大學, 2012: 14-45. DOI:10.7666/d.Y2361191.
[8] 曹瑩瑩, 張亮, 王鵬 等. 超高壓結合熱處理對肌球蛋白凝膠特性及蛋白二級結構的影響[J]. 肉類研究, 2013, 27(1): 1-7.
[9] 吳曉麗, 朱玉安, 劉友明, 等. 升溫速率對草魚和鰱魚糜膠凝特性的影響[J]. 華中農業大學學報, 2015, 34(4): 114-119. DOI:10.13300/j.cnki.hnlkxb.2015.04.016.
[10] 朱玉安, 劉友明, 張秋亮, 等. 加熱方式對魚糜凝膠特性的影響[J]. 食品科學, 2011, 32(23): 107-110.
[11] JI H M, YOON W B, PARK J W. Assessing the textural properties of Pacific whiting and Alaska pollock surimi gels prepared with carrot under various heating rates[J]. Food Bioscience, 2017, 20: 12-18. DOI:10.1016/j.fbio.2017.07.008.
[12] YONGSAWATDIGUL J, PARK J W. Linear heating rate affects gelation of Alaska pollock and pacific whiting surimi[J]. Journal of Food Science, 1996, 61(1): 149-153. DOI:10.1111/j.1365-2621.1996.tb14746.x.
[13] CAO Hongwei, JIAO Xidong, FAN Daming, et al. Microwave irradiation promotes aggregation behavior of myosin through conformation changes[J]. Food Hydrocolloids, 2019, 96: 11-19. DOI:10.1016/j.foodhyd.2019.05.002.
[14] 魏相茹. 鴨肉烤制過程溫度對肌球蛋白聚集行為的調控作用[D].
北京: 中國農業科學院, 2020: 18-19. DOI:10.27630/d.cnki.gznky.2020.000821.
[15] 柳艷霞, 王振宇, 鄭曉春, 等. 基于品質指標預測北京烤鴨的中心溫度[J]. 中國農業科學, 2020, 53(8): 1655-1663. DOI:10.3864/j.issn.0578-1752.2020.08.014.
[16] HAN Minyi, WU Ye, WANG Peng, et al. The changes and relationship of structure and functional properties of rabbit myosin during heat-induced gelation[J]. CyTA Journal of Food, 2015, 13(1): 63-68. DOI:10.1080/19476337.2014.913687.
[17] 婁愛華, 潘騰, 陳星, 等. pH值對純化豬肉肌球蛋白熱聚集體的影響[J]. 中國食品學報, 2021, 21(6): 46-53. DOI:10.16429/j.1009-7848.2021.06.006.
[18] 陳雪珂. 肌球蛋白凝膠化過程中與迷迭香酸的互作機制及其對蛋白理化特性的影響[D]. 重慶: 西南大學, 2019: 42.
[19] PAN Teng, GUO Huiyuan, LI Yuan, et al. The effects of calcium chloride on the gel properties of porcine myosin-κ-carrageenan mixtures[J]. Food Hydrocolloids, 2017, 63: 467-477. DOI:10.1016/j.foodhyd.2016.09.026.
[20] 朱宏星, 高田毅, 黃楊, 等. 肌紅蛋白血紅素輔基氧化修飾對肌球蛋白功能特性及凝膠特性的影響[J]. 食品科學, 2022, 43(8): 1-8. DOI:10.7506/spkx1002-6630-20210201-011.
[21] 馮雪平. 熱處理溫度對鰱肌球蛋白結構和凝膠水分影響的研究[D]. 鎮江: 江蘇大學, 2016: 24.
[22] 于秋影, 曹傳愛, 梁雪, 等. 呼吸式滾揉工作時間對調理牛肉品質的影響[J]. 食品工業科技, 2023, 44(5): 28-35. DOI:10.13386/j.issn1002-0306.2022040246.
[23] LI Fangfang, WANG Bo, KONG Baohua, et al. Decreased gelling properties of protein in mirror carp (Cyprinus carpio) are due to protein aggregation and structure deterioration when subjected to freeze-thaw cycles[J]. Food Hydrocolloids, 2019, 97: 105223. DOI:10.1016/j.foodhyd.2019.105223.
[24] 高宇, 畢保良, 賈丹, 等. 青魚和鰱魚肌球蛋白熱誘導凝膠特性的比較[J]. 食品工業科技, 2021, 42(3): 1-5. DOI:10.13386/j.issn1002-0306.2020030335.
[25] XU Xianglian, HAN Minyi, FEI Ying, et al. Raman spectroscopic study of heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristic[J]. Meat Science, 2010, 87(3): 159-164. DOI:10.1016/j.meatsci.2010.10.001.
[26] CANDO D, HERRANZ B, JAVIER BORDERIAS A, et al. Effect of high pressure on reduced sodium chloride surimi gels[J]. Food Hydrocolloids, 2015, 51: 176-187. DOI:10.1016/j.foodhyd.2015.05.016.
[27] FOEGEDING E A, ALLEN C E, DAYTON W R. Effect of heating rate on thermally formed myosin, fibrinogen and albumin gels[J]. Journal of Food Science, 2010, 51(1): 104-108. DOI:10.1111/j.1365-2621.1986.tb10846.x.
[28] FAN Sanhong, GUO Jiamin, WANG Xuping, et al. Effects of lipoxygenase/linoleic acid on the structural characteristics and aggregation behavior of pork myofibrillar protein under low salt concentration[J]. LWT-Food Science and Technology, 2022, 161: 113359. DOI:10.1016/j.lwt.2022.113359.
[29] TADPITCHAYANGKOON P, PARK J W, YONGSAWATDIGUL J. Gelation characteristics of tropical surimi under water bath and ohmic heating[J]. LWT-Food Science and Technology, 2012, 46(1): 97-103. DOI:10.1016/j.lwt.2011.10.020.
[30] LIU Fangfang, HUANG Hui, LIN Wanling, et al. Effects of temperature on the denaturation and aggregation of (Lateolabrax japonicus) myosin from sea bass surimi[J]. Journal of Food Processing and Preservation, 2021, 45(5): 15417. DOI:10.1111/jfpp.15417.
[31] TIAN Fang, HAN Mengfan, WANG Yue, et al. Effects of heting rates on the self-assembly behavior and gelling properties of beef myosin[J]. Journal of the Science of Food and Agriculture, 2023, 103(5): 2473-2482. DOI:10.1002/jsfa.12456.
[32] 孔保華, 王宇, 夏秀芳, 等. 加熱溫度對豬肉肌原纖維蛋白凝膠特性的影響[J]. 食品科學, 2011, 32(5): 50-54.
[33] 王月. EGCG驅動熱誘導肌球蛋白非線性自組裝成膠的機制研究[D].
楊凌: 西北農林科技大學, 2022: 31-41. DOI:10.27409/d.cnki.gxbnu.2022.001454.
[34] WANG Limei, WANG Xian, MA Jing, et al. Effects of radio frequency heating on water distribution and structural properties of grass carp myofibrillar protein gel[J]. Food Chemistry, 2020, 343: 128557. DOI:10.1016/j.foodchem.2020.128557.
[35] CAO Hongwei, FAN Daming, JIAO Xidong, et al. Effects of microwave combined with conduction heating on surimi quality and morphology[J]. Journal of Food Engineering, 2018, 228(7): 1-11. DOI:10.1016/j.jfoodeng.2018.01.021.
[36] BERTRAM H C, AASLYNG M D, ANDERSEN H J. Elucidation of the relationship between cooking temperature, water distribution and sensory attributes of pork: a combined NMR and sensory study[J]. Meat Science, 2005, 70(1): 75-81. DOI:10.1016/j.meatsci.2004.12.002.
[37] 李玲, 郭燕云, 周怡. 氧化程度對肌原纖維蛋白理化特性和凝膠水分分布的影響[J]. 食品與發酵工業, 2019, 45(6): 97-103. DOI:10.13995/j.cnki.11-1802/ts.018135.
[38] WU Z Y, BERTRAM H C, KOHLER A, et al. Influence of aging and salting on protein secondary structures and water distribution in uncooked and cooked pork: a combined FT-IR microspectroscopy and 1H NMR relaxometry study[J]. Journal of Agricultural and Food Chemistry, 2006, 54(22): 8589-8597. DOI:10.1021/jf061576w.
[39] 王仕鈺. 微波對雞胸肉糜凝膠特性的影響研究[D]. 廣州: 華南理工大學, 2013: 68.
收稿日期:2023-03-07
基金項目:現代農業產業技術體系北京市創新團隊項目(BAIC06-2022)
第一作者簡介:周銀娜(1998—)(ORCID: 0009-0007-7808-7328),女,碩士研究生,研究方向為肉品加工理論與技術。
E-mail: zyn12355@163.com
*通信作者簡介:王振宇(1981—)(ORCID: 0000-0003-4478-1710),男,研究員,博士,研究方向為肉品加工理論與技術。
E-mail: caasjgsmeat2021_1@126.com

