梨矮化砧木中矮1 號組培快繁技術研究
王藝衡,馮靜涵*,于春亮,李濤,李金斗,趙健霄,張海霞,3,張玉星,3,馬輝,3,許建鋒,3
(1. 河北農業大學園藝學院,河北保定 071051;2. 威縣農業農村局,河北威縣 054700;3. 河北省梨技術創新中心,河北保定 071051)
矮化密植栽培具有早果豐產、優質高效、省地易管等優點,利用矮化砧木是實現梨矮化密植的重要途徑,但是國外選育的梨矮化砧木大都因其適應性差而不宜在我國推廣應用。 梨矮化砧木中矮1 號的代號為S2,由中國農業科學院果樹研究所在1980 年從‘錦香’梨(南果梨×巴梨) 的實生后代中選育而成,具有果實品質優良、樹冠矮化緊湊、豐產穩產、抗病性強(強抗腐爛病和枝干輪紋病)等特性,是我國北方梨園矮化密植的常用砧木[1-3]。
由于梨屬植物具有童期較長、自交不親和、雜合程度高等特質,其實生繁殖易造成果園整齊度差和苗木良莠不齊,這嚴重影響建園效果和優良砧木在生產上的應用推廣,所以無性系砧木成為現代果園生產的基礎,無性育苗成為現代果業發展的關鍵技術環節。 在無性繁殖中,嫁接、扦插等營養繁殖存在成本高、速度慢、質量差、品種混雜、病毒感染嚴重等諸多弊端[4,5],最關鍵的是中矮1號極難扦插成活。 組培快繁與之相比則具有增殖系數高、病害率少、基因型一致、不受季節和環境影響、短期大規模生產等眾多優勢,已被廣泛應用于植物的快速繁殖、品種改良、基因工程育種和種質資源保存等方面,在梨無性系砧木生產和現代生物育種中具有重要作用[6-9]。 但目前,組培快繁技術仍存在增殖系數低、生根率低、重復性差等問題。 所以本試驗以梨矮化砧木中矮1 號為試材,研究篩選其適宜的外植體種類及消毒方式、繼代和生根培養基及生根條件,以建立起一種增殖系數高、生根效果好的組培快繁技術,為建立高效、穩定的組培快繁體系提供依據,為梨的轉基因研究和遺傳轉化體系奠定基礎。
1 材料與方法
1.1 材料
2021 年3 月于河北省邢臺市威縣香花營種質資源圃,剪取芽體飽滿但未萌發的一年生中矮1 號健壯枝條,置于河北農業大學梨中心溫室中進行水培催芽,隔日換水以促進萌發。
1.2 試驗方法
1.2.1 中矮1 號外植體種類及消毒時間篩選將萌發后的芽體完整地取下(不破壞生長點)并作為外植體,將其分為莖段芽、混合芽、無花芽混合芽、葉芽四種(圖1A ~D)。 首先用洗潔精水清洗外植體2 min,然后將其置于燒杯中并用雙層紗布封口后用自來水沖洗30 min,最后在超凈工作臺中用75%酒精涮洗30 s→0.1%升汞涮洗(3、5、7)min→無菌水沖洗30 s→用濾紙吸干水分后接種于初代培養基(MS+1.5 mg/L 6-BA+0.1 mg/L NAA+0.4 mg/L GA3+30 g/L 蔗糖+7 g/L 瓊脂+2 g/L PVA,pH=6.0)中。 培養室條件:光照強度為4 000 lx,光照時間為16 h,溫度為24℃,下同。 30天時統計其成活率、污染率和褐變率。

圖1 四種外植體和兩種幼化程度的苗
1.2.2 中矮1 號組培苗繼代培養基篩選 切取初代培養30 天時長勢一致的1.5 cm 長莖尖,分別接種于表1 正交設計的①~⑨號繼代培養基(MS+30 g/L 蔗糖+7 g/L 瓊脂+2 g/L PVA+表1中的激素組合,pH =6.0)中。 每個處理接種20株,重復3 次,30 天時統計其增殖系數、芽長、苗高、葉片數、節間數和節間長度。
1.2.3 中矮1 號組培苗生根培養基篩選 生根培養采用兩步生根法,即第一步先切取繼代培養30 天時長勢一致且健壯的3.5 cm 長組培苗,分別接種于表2 正交設計的①~⑨號生根培養基(1/2 MS+15 g/L 蔗糖+7 g/L 瓊脂+2 g/L PVA+表2 中的生根調節物質組合,pH=6.0)中誘導7 天,其中前5 天進行暗培養,后續轉為全光照培養;第二步將誘導后的組培苗轉接至不含激素的培養基(1/2MS+15 g/L 蔗糖+7 g/L 瓊脂+2 g/L PVA,pH=6.0)中培養33 天。 每個處理接種20 株,重復3 次,40 天時統計其生根率、根數、根長和生根所需天數。
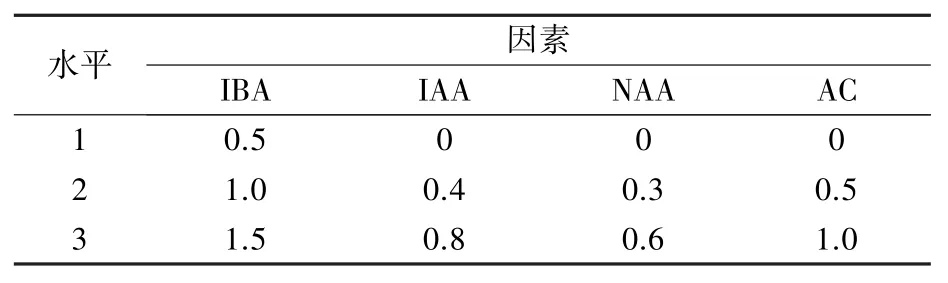
表2 生根培養基調節物質L9(34)正交試驗設計(mg/L)
1.2.4 光照對中矮1 號組培苗生根的影響 將組培苗接種于⑨號生根培養基(1/2MS +15 g/L蔗糖+7 g/L 瓊脂+2 g/L PVA+1.5 mg/L IBA+0.8 mg/L IAA+0.3 mg/L NAA,pH=6.0)后,分別在強光(4 000 lx)、弱光(無燈管直照處)、微光(開口箱子中)、黑暗(暗箱中)四種光照環境下培養5天,其它條件同上。 每個處理接種30 株,40 天時統計生根指標。
1.2.5 組培苗幼化程度對中矮1 號組培苗生根的影響 分別將剛完成繼代培養的幼嫩苗(圖1E)和經過一次生根培養但未生根的成熟苗(圖1F)接種于⑤號生根培養基(1/2MS +15 g/L 蔗糖+7 g/L 瓊脂+2 g/L PVA+1.0 mg/L IBA+0.4 mg/L IAA+0.6 mg/L NAA,pH=6.0)中,其它條件同上。 每個處理接種30 株,40 天時統計生根指標。
1.2.6 一步生根法對中矮1 號組培苗生根的影響 選取30 株組培苗使用一步生根法來進行生根培養,即全程在⑨號生根培養基中培養(前5天為暗培養),期間不更換培養基,40 天時統計生根指標。 以使用兩步生根法進行生根培養的組培苗為對照,比較二者生根過程中的差異。
1.3 指標計算及方法
褐化率(%)=外植體褐化數/外植體接種數×100;污染率(%)=外植體污染數/外植體接種數×100;成活率(%)=外植體成活數/外植體接種數×100。
增殖系數=增殖芽總數/接種株數;平均株高=苗干總高/接種株數;平均葉片數=完全展開的葉片總數/接種株數;平均芽長=增殖芽總長/接種株數。
生根率(%)=生根株數/接種株數×100;平均根數=總根數/生根株數;平均根長=總根長/總根數;平均生根天數=(生根日期-接種日期)/生根株數。
1.4 數據處理與分析
試驗數據用SPSS Statistics 25 進行方差分析,用Duncan’s 新復極差法進行多重比較,用Microsoft Excel 制圖。
2 結果與分析
2.1 中矮1 號外植體種類及消毒時間篩選結果
由表3 可以看出,0.1%升汞消毒3 min 時,葉芽成活率(91.7%)最高,其次為無花芽混合芽(44.4%);消毒5 min 時,無花芽混合芽成活率(34.5%)高于葉芽(25.8%);消毒7 min 時,只有無花芽混合芽成活,成活率為33.3%;三個消毒時段下莖段芽和混合芽均無成活株。除莖段芽,另外三種外植體的褐化率隨消毒時間延長而升高。無花芽混合芽和葉芽的成活率隨消毒時間的延長而下降。
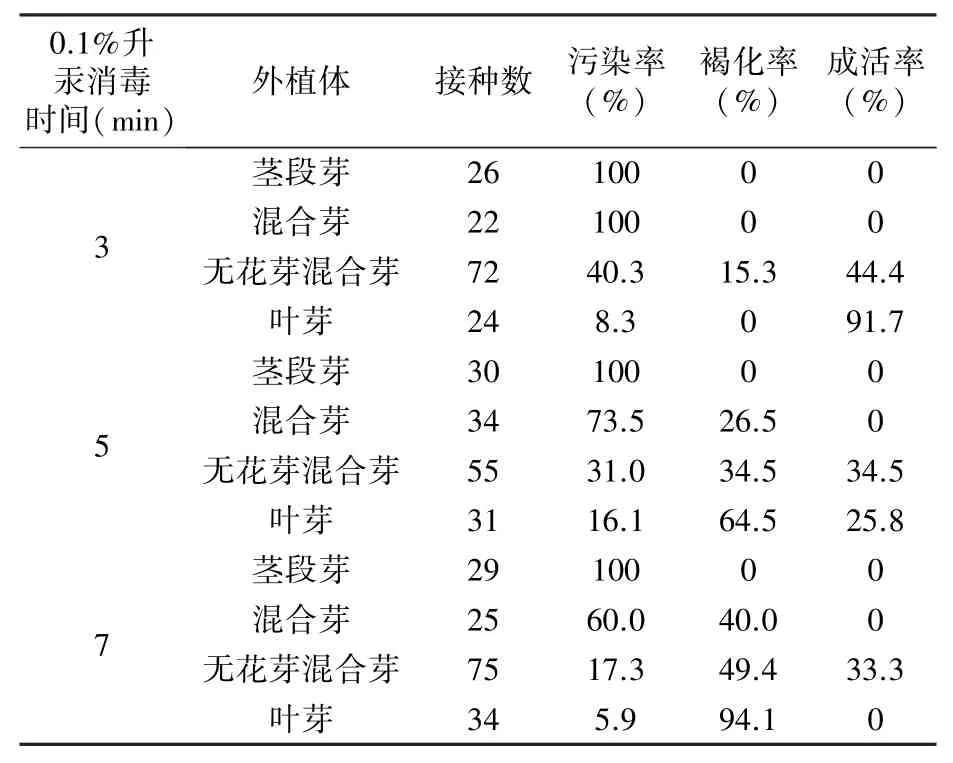
表3 不同消毒時間和外植體種類對外植體引入的影響
綜上,葉芽和無花芽混合芽較適合作為中矮1 號的外植體,引外植體時的最佳升汞消毒時間為3 min,總消毒時間為4 min。
2.2 中矮1 號組培苗繼代培養基篩選結果
圖2 顯示,⑦號繼代培養基(MS+30 g/L 蔗糖+7 g/L 瓊脂+2 g/L PVA+1.8 mg/L 6-BA+0.1 mg/L NAA+0.2 mg/L GA3,pH =6.0)組培苗的增殖系數(5.52)最高,顯著高于其它處理;⑥號培養基(MS+30 g/L 蔗糖+7 g/L 瓊脂+2 g/L PVA+1.4 mg/L 6-BA+0.2 mg/L IBA+0.1 mg/L NAA,pH =6.0)組培苗的平均芽長(1.15 cm)最長,9 個處理間無顯著差異;⑦號培養基組培苗的平均苗高(4.14 cm)最高,與⑧號培養基(MS+30 g/L 蔗糖+7 g/L瓊脂+2 g/L PVA +1.8 mg/L 6-BA +0.1 mg/L IBA+0.2 mg/L NAA,pH=6.0)無顯著差異,顯著高于其它處理;⑦號培養基組培苗的平均葉數(20.28 片)最多,與⑧號、⑨號培養基(MS+30 g/L蔗糖+7 g/L 瓊脂+2 g/L PVA+1.8 mg/L 6-BA+0.2 mg/L IBA+0.1 mg/L GA3,pH =6.0)無顯著差異,顯著多于其它處理;⑦號培養基組培苗的平均節間數(4.89 節)最多,與⑥號、⑨號培養基無顯著差異,顯著多于其它處理;⑤號培養基(MS+30 g/L 蔗糖+7 g/L 瓊脂+2 g/L PVA+1.4 mg/L 6-BA+0.1 mg/L IBA+0.2 mg/L GA3,pH =6.0)組培苗的平均節間長度(1.23 cm)最長,9 個處理間無顯著差異。
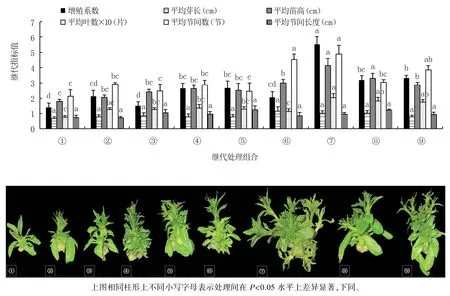
圖2 不同增殖激素組合對組培苗繼代培養的影響
極差分析結果(表4)表明,四種激素中6-BA對繼代增殖的影響最大,主要影響增殖系數、苗高、葉片數和節間數;NAA 主要影響芽長和節間長度;GA3對芽長、苗高和節間長度也有一定影響。 方差分析篩選出的最佳繼代培養基激素組合為:1.8 mg/L 6-BA +0.1 mg/L NAA +0.2 mg/L GA3,再結合圖2 的單因素分析結果認為,1.8 mg/L 6-BA+0.1 mg/L NAA+0.2 mg/L GA3為最佳繼代培養基激素組合。
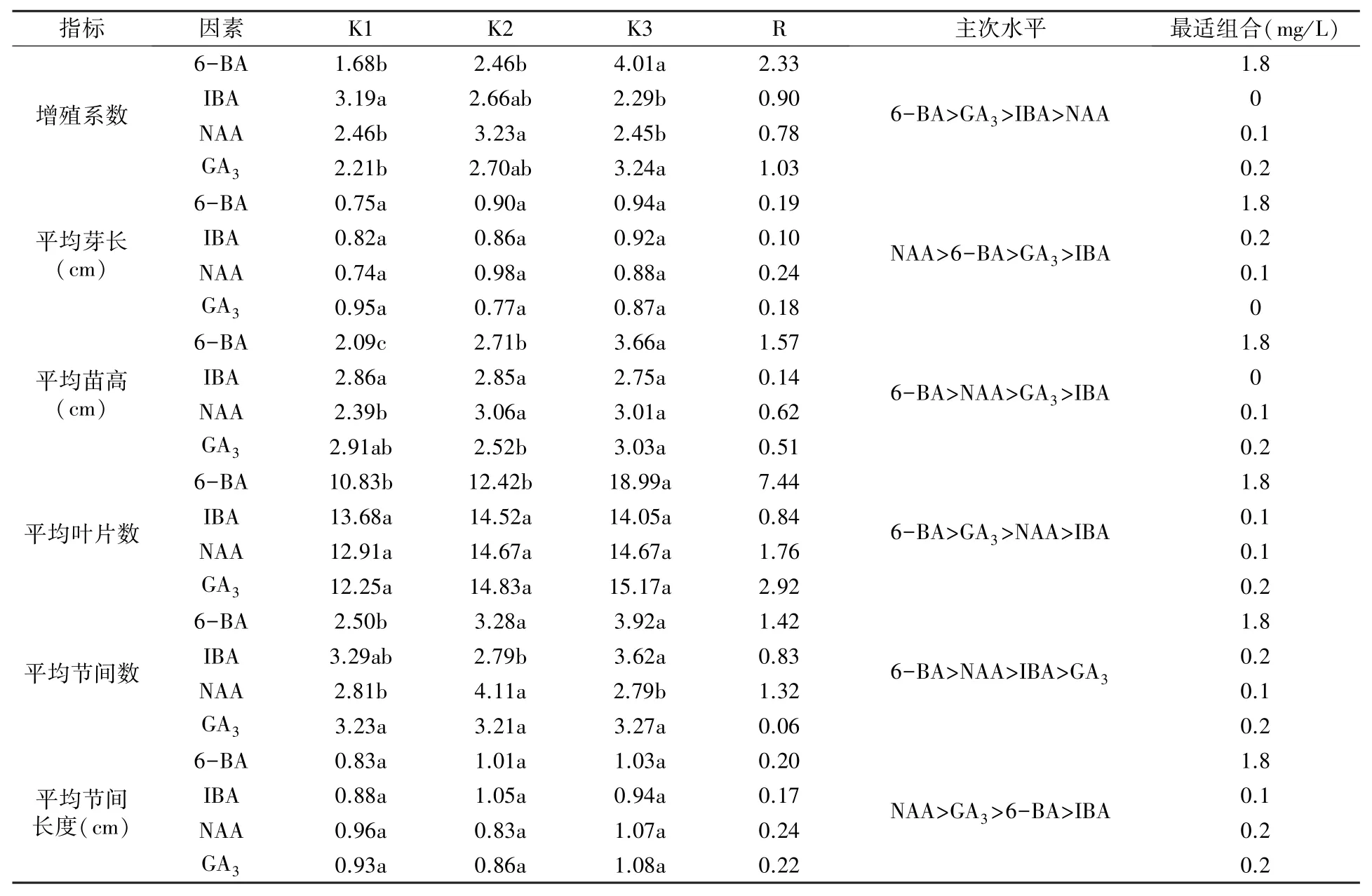
表4 增殖激素正交試驗的方差分析及極差分析
2.3 中矮1 號組培苗生根培養基篩選
圖3 顯示,⑤號生根培養基(1/2MS+15 g/L蔗糖+7 g/L 瓊脂+2 g/L PVA+1.0 mg/L IBA+0.4 mg/L IAA+0.6 mg/L NAA,pH =6.0)組培苗的生根率(72.22%)最高,顯著高于其它處理;⑨號培養基(1/2MS +15 g/L 蔗糖+7 g/L 瓊脂+2 g/L PVA+1.5 mg/L IBA +0.8 mg/L IAA +0.3 mg/L NAA,pH=6.0)組培苗的平均根數(5.36 條)最多,僅顯著多于②號培養基(1/2MS +15 g/L 蔗糖+7 g/L 瓊脂+2 g/L PVA+0.5 mg/L IBA+0.4 mg/L IAA +0.3 mg/L NAA +0.5 mg/L AC,pH =6.0),與其余7 個處理無顯著差異;⑨號培養基組培苗的平均根長(7.74 cm)最長,與⑤號培養基無顯著差異,顯著高于其它處理;⑨號培養基生根所需天數(13.65 天)最少,與①號(1/2MS+15 g/L蔗糖+7 g/L 瓊脂+2 g/L PVA +0.5 mg/L IBA,pH=6.0)、③號(1/2MS+15 g/L 蔗糖+7 g/L 瓊脂+2 g/L PVA+0.5 mg/L IBA+0.8 mg/L IAA+0.6 mg/L NAA+1.0 mg/L AC,pH=6.0)、④號(1/2MS+15 g/L蔗糖+7 g/L 瓊脂+2 g/L PVA+1.0 mg/L IBA+0.3 mg/L NAA+1.0 mg/L AC,pH =6.0)、⑤號培養基無顯著差異,顯著少于其它處理。
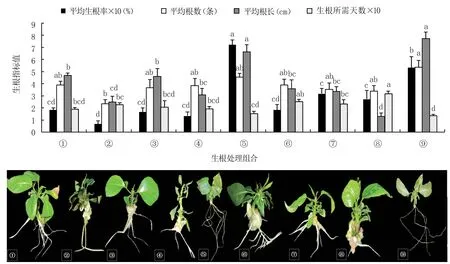
圖3 不同生根調節物質組合對組培苗生根的影響
極差分析結果(表5)表明,四種生根調節物質中AC 對組培苗生根的影響最大,為四項生根指標的最主要影響因素,高濃度的AC 會影響組培苗的生長狀態,可能造成組培苗葉片枯黃、頂梢發黑、基部不長愈傷;IBA 主要影響生根率;IAA 主要影響根數和根長;NAA 主要影響生根所需天數。 方差分析篩選出的最佳生根調節物質組合為:1.0 mg/L IBA+0.8 mg/L IAA+0.6 mg/L NAA,結合圖3 的單因素分析結果認為,1.0 mg/L IBA+0.4 mg/L IAA+0.6 mg/L NAA 為最佳生根調節物質組合。
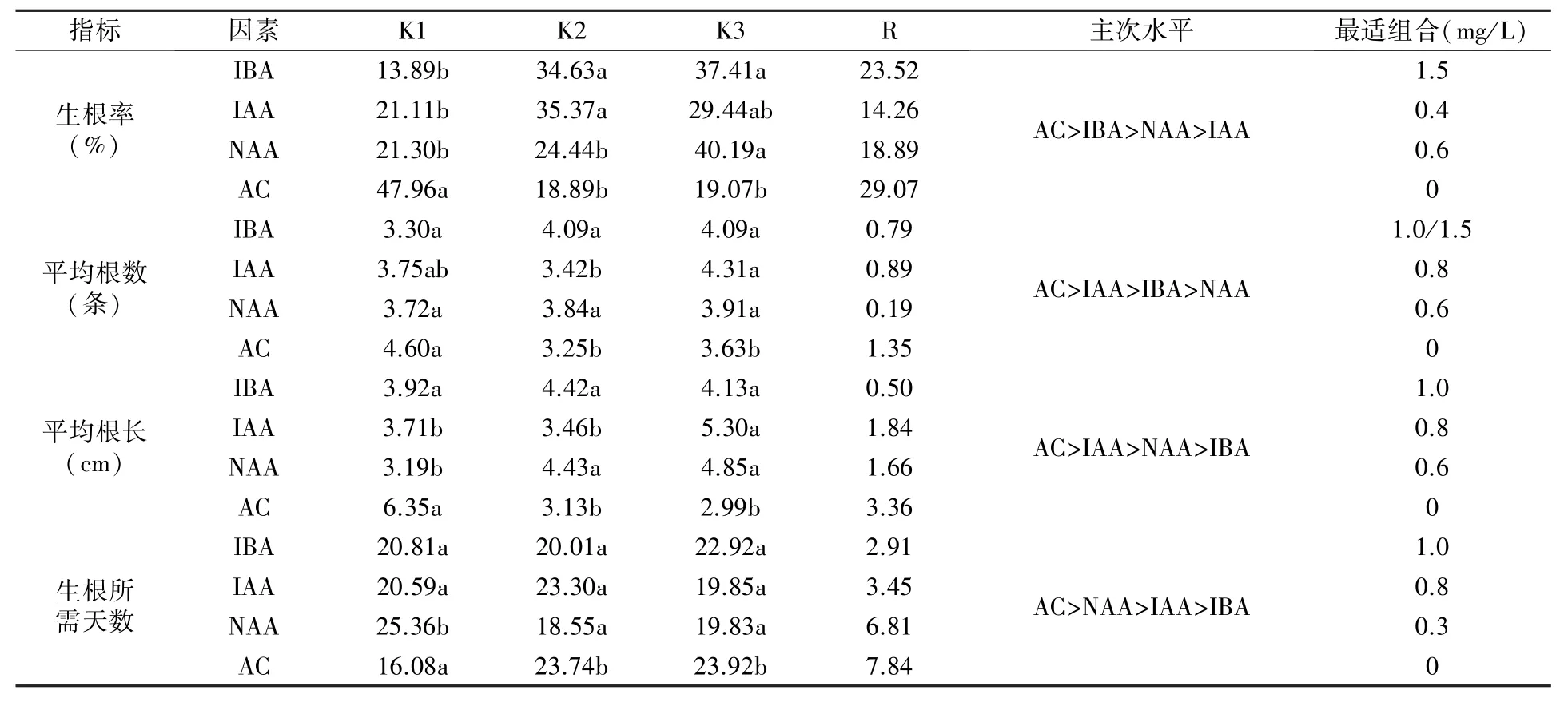
表5 生根調節物質正交試驗的方差分析及極差分析
2.4 光強對中矮1 號組培苗生根的影響
由圖4 可以看出,組培苗生根培養前期暗培養5 天的平均生根率(60.00%)最高,顯著高于其它處理,強光培養的生根率(6.67%)最低;微光培養組培苗的平均根數(4.40 條)最多,暗培養(3.67條)其次,4 個處理間無顯著差異;暗培養組培苗的平均根長(5.55 cm)最長,與微光和弱光培養無顯著差異,顯著長于強光培養。 表明,4 個處理在各自光照強度下培養5 天,其愈傷生成速率隨光照強度的減弱而增加,暗培養下愈傷組織的生成量最多,強光培養則幾乎不產生愈傷。
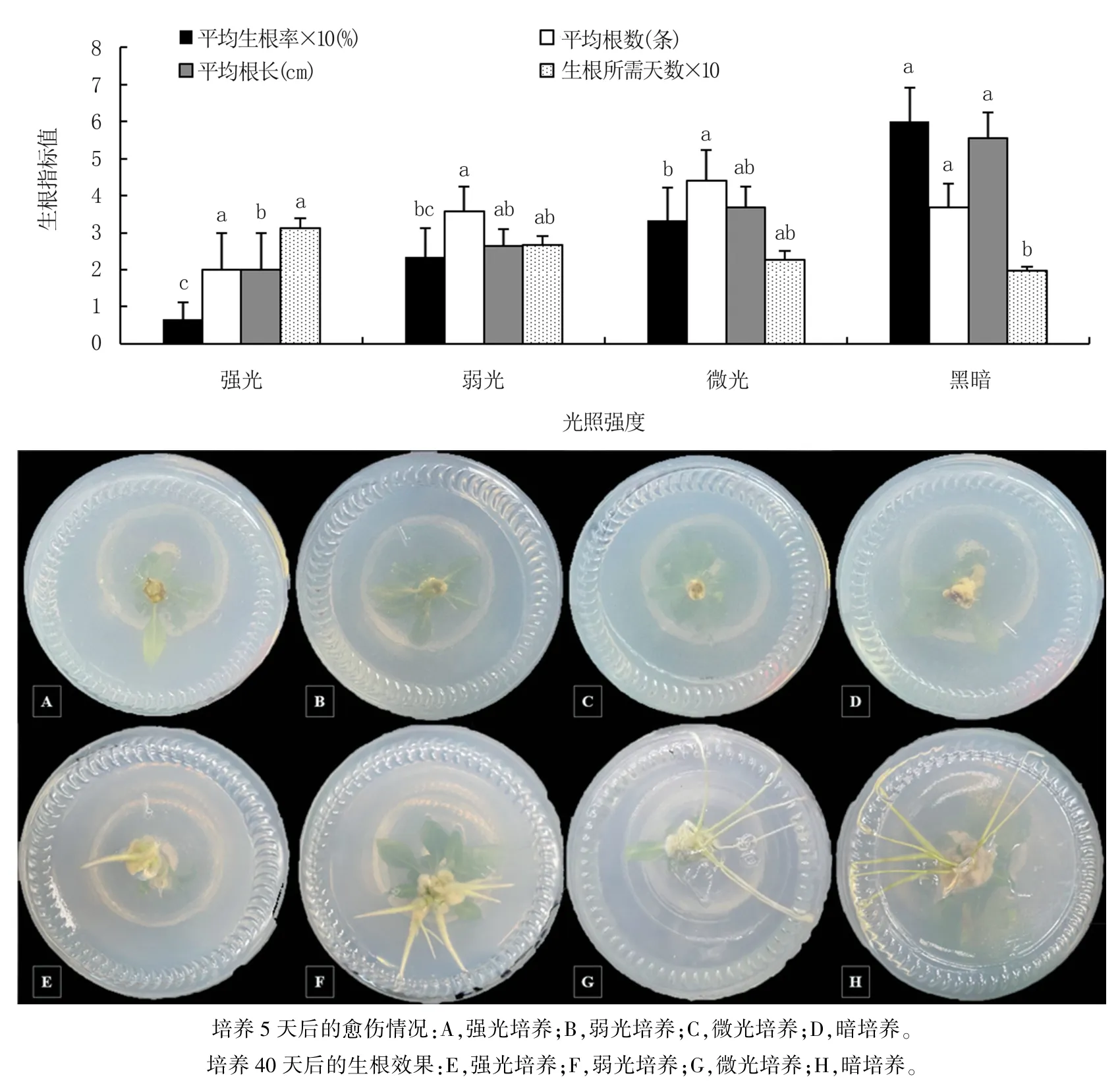
圖4 不同光強對組培苗生根的影響
4 個處理生根培養40 天后,總體的生根效果隨光照的減弱而變好,強光培養組培苗的生根效果較差,根數少且短粗,暗培養的生根質量較好,根數多且細長。
綜上,生根培養前期暗培養5 天更有益于中矮1 號組培苗生根。
2.5 苗幼化程度對中矮1 號組培苗生根的影響
由表6 可以看出,幼嫩苗的生根率、平均根數、平均根長都要高于成熟苗,生根速度也更快。幼嫩苗莖段基部的愈傷組織大小適中,根系細軟(圖5A),而成熟苗的愈傷組織則較小,根系粗硬(圖5B)。 綜上,繼代培養40 天的幼嫩苗生根效果更好。
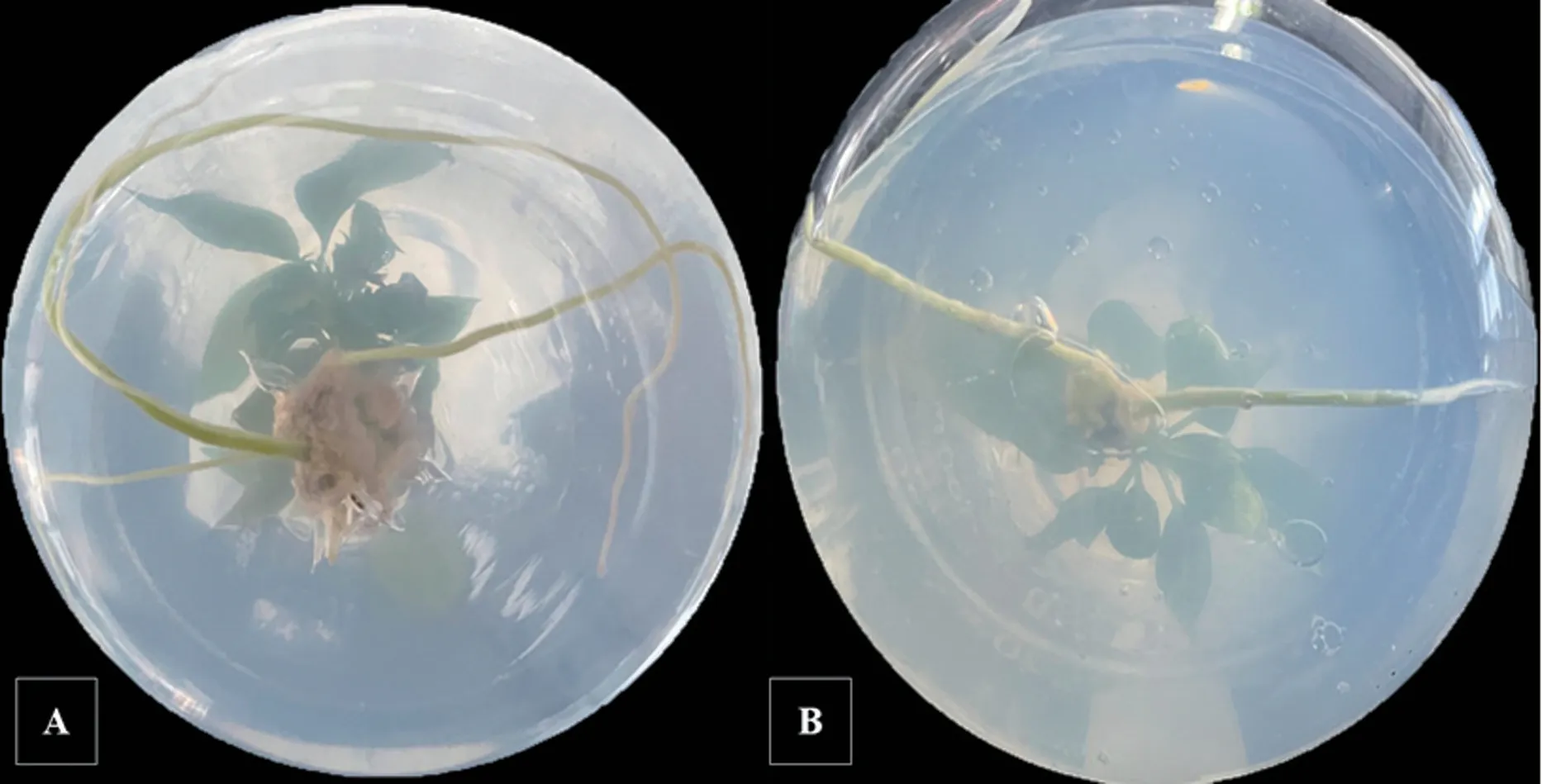
圖5 幼嫩苗(A)和成熟苗(B)的生根效果對比
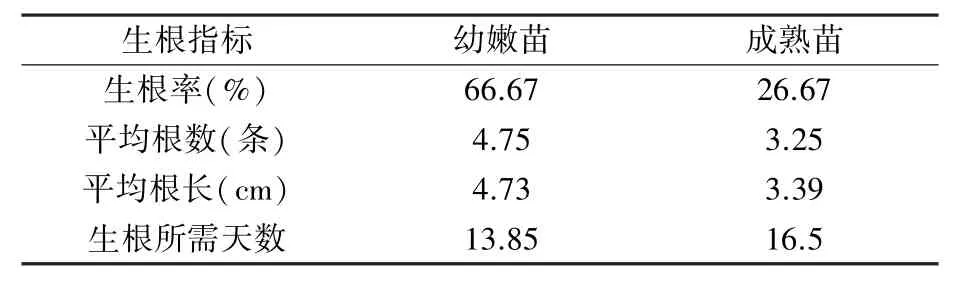
表6 幼嫩苗和成熟苗的生根指標對比
2.6 一步生根法對中矮1 號組培苗生根的影響
圖6 A 顯示,組培苗用一步生根法生根培養后的愈傷組織生成量極大,生長狀態較差,出現苗細弱、葉焦邊、枯尖等現象,沒有出現生根苗。 兩步生根法的組培苗愈傷組織大小正常,苗健康粗壯,根系狀態較好(圖6B)。 所以兩步生根法更適合中矮1 號的生根培養。

圖6 一步生根苗(A)和兩步生根苗(B)的生根效果對比
3 討論與結論
外植體的高效引入是建立組培快繁技術的關鍵,外植體種類和滅菌方法的選擇將直接影響其成活率。 本試驗采用的外植體為早春時溫室中水培萌發的嫩梢,其本身攜帶的病菌、酚類物質較少,酶活性較弱,所以污染率、褐變率不高[6,10]。本試驗用于篩選的四種外植體中,混合芽多在花芽和花穗處滋生真菌,莖段芽則在莖部滋生真菌,二者與葉芽、無花芽混合芽相比滅菌難度較大,滅菌時間難以把握。 如果滅菌時間過長,植物細胞會受到傷害,導致生長點死亡,褐化率增高;滅菌時間太短,外源菌無法被完全消滅,導致污染率增高[4,7]。 因此合理的滅菌時間將直接關系到外植體的成活。
植物激素是促進植物組織分化的重要調節物質,不同的激素組合及濃度配比可能會刺激不同基因控制的酶類,從而影響內源激素的分布水平,進而影響不定芽的增殖效果和植株的生長狀態,因此篩選適宜的激素組合是建立組培快繁技術的關鍵[4,10,11]。 6-BA 可促使腋芽萌發和抑制頂端優勢,對組培苗增殖的影響最大,但當其濃度超過2.0 mg/L 時會加劇組培苗的玻璃化,抑制芽和莖的伸長[1,12,13];低濃度的GA3可促進植物細胞分裂和伸長,進而影響組培苗的增殖數和苗高[14];低濃度的NAA 能促進莖干上腋芽的分生,且對苗高起一定的主導作用[15,16]。 本研究結果與以上論述相一致。 前人研究中,蔡猛[17]篩選的中矮1號繼代培養基(MS+1.0 mg/L 6-BA +0.3 mg/L IBA+30 g/L 蔗糖+6 g/L 瓊脂)的增殖系數為3.38;及華等[18]篩選的繼代培養基(MS+1.0 mg/L 6-BA+0.2 mg/L IBA+0.1 mg/L GA3+20 g/L 蔗糖+6.5 g/L 瓊脂)的增殖系數為3.4;羅婭等[19]篩選的繼代培養基(MS +3.0 mg/L BA +0.2 mg/L IBA+2.0 mg/L GA3+30 g/L 蔗糖+6 g/L 瓊脂)的增殖系數為3.88。 本試驗篩選出的繼代培養基的平均增殖系數為5.52,較前人研究結果有明顯提高,且組培苗繼代30 天的平均苗高可達4.14 cm。高壯苗可以更早地進行后續的生根培養,從而加速育苗進程。
生長素的種類及濃度是影響組培苗生根的關鍵因素[20]。 首先,對于生根困難的果樹材料,兩步生根法要好于一步生根法,其原因可能為根原基誘導、根和莖的生長對生長素的需求濃度不同,根原基的形成需要在高濃度生長素下進行誘導,而根的生長發育階段,高濃度的生長素反而會抑制幼根生長[21-23];一步生根法較省時省力,可降低移瓶過程中組培苗污染的可能性,但組培苗的莖段基部易生成大團愈傷組織,不利于其誘導生根和移栽成活。 其次,組培苗在混合生長素下培養其生根效果要好于單一生長素:IBA 可以誘發根原基形成,促進內源激素IAA 的運輸,可在輔酶作用下轉化成IAA 來發揮作用[7];羅嘉亮等[8]認為IBA 的生根誘導效果最佳,但李曉剛[12]和方明[9]等認為IBA 對組培苗的生根無顯著性影響;IAA 是影響不定根形成的重要因子,但其易被氧化酶氧化,性質不穩定且作用持續的時間較短[8];NAA 可以促進組培苗儲存的淀粉水解為還原糖,有利于不定根的形成,但高濃度NAA 會使組培苗基部產生較大的愈傷,誘導出的根較粗短,不利于移栽成活[8,23,24];活性炭(AC)可以吸附某些有害物質,為組培苗提供暗環境,提高組培苗的可溶性蛋白和總糖含量,從而有利于根的誘導和根系生長,但活性炭濃度太高時則可能減少愈傷組織的生成,吸附大部分的生長調節物質及對生根有利的物質,從而抑制根的發生[24]。 欒曉龍等[25]在生根培養基中添加1.0 g/L AC,顯著提高山梨的生根率和生根條數;王宏偉等[15]研究表明豆梨組培苗的增殖系數和株高隨著活性炭濃度的提高而降低;劉翠瓊[26]試驗表明0.5 g/L AC 可提高巴梨的生根率,1.0 g/L AC 則會起到抑制作用。本研究表明,AC 對組培苗生根的影響最大,0.5、1.0 g/L AC 均對中矮1 號的生根起明顯抑制作用;IBA 主要影響生根率;IAA 主要影響根數和根長;NAA 主要影響生根所需天數。 前人研究中,蔡猛[17]篩選的中矮1 號生根培養基(1/2MS+0.1 mg/L NAA+30 g/L 蔗糖+7 g/L 瓊脂)的生根率為50.1%,平均根數為2.99 條;羅婭等[19]篩選的培養基(1/2QL+5.0 mg/L IBA+5.0 g/L 蔗糖上暗培養10 d→1/2QL+5.0 g/L 蔗糖+0.5 g/L AC)為67%,平均根數為1.5 條;及華[27]篩選的培養基(ASH+2.0 mg/L IBA+20 g/L 蔗糖+6.5 g/L 瓊脂上暗培養7 ~9 d→ASH+蛭石+20 g/L 蔗糖+6.5 g/L 瓊脂)為70%,平均根數為3 條。 本試驗優選出的生根培養基其生根率為72.22%,平均根數為5.36 條,明顯多于前人研究中的誘導結果,生根效果較好。
暗培養時間、光強、苗的幼化程度等也是影響組培苗生根的重要因素。 暗培養時間受組培苗生長狀態、繼代次數和培養環境等因素影響,合適的時間有助于組培苗根的形成,但時間過長易造成組培苗細弱、葉焦邊、枯尖等現象[23,26]。 培養時的光強不同,生根效果也有很大差異。 本試驗中,光強越弱,生根越早,根系質量越好。 分析其原因可能是,暗環境更有利于根原基的誘導,更早的形成愈傷組織。 本研究認為,中矮1 號組培苗的生根能力還與其幼化程度有關,與成熟組織相比,幼齡組織和過渡態組織具有更強的再生能力,因為其細胞具有強大的分裂能力,這是根原基形成的前提條件[27]。
綜之,本試驗通過對梨矮化砧木中矮1 號組培快繁影響因素的研究而建立的離體快繁技術為:以中矮1 號一年生枝條水培萌發的葉芽或無花芽混合芽為外植體,采取75%酒精30 s→0.1%升汞3 min→無菌水30 s 的消毒方式進行滅菌,然后接種于啟動培養基(MS +30 g/L 蔗糖+1.5 mg/L 6-BA+0.1 mg/L NAA+0.4 mg/L GA3+7 g/L瓊脂,pH =6.0)上;30 天時轉接入繼代培養基(MS+30 g/L 蔗糖+1.8 mg/L 6-BA +0.1 mg/L NAA+0.2 mg/L GA3+7 g/L 瓊脂,pH =6.0)上增殖培養,增殖系數可達5.52;30 天時轉接入生根培養基(1/2 MS+15 g/L 蔗糖+1.0 mg/L IBA+0.4 mg/L IAA+0.6 mg/L NAA+7 g/L 瓊脂,pH =6.0)上培養7 天(前5 天為暗培養),再轉入無激素培養基中,最終生根率可達72.22%。

