Wnt/β-catenin通路在新北美圣草苷促進BMSCs成骨分化中的介導作用*
曾文叢 曾芳俊 何 偉
江西省贛州市人民醫院脊柱外科 341000
骨質疏松癥是臨床中老年人和絕經后女性的常見病癥,以骨組織微結構改變、骨量減少為主要特征,進而引起骨骼脆性增加、強度下降,是一種系統性代謝骨病。骨髓間充質干細胞(Bone Marrow Mesenchymal Stem Cells,BMSCs)具有多向分化能力,可以定向分化為神經元、成骨細胞、軟骨細胞及脂肪細胞等,研究證實,BMSCs所分化的成骨細胞在骨組織形成、維持和重建等過程中發揮關鍵作用,骨質疏松癥的發生發展與BMSCs分化失衡關系密切[1]。BMSCs成骨分化過程受到多個通路調節,如MAPKK通路、Wnt/β-catenin通路、Notch通路及RANKL/RANK/OPG通路等,而經典Wnt/β-catenin通路已被證實是BMSCs成骨分化的關鍵通路[2-3]。骨碎補取自蕨類植物槲蕨的根莖,是骨科中常用的中藥,具有補腰腎強筋骨、止痛續傷的作用,可有效緩解骨質疏松癥狀[4],但具體作用機制尚無明確闡述。新北美圣草苷(Neoeriocitrin)是骨碎補的主要成分之一。本研究采用體外培養的研究方法,以BMSCs作為靶細胞,探討新北美圣草苷調節其成骨分化的作用機制。
1 材料與方法
1.1 實驗動物與試劑器材
1.1.1 實驗動物:選取SPF級3月齡大鼠30只,體重(200±20)g,購于濟南朋悅實驗動物繁育有限公司,批號:SCXK(魯)20140007。
1.1.2 主要實驗藥品、試劑及實驗器材:骨碎補購于中藥房;南美胎牛血清(Hy-Clone,批號:NZJ1221);堿性磷酸酶染液(南京建生成物,批號:20160818);β-甘油磷酸鈉(上海源葉生物,批號:S20S7G21494);堿性磷酸酶檢測試劑盒(南京建成生物,批號:20160813);大鼠β-catenin ELISA kit(武漢基因美,批號GR201612-1);Transcriptor Frist Strand cDNA Synthesis Kit(Roche,批號13713422);逆轉錄試劑盒(大連寶生物)。高速冷凍離心機(Neofuge23R,上海力康);顯微鏡(OLYMPUS/IX71,日本奧林巴斯);酶聯免疫儀(Biotek Elx800,美國伯騰);CO2培養箱(HF160W,上海力康);恒溫水浴鍋(HH-2,江蘇金壇榮華);流式細胞儀(BD FACSVERSE,美國);超潔凈工作臺(SW-CJ-2FD,上海博訊實業)。
1.2 實驗方法
1.2.1 新北美圣草苷含藥血清制備:依據成人患者每日所進藥量換算得出大鼠用藥量,采用水煎法將骨碎補藥液濃縮,儲存于4℃備用,使用前恢復至室溫。將大鼠依照隨機數字表法隨機分為對照組、低劑量組、高劑量組,每組10只大鼠。每日早8點和下午2點進行灌胃處置,劑量如下:低劑量組灌服0.81g/kg骨碎補水煎液,高劑量組灌服4.05g/kg骨碎補水煎液,對照組灌服等體積生理鹽水。連續灌胃干預3d。末次灌胃1.5h后,取大鼠腹主動脈血,以4℃、2 500r/min離心20min后,取上層清液,經56℃水浴滅活后過濾,-20℃保存備用。
1.2.2 BMSCs培養與擴增:選用全脊髓貼壁法制備BMSCs:將大鼠麻醉后,于75%乙醇溶液內浸泡10min,于超潔凈工作臺上分離大鼠股骨,繼續置于75%乙醇溶液中浸泡20s后,取出股骨干骺端。隨后以100kU/L青霉素、鏈霉素合并10%胎牛血清與L-DMEM培養基反復沖洗大鼠股骨髓腔至股骨表面微亮。將髓腔沖洗液收集后置于25ml培養瓶內,放入5%CO2培養箱,37℃繼續培養。24h后換液1次,隨后每2d換液1次。當80%以上細胞融合后,選取0.25%胰蛋白酶進行消化,依照1∶3進行傳代培養。選取第三代生長較好的細胞,應用流式細胞儀對所培育細胞表面抗原進行檢測,確定其免疫表型。
1.2.3 細胞分組及給藥:將細胞分為對照組、低劑量組、高劑量組。低劑量組細胞給予L-DMEM、成骨分化誘導液和10%低劑量含藥血清;高劑量組細胞給予L-DMEM、成骨分化誘導液和10%高劑量含藥血清;對照組細胞給予L-DMEM、100kU/L青霉素和100kU/L鏈霉素,成骨分化誘導液及10%胎牛血清培養基。連續干預10d。
1.3 實驗指標
1.3.1 BMSCs的鑒定:研究證實,BMSCs表面抗原標記對CD34、CD45等陰性反應,對CD29、CD104、CD44等陽性反應。選用0.25%胰蛋白酶消化細胞后,制備單細胞懸液,以1 500r/min離心3min后進行PBS重懸,細胞濃度為2×105/ml。PBS沖洗2次后,取400μl細胞懸液,加入PE、APC、FITC標記的抗體,隨后避光條件下孵育40min,再以PBS沖洗1次,以流式細胞儀進行檢測。
1.3.2 細胞增殖水平比較:選取第三代生長良好的細胞,制備為單細胞懸液,以1×104/mm接種于96孔培養板,每孔滴入100μl細胞懸液。各組設置6個復孔,加入各組對應的培養基,隨后置于5%CO2培養箱,37℃繼續培養。于培養的第3、5、7、9天取出板進行檢測。向每孔內滴加10μl CCK-8,37℃條件下孵育4h。在酶標儀中選取490nm波長,檢測各孔吸光度(A)。各組細胞增殖水平以A490吸光度值表示。
1.3.3 BMSCs礦化能力比較:將第三代BMSCs接種于6孔板上,各組設置3個復孔。待培養至21d時,去掉培養液以PBS沖洗,使用95%乙醇溶液將細胞固定30min,隨后以0.2%茜素紅染色30min,以清水沖洗。將細胞置于40倍光鏡下觀察拍照,并計算各組的礦化結節數量。
1.3.4 成骨相關mRNA及Wnt/β-catenin通路相關mRNA表達水平比較: 將BMSCs以1×104/ml接種于6孔板內,待瓶底80%以上被細胞鋪滿時,分別加入各自的培養液繼續培養,每2d進行1次換液。培養7d后,提取各組細胞總RNA,選用光度計檢測RNA純度在1.8~2.2范圍內則認為總RNA純度較好,可用于后續檢測,置于-80℃冰箱內保存備用。參考逆轉錄試劑盒說明書進行操作,于冰上加入4μl 5×Primescript buffer,Oligo dT primer、Primescript RT Enzyme mix I、Random 6 mers各1μl,1μg總RNA,隨后滴加RNase Free ddH2O至20μl,反應體系即配置成功。隨后進行反轉錄:37℃ 15min,85℃ 5s,4℃條件下保存。參照試劑盒操作步驟說明進行操作,反應條件:95℃ 5min,95℃ 20s,62℃ 15s,72℃ 15s,72℃ 5min,其中后4個步驟循環45次。檢測mRNA的表達情況,由程序生成標準曲線,記錄CT值,并計算各組mRNA/空白組mRNA倍數。RT-PCR引物由生工生物工程公司合成,引物序列詳見表1。

表1 引物基因序列
1.3.5 β-catenin蛋白、Lrp-5蛋白水平比較:各組取培養7d的BMSCs細胞,每組取6孔,依照下方操作步驟提取總蛋白:胰蛋白酶消化細胞,4℃ 1 500r/min 離心5min,隨后以PBS沖洗3次,估算細胞總體積。將樣本置于冰面,加入RIPA裂解液后,反應30min。4℃ 12 000r/min 離心10min,取上層清液,依據試劑盒操作步驟檢測β-catenin蛋白及LRP蛋白表達水平。
1.4 統計學方法 選用SPSS20.0軟件對數據進行統計學分析,計量資料以均數±標準差表示,采用單因素方差分析。以P<0.05表示差異具有統計學意義。
2 結果
2.1 BMSCs形態及表型鑒定 接種初,其他細胞與BMSCs混雜,細胞呈圓形。24h后細胞開始貼壁生長,呈紡錘狀,細胞數目較少。48h后可見部分細胞呈短梭形,有偽足(見圖1a)。3d后貼壁細胞數量增加同時體積增大,細胞逐漸伸展為多角形、梭形,成簇生長(見圖1b)。8d左右出現相互融合。10d左右細胞融合狀態可達80%以上(圖1c)。流式細胞儀檢測結果顯示,表面CD44、CD29、CD45陽性細胞比例分別為95.30%、94.25%、0.40%,結合形態觀察結果可以確認所培養細胞為BMSCs。

圖1 BMSCs形態學觀察
2.2 各組BMSCs細胞增殖水平比較 與對照組相比,給藥兩組各時間點吸光度值明顯增加,差異具有統計學意義(P<0.05);同時與低劑量組相比,高劑量組在各時間點吸光度值均明顯升高,差異具有統計學意義(P<0.05);低劑量組、高劑量組在3~5d的促增殖作用更明顯。詳見表2。
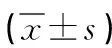
表2 各組BMSCs細胞增殖水平比較
2.3 各組BMSCs礦化能力比較 在干預21d后,各組BMSCs均形成礦化結節。經茜素紅染色后表現為大小不等的紅色致密結節。三組礦化結節數量顯示:高劑量組(15.35±4.10)>低劑量組(11.24±2.61)>對照組(5.33±1.21),差異具有統計學意義(P<0.05)。
2.4 各組β-catenin、Lrp-5、Osterix、RUNX-2、Gsk-3β mRNA表達水平比較 干預7d后,給藥兩組的GSK-3β mRNA表達明顯低于對照組,且高劑量組低于低劑量組;β-catenin、Lrp-5、Osterix、RUNX-2 mRNA表達明顯高于對照組,且高劑量組高于低劑量組,差異具有統計學意義(P<0.05)。詳見表3。
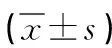
表3 各組β-catenin、Lrp-5、Osterix、RUNX-2、Gsk-3β mRNA表達水平比較
2.5 各組β-catenin蛋白、Lrp-5蛋白水平比較 干預7d后,給藥兩組的β-catenin蛋白、Lrp-5蛋白水平明顯高于對照組,且高劑量組高于低劑量組,差異具有統計學意義(P<0.05)。詳見表4、圖2。

圖2 β-catenin、Lrp-5蛋白的表達

表4 各組β-catenin蛋白、Lrp-5蛋白水平比較
3 討論
骨質疏松是引起中老年人骨折的主要原因之一,嚴重影響患者的日常生活,且增加社會醫療負擔[3]。人體骨骼的細胞成分主要為骨細胞,約占細胞總數的90%。骨細胞具有內分泌功能和傳導功能,同時可以感受機械刺激并轉化為生物信號,對外界變化的力學環境產生適應性變化,調控成骨細胞和破骨細胞動態平衡,進行骨骼重建[2,5]。
骨質疏松癥在傳統醫學中被歸入“痿病”“虛勞”“骨痿”等證的范疇,中醫理論認為,骨生長發育狀態與腎精充沛與否關系密切[6-7]。《黃帝內經》有“腎者,主骨生髓”以及“腎氣熱,則腰脊不舉,骨枯而髓減”等論述,提示本病的病位主要在腎,故當以補腰腎強筋骨論治。以干細胞為理論基礎的骨再生技術近年來成為骨缺損和骨質疏松癥等多種骨科疾病的熱點技術,其中促進干細胞成骨分化及自我更新是該治療技術的核心[8-9]。
骨碎補是補腎壯骨類中藥,相關體外研究證實[10],骨碎補對BMSCs有促進增殖和促進成骨分化的作用,新北美圣草苷正是其主要成分。故本研究中以BMSCs為靶細胞,探究新北美圣草苷促進其成骨分化的具體作用機制。
BMSCs經誘導可分化為脂肪細胞、軟骨細胞、成骨細胞等,其成骨分化在骨組織的維持與重建中發揮重要作用[11]。本研究結果顯示,低劑量組與高劑量組細胞吸光度明顯高于對照組,提示含藥血清可明顯促進BMSCs的增殖作用,且3~5d時作用較明顯,7~9d時增殖速度較緩慢可能與培養器材的限制相關,細胞密度達到了一定值。而劉偉等研究發現高濃度骨碎補提取物可產生抑制作用甚至毒副作用,在后續實驗中可增加更高濃度組進行研究。同時給藥兩組的礦化結節數量明顯高于對照組,高劑量組高于低劑量組,提示高濃度含藥血清可有效促進BMSCs向礦化細胞及成骨細胞分化。
BMSCs成骨分化受多條通路的調控,其中經典Wnt/β-catenin通路發揮關鍵作用。β-catenin是經典Wnt/β-catenin通路的關鍵因子,其濃度與Wnt通路是否激活關系密切,同時其在細胞定性分化和細胞增殖中也起到關鍵作用[12-13]。當Wnt蛋白與Lrp-5/6及Frizzled受體結合后,細胞內散落蛋白被激活并激活下游GSK-3β的結合蛋白,而GSK-3β的結合蛋白可以下調β-catenin被GSK-3β的磷酸化程度,進而調控目標基因的表達[14]。RUNX2可以通過增加Ⅰ型膠原、骨橋蛋白及骨鈣素等相關基因的轉錄進而促進BMSCs的成骨分化,其下游因子Osterix也是調控BMSCs成骨分化的重要因子[15-16]。本研究結果顯示,BMSCs經誘導后,GSK-3β mRNA表達下調同時β-catenin、Lrp-5、Osterix、RUNX-2 mRNA上調,而β-catenin蛋白、Lrp-5蛋白水平均升高,且高劑量組優于低劑量組,提示含藥血清能夠調控Wnt/β-catenin通路相關蛋白及mRNA表達,進而促進BMSCs成骨分化。
綜上所述,新北美圣草苷可以促進BMSCs的成骨分化及細胞增殖,可能與激活Wnt/β-catenin通路,下調GSK-3β mRNA表達,同時上調β-catenin、Lrp-5、Osterix、RUNX-2 mRNA,提高β-catenin蛋白、Lrp-5蛋白水平相關。

