呋喹替尼聯合PD-1抑制劑四線治療晚期結直腸癌的療效觀察
解燕茹 山西省稷山縣人民醫院腫瘤科 043200
結直腸癌(Colorectal cancer,CRC)是常見的消化道惡性腫瘤,發病率在我國惡性腫瘤中居第4位,死亡率居第5位[1],超過50%的患者就診時,已到Ⅲ~Ⅳ期,5年存活率不及40%[2]。近年來,隨著靶向新藥的不斷研發,一二線化療聯合貝伐珠單抗、西妥昔單抗,以及三線的呋喹替尼、瑞戈非尼,使晚期轉移性結直腸癌(metastatic colorectal cancer,mCRC)患者的中位總生存已超過30個月[3]。免疫治療在多種實體瘤的療效均得到證實,已成為臨床研究的熱點,尤其在錯配基因修復缺失(dMMR)/高度微衛星不穩定性(MSI-H)mCRC中,不論KRAS、BRAF基因狀態,也不論腫瘤部位(左半或右半),免疫檢查點抑制劑已獲批一線治療dMMR/MSI-H mCRC的適應證,為晚期轉移性結直腸癌的治療錦上添花,使更多的患者有接受四線甚至更多線治療的機會。但錯配修復功能完整(pMMR)/微衛星穩定(MSS)患者未能從免疫治療中獲益,本文采用呋喹替尼聯合PD-1抑制劑,四線治療pMMR/MSS mCRC患者,取得較好臨床療效,現報道如下。
1 資料與方法
1.1 一般資料 選取2020年1月—2022年4月我院收治的三線治療失敗后晚期轉移性結直腸癌患者30例,隨機分為觀察組和對照組,各15例。納入標準:有明確的病理證實為大腸癌,且免疫組化為pMMR/MSS;既往曾接受三線呋喹替尼治療失敗進展者;無腦轉移;體能狀態PS評分≤2分;至少有1個可測量靶病灶。排除標準:既往前線曾接受免疫檢查點抑制劑;有嚴重臟器功能不全者;dMMR/MSI-H者;有自身免疫性疾病者。其中觀察組男6例,女9例,年齡35~75(58.87±19.34)歲;對照組男8例,女7例,年齡40~80(59.93±10.86)歲。兩組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。
1.2 治療方法 觀察組給予口服呋喹替尼聯合PD-1單抗,呋喹替尼(愛優特,和記黃埔醫藥蘇州有限公司,規格1mg×21片)3mg qd連續服用21d,停藥7d。PD-1單抗:使用信迪利單抗(達伯舒,信達生物制藥蘇州有限公司,規格100mg)9例,卡瑞利珠單抗(艾瑞卡,蘇州盛迪亞生物醫藥有限公司,規格200mg)6例。具體用法為:0.9%氯化鈉100ml+信迪利單抗/卡瑞利珠單抗200mg,緩慢靜滴,至少30min以上,口服呋喹替尼第1天靜滴,q28d。對照組予止疼、營養支持、對癥治療。治療4個周期后復查評價。
1.3 觀察指標 (1)近期療效評價:根據WHO實體瘤客觀判定標準進行評定。完全緩解(CR):所有病灶完全消失,至少維持4周;部分緩解(PR):病灶最大直徑總和減小≥30%,至少維持4周;疾病穩定(SD):病灶最大直徑總和減小未達PR,或增加未達PD;疾病進展(PD):病灶最大徑直徑總和增加≥20%或出現新的病灶。疾病控制率(DCR)=(CR+PR+SD)/(CR+PR+SD+PD)×100%。(2)于治療前和治療4個周期后,測定兩組患者免疫功能,觀察CD3+CD4%、CD3+CD8% 、CD4/CD8。檢測方法:空腹抽取患者2ml外周血于EDTA抗凝管,采用直接熒光標記法測定全血淋巴細胞亞群水平,使用流式細胞儀(廠家:青島瑞斯凱爾生物科技有限公司,型號:RasieCyte 2L6C)進行檢測。(3)不良反應:采用抗腫瘤藥物不良反應評價標準進行評定,比較兩組患者高血壓、蛋白尿、甲狀腺功能(甲功)異常、手足皮膚反應、發熱情況。
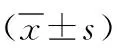
2 結果
2.1 兩組患者近期臨床療效比較 觀察組DCR為46.67%,高于對照組的13.33%,差異有統計學意義(χ2=5.136,P=0.023<0.05)。見表1。

表1 兩組近期療效比較[n(%)]
2.2 兩組患者血清免疫功能指標比較 治療前兩組患者血清CD3+CD4%、CD3+CD8%、CD4/CD8水平比較,差異均無統計學意義(P>0.05)。治療4個周期后,觀察組患者CD3+CD4%、CD4/CD8水平較治療前明顯升高,CD3+CD8+%水平較治療前降低,而對照組患者CD3+CD4% CD4/CD8水平較治療前下降,CD3+CD8+%水平較治療前升高,且治療后觀察組CD3+CD4%、CD4/CD8水平較對照組升高,CD3+CD8%水平較對照組降低,差異均有統計學意義(P<0.05)。見表2。
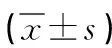
表2 兩組患者免疫功能指標比較
2.3 兩組不良反應發生率比較 觀察組高血壓、甲狀腺功能異常發生率高于對照組,差異均有統計學意義(P<0.05),但蛋白尿、手足皮膚反應、發熱發生率與對照組比較,差異無統計學意義(P>0.05)。見表3。

表3 兩組不良反應比較[n(%)]
3 討論
當前mCRC診療策略已非常規范,一二線pMMR者治療以奧沙利鉑、伊立替康、卡培他濱、氟尿嘧啶為基礎的化療,聯合血管靶向藥物貝伐珠單抗或抗表皮生長因子受體(EGFR)西妥昔單抗,依據KRAS狀態、腫瘤部位、患者的體能狀態評分分層選擇,dMMR者一二線治療選擇PD-1單抗免疫治療。三線治療可選擇瑞戈非尼、呋喹替尼、曲氟尿苷替匹嘧啶,但mCRC四線及后線該如何治療,目前尚無標準指南推薦,部分患者進入臨床研究,采用最佳支持治療。
本文中,四線治療選擇繼續服用呋喹替尼聯合PD-1抑制劑,主要歸于以下幾個原因:(1)KEYNOTE-177[4]、CheckMate142等研究,均證實dMMR/MSI-H mCRC是PD-1單抗的優勢人群,這也奠定了PD-1單抗一線治療dMMR/MSI-H mCRC的地位,但全部mCRC 患者中dMMR/MSI-H僅占5%, pMMR/MSS患者約占95%, PD-1/PD-L1抑制劑對pMMR/MSS患者幾乎無任何治療效果[5],這意味一大部分mCRC患者并不能從免疫治療中獲益,遠遠不能滿足臨床治療的需求,因此亟待探索改變pMMR/MSS mCRC患者免疫治療無應答的困境。(2)Zelenay等[6]在小鼠大腸癌動物模型中,采用PD-1單抗聯合抗血管內皮生長因子治療,結果發現聯合治療后小鼠體內細胞毒性T細胞免疫功能增強,提高CD8+T淋巴細胞向腫瘤細胞內部的浸潤,從而提高對PD-1單抗治療的敏感性。REGONIVO研究[7]采用瑞戈非尼聯合納武利尤單抗治療晚期三線及三線以上胃腸癌患者,入組的25例mCRC 患者中僅1例為MSI-H,其余24例均為MSS型,結果顯示pMMR/MSS mCRC客觀緩解率ORR為33%(8/24),中位無進展生存期為7.9個月。王育生等[8]對1例直腸癌肝肺轉移MSS患者,三線采用口服瑞戈非尼,三線治療失敗后,四線繼續口服瑞戈非尼同時聯合PD-1抑制劑, PFS達3個月。(3)呋喹替尼是首個獨立由中國人發明、中國醫生研究、中國企業生產的抗腫瘤新藥。對血管內皮生長因子受體(VEGFR)1、2、3都有強效的抑制作用,在Ⅰ期和Ⅱ期的臨床試驗中,呋喹替尼顯示了其對結直腸癌作用強、毒性低、耐受性好的優勢,Ⅲ期的隨機、雙盲、對照FRESCO研究[9],呋喹替尼中位OS、PFS均完勝安慰劑對照組,同時展現了良好的安全性,通過優先審評審批程序,于2018年9月國家藥品監督管理局獲批上市。呋喹替尼相較瑞戈非尼價格明顯優惠,更容易被廣大基層患者接受。基于以上研究結果及原因,筆者三線采用呋喹替尼單藥治療,三線治療失敗進展后,對于體能狀態良好,預計生存超過3個月的患者,四線繼續口服呋喹替尼,同時聯合PD-1抑制,取得了較好的治療效果。
本研究觀察到四線呋喹替尼聯合PD-1單抗免疫治療,DCR較最佳支持治療組明顯延長,除引起血壓增高、甲狀腺功能異常外,并未因聯合用藥增加靶向藥物和免疫抑制劑的不良反應,臨床療效、安全性良好,且6例使用卡瑞利珠單抗的患者,聯合呋喹替尼靶向治療,反應性毛細血管增生癥反而較單用卡瑞利珠單抗減輕。CD4+淋巴細胞為輔助性T淋巴細胞,CD8+淋巴細胞為抑制性T淋巴細胞,二者維持于平衡狀態,維持正常的免疫功能。研究發現[10]當CD4/CD8比例降低時,患者免疫功能呈抑制狀態,腫瘤微環境呈現為“冷腫瘤”,而當CD4/CD8比例升高時,患者免疫原性增強,免疫功能呈增強狀態,腫瘤微環境由“冷腫瘤”轉變為“熱腫瘤”狀態。本研究中治療前兩組患者免疫功能測定無明顯差異,治療后觀察組CD3+CD4%、CD4/CD8較對照組升高,CD3+CD8%水平較對照組降低,改善PD-1單抗對pMMR/MSS mCRC無應答。究其原因可能為:聯合用藥后,血管靶向藥物改變腫瘤血管雜亂無章的狀態,使腫瘤畸形血管正常化,提高T淋巴細胞向腫瘤組織聚集,從而將腫瘤微環境由免疫抑制型變為免疫增強型。然而本研究納入的研究對象較少,觀察時間較短,因此所得結論可能存在一定的局限性,需要更多的研究及更多的患者進一步證實。同時也提示若將PD-1單抗免疫抑制劑提前至三線,三線聯合瑞戈非尼、呋喹替尼、曲氟尿苷替匹嘧啶,能否進一步提高三線單藥治療療效,呋喹替尼跨線治療是否會持續獲益,還需進一步通過臨床驗證。

