肺磨玻璃結節的高分辨率CT特征及鑒別肺腺癌的價值
錢國偉 福建省南平市建陽第一醫院 354200
肺癌作為發病率排名首位的惡性腫瘤,其病死率非常高且呈逐年增高趨勢,對人們的生命安全及身心健康極具威脅[1]。隨著我國人們體檢普及率的增長,越來越多的人開始重視肺癌的早期篩查。美國胸協會、歐洲呼吸學會及國際肺癌研究協會于2011年將肺腺癌重新分為浸潤前病變及浸潤性病變,前者包含不典型腺瘤樣增生(AAH)及原位癌(AIS),后者包含微浸潤性病變(MIA)及浸潤性病變(IAC)。每種類型意味診療方案及手術切除范圍的不同,同時對5年生存率亦存在影響,故此術前對于GGN診斷極其重要[2]。肺癌常用臨床監測方法為CT,經過多層螺旋CT技術快速更新,傳統CT逐步呈現高分辨率CT(HRCT)的功能,其可清晰顯現與實體標本相似的肺組織細微結。肺磨玻璃結節(GGN)是通過HRCT影響結果呈現不掩蓋其內部支氣管血管束的肺內局限性密度增高影,其可呈現一般直徑2~3mm的多發或單發半透明玻璃狀影,內見支氣管壁影或血管[3]。基于此,為分析GGN于HRCT特征及鑒別肺腺癌的臨床價值,筆者回顧性收集2018年6月—2021年6月期間我院收治150例肺腺癌患者臨床資料納入研究,現報道如下。
1 資料與方法
1.1 一般資料 本研究經我院倫理委員會批準,回顧性收集2018年6月—2021年6月期間我院收治的疑似肺腺癌患者臨床資料。 納入標準:(1)HRCT檢查影響結果顯示存在GGN;(2)GGN為<3mm,且HRCT影像顯示無肉眼可見偽影;(3)術中病理結果確診肺腺癌;(4)臨床資料足夠滿足本次研究。排除標準:(1)存在CT掃描禁忌;(2)合并其他惡性腫瘤;(3)腫瘤已出現侵犯血管、胸膜、淋巴結系統或出現腫瘤壞死;(4)妊娠或哺乳期女性。最終150例肺腺癌患者納入研究,據病理結果類型分為浸潤前組(59例)及浸潤組(91例)。浸潤前組中男20例,女39例;年齡36~72歲,平均年齡(54.18±6.24)歲;家族史:有22例,無37例;吸煙史:有7例,無52例。浸潤組中男33例,女58例;年齡38~75歲,平均年齡(52.86±6.37)歲;家族史:有36例,無55例;吸煙史:有19例,無72例。兩組一般資料對比無顯著差異(P>0.05)。
1.2 方法
1.2.1 HRCT掃描。以多層螺旋CTNeuViz 16 CT于患者深吸氣下屏氣進行胸部掃描。囑患者平臥后屏氣,自肺尖至膈頂以肺窗位-600HU、窗寬1 600HU、管電流200mAs及管電壓120kV進行掃描。掃描結束后,將非離子型對比劑(武漢曙爾生物科技有限公司生產,1.5ml/kg)以2.5ml/s高壓注射于肘靜脈后增強掃描,分別于注射結束后30s與90s掃描。結束后將所有薄層圖像重建進行測量,層厚1.5mm,CT成像采用標準算法與高分辨骨算法。
1.2.2 影像評估及病理檢查。所有圖像特征在預先不告知患者病歷資料情況下以2位肺癌影像診斷經驗超過10年的醫生共同分析位置、大小、邊緣、形態、結節內部擴張小血管及支氣管、實性成分最大直徑及比值、胸膜牽拉進行判斷,若意見相同則記錄下來,若意見相左,則與肺癌影像診斷經驗超過15年的醫生討論分析,最終記錄一致意見。術中病理確診:術前以微量亞甲藍注射病灶及CT引導針穿刺進行雙重定位,定位成功后行胸腔鏡手術。術中將切除的采樣淋巴結及肺組織以快速冰凍病理進行檢測。當檢測結果為良性或不典型腺瘤樣增生(AAH),則可結束手術,若檢測結果為原位癌(AIS) 及微浸潤性病變(MIA) 則繼續手術進行淋巴結清掃;若檢測結果為浸潤性病變(IAC),則繼續手術將病變側肺葉全部切除與淋巴結清掃。術后需將術中切除的淋巴結組織及肺組織重新進行病理學檢查,再次確定浸潤情況及結節病變類型。
1.3 觀察指標 (1)觀察和統計所有患者HRCT特征及影像學參數,包括形狀、位置、邊緣、胸膜牽拉、擴張小支氣管、擴張小血管、結節大小、實性成分最大直徑及實性成分最大直徑占比;(2)采用Logistic回歸分析HRCT特征與肺腺癌浸潤性的關系;(3)單繪制 ROC 曲線分析HRCT特征鑒別肺腺癌浸潤性的價值。
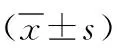
2 結果
2.1 HRCT影像學特征 兩組在位置、擴張小支氣管方面無顯著差異(P>0.05),而在形狀、邊緣、胸膜牽拉、擴張小血管等方面差異具統計學意義(P<0.05),見表1。

表1 兩組HRCT影像學特征對比[n(%)]
2.2 HRCT影像學參數 浸潤前組結節大小、實性成分最大直徑及其占比均顯著低于浸潤組(P<0.05),見表2。
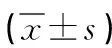
表2 兩組HRCT影像學參數對比
2.3 HRCT影像學與肺腺癌病理結果的Logistic回歸分析 以形狀(圓形=1、不規則=2、分葉狀=3)、邊緣(光滑=0、毛刺=1、模糊=2)、胸膜牽拉(有=1、無=0)、擴張小血管(有=1、無=0)、結節大小(連續變量)、實性成分最大直徑(連續變量)及實性成分最大直徑占比(連續變量)為協變量,肺腺癌病理結果(浸潤前=0、浸潤=1)為因變量行Logistic回歸分析。結果顯示形狀、胸膜牽拉、實性成分最大直徑及實性成分最大直徑占比均為肺腺癌的獨立影響因素,見表3。

表3 HRCT影像學與肺腺癌病理結果的Logistic回歸分析
2.4 HRCT特征對肺腺癌浸潤性的鑒別價值分析 ROC曲線分析結果顯示,單一HRCT特征鑒別肺腺癌浸潤性時,以實性成分最大直徑占比的AUC值最高,但與形狀、胸膜牽拉、實性成分最大直徑的AUC比較差異無統計學意義(Z=1.741、1.360、0.563,P=0.082、0.174、0.574),以56%為截斷值,其鑒別肺腺癌浸潤性的敏感度為45.05%、特異度為88.14%。見表4。

表4 HRCT特征對肺腺癌浸潤性的鑒別價值分析
3 討論
GGN并不是疾病的準確名稱,而是機體肺部疾病的一種影像學改變,表現為肺內局限性淡薄的密度增高影,但其未掩蓋其中的支氣管束及血管[4]。其可能為出血、炎癥等良性病變,也可能為原位癌或浸潤性癌變等惡性病變,常常不同診斷結果意味著不一樣的處理方案及對于患者預后判斷[5]。目前,臨床確診肺腺癌的診斷依據為穿刺活檢,然其屬于一種有創手段,可能引起血胸、氣胸等并發癥,故此,許多專家希望通過分析患者GGN的HRCT影像特征來判斷疾病良惡性、病變程度及浸潤性[6]。
本研究結果顯示,浸潤前組及浸潤組在形狀、邊緣、胸膜牽拉、擴張小血管等方面具有顯著差異,Logistic回歸分析結果也顯示,形狀、胸膜牽拉為肺腺癌的獨立影響因素,其病變風險增加至1.369倍、1.592倍。另有報道顯示,GGN惡性病變中出現胸膜牽拉概率遠高于良性病變,且惡化等級越高出現胸膜牽拉概率越高。良性病變常邊緣光滑少見模糊或毛刺,其多可見部分點狀鈣化,可能存在周圍胸膜粘連肥厚的情況,而惡性病變中,形狀不規則或分葉狀都是較為多見且存在邊緣粗糙或弧形凹陷[7]。分葉征又因癌性細胞分化差異分為深分葉和淺分葉,肺內結締組織間隔影響病變區域的生長發育而出現延伸至肺部的凹陷為深分葉,其于臨床診斷異常關鍵[8]。本研究ROC曲線也顯示,形狀、胸膜牽拉鑒別肺腺癌浸潤性的AUC分別為0.610、0.635,但形狀、胸膜牽拉鑒別肺腺癌的敏感度欠佳,分別為59.34%、47.25%。另有研究顯示,當病變侵犯胸膜可致使胸膜出現腫瘤內部結締組織增生反應,而致使病灶中心纖維化對胸膜形成牽拉,影像學結果表現為腫瘤周圍條索纖維化改變樣[9]。
病變中實性成分大小常為臨床鑒別GGN良惡性的重要指標之一,其中實性成分常代表腫瘤對于機體的入侵部分。李魯等[10]將GGN中實性成分于病變部位占比進行研究,結果顯示當其占比超過50%,提示確診浸潤性肺腺癌概率大大增高,且淋巴轉移概率可達21%~26%。本研究HRCT影像學計量資料對比結果顯示,浸潤前組實性成分最大直徑及其占比均顯著低于浸潤組,且Logistic回歸分析結果也顯示實質成分最大直徑及實性成分最大直徑占比均為肺腺癌的獨立影響因素,與既往研究結果一致。然兩組性別、年齡、家族史及吸煙史均無顯著差異,可能與本次研究樣本量較少無法顯現差異有關。本研究ROC曲線顯示實質成分最大直徑及實性成分最大直徑占比鑒別肺腺癌的AUC分別為0.684、0.716。其中實性成分最大直徑占比的AUC值最高,但與形狀、胸膜牽拉、實性成分最大直徑的AUC比較差異無統計學意義,以56%為截斷值,其鑒別肺腺癌浸潤性的敏感度為45.05%,特異度為88.14%。
綜上所述,肺腺癌是由浸潤前病變逐漸轉變為浸潤性病變的一個過程,影像學結果顯示結節形狀、胸膜牽拉、實質成分最大直徑及實性成分最大直徑占比均為肺腺癌的獨立影響因素,可判斷肺腺癌是浸潤前病變還是已經進行致浸潤性病變,可為臨床醫者為患者制定手術方案提供參考依據。本研究不足之處在于樣本量偏小且作為回顧性研究,樣本資料可能存在偏倚,后續研究會擴大病例范圍,增加樣本量,望早日將肺腺癌影像判斷標準統一化。

