海藻糖及保存設備對豬全血冷藏品質的影響
萬康 陶樂仁 沈釘

摘?要:血液的長期保存有著重要的應用價值和理論意義。以豬全血為研究對象,將其保存于含不同濃度(0.05、0.25和0.50 mol ·L?1)海藻糖的血液保存液Ⅲ(CPDA)和不同保存設備中,并對豬全血的保存品質進行了評價。保存期間,每4天測量1次血液的?pH、紅細胞總數(RBC)、平均紅細胞血紅蛋白含量(MCH)、紅細胞比容(HCT)、平均紅細胞體積(MCV)、白細胞總數(WBC)、游離血紅蛋白(FHb)、溶血率。結果表明,0.05 mol ·L?1海藻糖延緩了紅細胞、白細胞的凋亡速度以及紅細胞的形變速度,降低了血液的溶血速度,使血液得到了更好的保存,海藻糖濃度過高反而會對血液的保存產生不利的影響。此外,與冰箱相比,恒溫槽中的溫度更為穩定,使得血液的保存效果明顯提升。
關鍵詞:豬全血;紅細胞;海藻糖;保存設備
中圖分類號: R446.11 ??文獻標志碼: A
Effect of trehalose and preservation equipment on storage quality of porcine whole blood
WAN Kang,TAO Leren ,SHEN Ding
(School of Health Science and Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract:Long-term preservation of blood has important application value and theoretical significance. The influence of trehalose concentration (0.05, 0.25 and 0.5 mol ·L?1) in blood preservation solution III (CPDA) and preservation equipment on storage quality of porcine whole blood was evaluated. pH, total red blood cells(RBC), average red blood cell hemoglobin content (MCH), hematocrit (HCT), average red blood cell volume (MCV), total white blood cells (WBC), free hemoglobin (FHb) and hemolysis rate of porcine blood were determined every 4 days in its preservation process. Results show that at the trehalose concentration of 0.05 mol ·L?1, both the apoptosis rate of RBC and WBC and the deformation rate of RBC are delayed, and the hemolysis rate of blood reduces, which results in better preservation of blood. High concentration of trehalose has an adverse impact on the preservation of blood. In addition, compared with the refrigerator, the temperature in the thermostatic bath maintains more stably, which significantly improves thepreservation of blood.
Keywords:porcine whole blood; red blood cell; trehalose; preservation equipment
全血保存在過去是保存血制品的一種常見方式,近年來又重新引起了醫學界的重視[1–2]。血液離體后保存于不同條件下,其血細胞的生化狀況、形態等均會出現不同程度的變化,在衰老的過程中血細胞會出現不可逆的改變,從而導致血液保存失敗。
海藻糖是一種人體細胞間優化溝通所需要的己糖脫氧糖,廣泛存在于人體中,具有軟化血管、調節血壓的作用。此外,海藻糖還具有極高的穩定性,在各種惡劣環境下依然可以對生物膜、蛋白質等生物大分子發揮良好的保護作用[3]。研究[4–5]發現,海藻糖在冰凍過程中對細胞膜具有保護作用,可以取代水與磷脂極性基團結合來保持膜結構的完整性,同時還可以起到伴侶蛋白的作用,抑制變性蛋白質聚集,為蛋白質復性提供能量,進而有效延緩血液保存品質的變化。
人血因管控嚴格難以獲得,豬血與人血在成分上大致相同,可以用來代替人血進行血液保存方面的研究,市面上也存在用人血保存液保存的實驗用豬血。目前已有的研究表明,冷凍紅細胞可以達到長期保存的效果,但是冷凍紅細胞制作成本高且制作過程中添加的甘油對身體有害,需要在輸注前經洗滌去除,操作過程復雜繁瑣,因此該方法主要用于保存稀有血型。而現行的低溫保存方法會使血細胞損傷速度加快,導致溶血率快速增高,血液變質,從而易造成資源浪費。基于海藻糖對細胞的保護特性,以全血為實驗對象,改變海藻糖濃度和保存設備,對全血的保存品質進行評估,以期建立一種方便、安全、有效的全血儲存方法。
1 材料和方法
1.1 儀器與試劑
THD?2006型低溫恒溫槽購于寧波天恒儀器廠。?BCD?226WGAC 型變頻冰箱購于無錫松下冷機有限公司。?UV?1200型紫外分光光度計購于上海美普達儀器有限公司。?SQP 型電子天平購于賽多利斯科學儀器(北京)有限公司。HH?2型數顯恒溫水浴鍋購于上海梅香儀器有限公司。?TC?Spinplus?6型低速離心機購于上海珂淮儀器有限公司。330 Vet 型全自動動物血液細胞分析儀購于山東卓越生物技術股份有限公司。
二水合枸櫞酸三鈉、枸櫞酸單水合物、磷酸二氫鈉單水合物、葡萄糖單水合物、乙二醇、腺嘌呤均購于國藥集團化學試劑有限公司,且均為分析純。微量游離血紅蛋白試劑盒購于南京建成生物工程研究所。Tr?100 ml 一次性使用塑料血袋購于山東威高集團醫用高分子制品股份有限公司。豬全血采集于昆山市定點屠宰加工中心有限公司。
1.2 保存液和血液保存溫度的確定
本實驗中采用血液保存液Ⅲ(CPDA),將僅采用?CPDA 保存的血液作為對照組,將采用加入不同濃度(0.05、0.25和0.50 mol ·L?1)海藻糖的?CPDA 保存的血液作為實驗組。目前常用全血儲存溫度為4℃。有研究表明,4℃下可明顯減緩紅細胞的溶血情況[6],因此本次實驗中保存溫度設定為4℃。
1.3 血液的采集
采血所需的工具多為塑料、樹脂制品,因此對采血工具進行紫外滅菌。對血液保存液進行高溫滅菌后將4種不同配方的血液保存液放置于4個無菌瓶中備用,并做好標記。
鑒于動物血液離體后會迅速凝固,操作時將注射器內壁先用血液保存液潤濕,再進行靜脈抽血。按照保存液、血液體積比14∶100將血液注入無菌瓶中,并將無菌瓶密封置于0~10℃的保溫箱中帶回。
1.4 樣品的處理
將1個無菌瓶中的血液分裝到14個血袋中,并做好標記。為了防止血細胞分布不均,每次裝袋前將無菌瓶中的血液充分混勻。將其中7個血袋置于冰箱中,記為一組,另外7個血袋置于恒溫槽中,記為一組。按照同樣方法處理其他3個無菌瓶中的血液,共得到8組56個血袋。冰箱和恒溫槽的溫度均設定為4℃。
1.5 相關指標的測定
利用血細胞分析儀測量紅細胞總數(RBC)、紅細胞比容(HCT)、平均紅細胞體積(MCV)、平均紅細胞血紅蛋白含量(MCH)、白細胞 (WBC);利用 pH 計測量 pH;使用試劑盒測量游離血紅蛋白(FHb);通過公式[7]計算溶血率。每4天測量1次各項指標,每次實驗時取1個血袋,測量完畢血袋即報廢。
2 結果討論
經觀察,整個保存期間所有血袋均未出現破損滲漏,采血管無裂紋、氣泡、扭結,上清液呈微黃色且無雜質,血液顏色無異常,且各組血袋均未出現凝塊。
使用?ADAM?4000?5000 Utility 分別對冰箱和恒溫槽的溫度進行30 min 連續監測,結果如圖1所示,其中:?t 為時間;?T 為溫度。從圖中可以看出,恒溫槽整體溫度波動比冰箱的小。由于常規冰箱采用啟停雙位控制系統,每隔一段時間溫度會有一次較大的波動,整體溫度波動較大,而恒溫槽采用的是電阻絲加熱、壓縮機制冷的方法,輔以比例積分微分(PID)微機自整定精確溫度控制方式,將溫度穩定在設定溫度,恒溫槽整體溫度較穩定,溫度波動均在0.3℃以內。
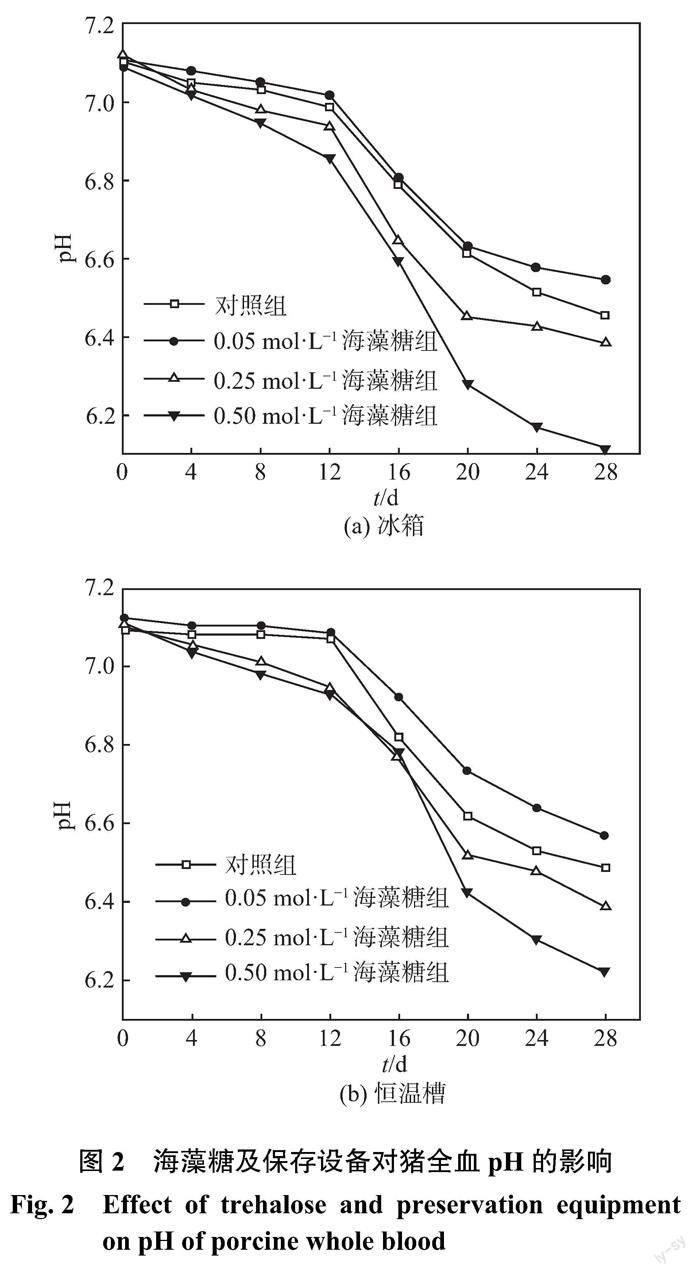
2.1 海藻糖及保存設備對豬全血 pH 的影響
當?pH 過低時,全血的細胞形態與細胞膜流變學特性均會受到一定影響,同時還會出現細胞聚集,從而加速?pH 的下降,對紅細胞的攜氧功能造成影響[8?9],因此?pH 可以作為評判血液保存效果的重要指標。圖2為海藻糖及保存設備對豬全血?pH 的影響。從圖中可見,各組血液的?pH 均呈下降趨勢。這是由于血漿和外源性葡萄糖在保存過程中發生無氧酵解產生乳酸,乳酸堆積造成?pH 下降[10]。冰箱和恒溫槽中0.50 mol ·L?1海藻糖組的?pH 均迅速下降,在保存末期其值低于6.3,且下降速度均慢于其他2種濃度海藻糖組和對照組。低濃度海藻糖降低了細胞膜的通透性,相對減少了紅細胞與葡萄糖的接觸,減緩了紅細胞代謝速度,導致乳酸減少,pH 下降速度減慢,而高濃度海藻糖增加了細胞膜的通透性,保存液中的葡萄糖更容易滲透至細胞內,加速紅細胞的代謝,因此?pH 下降得較快。與對照組相比,0.25、0.50 mol ·L?1海藻糖組的?pH 下降速度反而更快,這表明過量添加海藻糖不利于血液的保存。恒溫槽中血液的?pH 下降速度比冰箱中的稍慢,尤其在保存末期,其下降速度更慢。
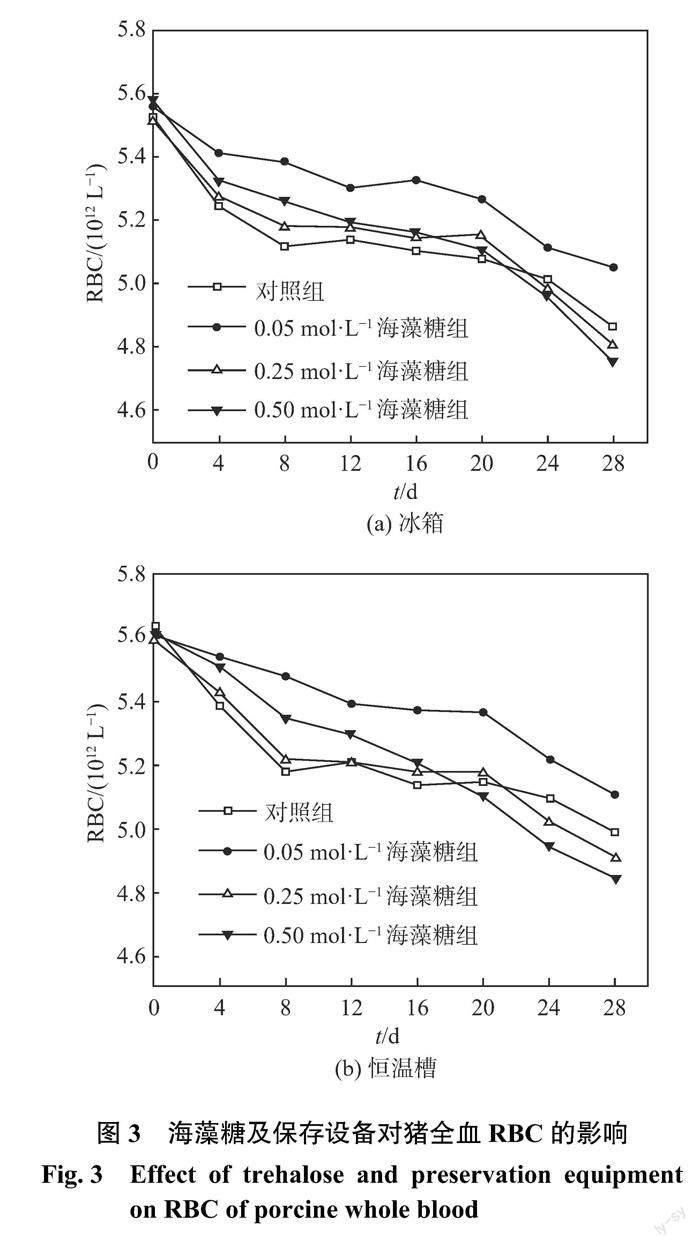
2.2 海藻糖及保存設備對豬全血 RBC 的影響
RBC 是指血液中數量最多的一種血細胞即紅細胞總數。紅細胞主要負責運送氧氣,因此?RBC 可作為評判血液保存效果的重要指標。紅細胞在保存過程中,隨著時間的推移將發生一系列物理、生理改變,最終衰敗、死亡,在此期間紅細胞會出現雙凹圓盤狀消失、細胞膜破裂、內容物流出,從而造成溶血。圖3為海藻糖及保存設備對豬全血?RBC 的影響。從圖中可見,各組的?RBC 均呈緩慢下降趨勢,這與鄧梅英等[11]的研究結果一致。冰箱和恒溫槽中0.05 mol ·L?1海藻糖組的?RBC 下降速度最慢,這表明該濃度海藻糖延緩了紅細胞的衰亡進程。冰箱和恒溫槽中0.50 mol ·L?1海藻糖組的?RBC 在前12天內下降速度比對照組和0.25 mol ·L?1海藻糖組的都慢,但是在整個保存期間該組的?RBC 持續快速下降,在第28天時?RBC 的損失率遠高于其他組。保存末期,恒溫槽中0.05 mol ·L?1海藻糖組的?RBC 高于冰箱中同濃度海藻組的。洛群等[12]研究了海藻糖濃度對紅細胞的保存效果的影響,發現高濃度海藻糖可延長紅細胞保存期近一倍,這與本次實驗結果不同。這可能是因為洛群等只研究了短期內的保存效果(4~7 d),而本次實驗時間為28 d,保存前期0.50 mol ·L?1海藻糖組對?RBC 保存效果的確優于對照組和0.25 mol ·L?1海藻糖組,但在保存末期0.50 mol ·L?1海藻糖組的?RBC 保存效果明顯更差。
2.3 海藻糖及保存設備對豬全血 MCH 的影響
MCH 是指每個紅細胞內所含血紅蛋白的平均量。紅細胞體積的變化以及胞內血紅蛋白外漏均會導致 MCH 的檢測結果發生變化。圖4為海藻糖及保存設備對豬全血 MCH 的影響。從圖中可見,直至保存末期,各組的?MCH 均未見明顯的增加或減少,保存過程中的波動也均符合保存質量要求。不論是在冰箱中還是在恒溫槽中,3組不同濃度海藻糖組與對照組之間均沒有統計學意義(概率值r>0.05),冰箱中0.05、0.50 mol ·L?1 海藻糖組的?MCH 均值分別為21.09、20.76 pg,恒溫槽中的分別為21.21、20.88 pg,可見恒溫槽的保存效果略好于冰箱。但兩種保存設備對?MCH 的保存效果差別不大,這說明紅細胞中的血紅蛋白并未發生明顯的外漏,而血漿中增加的游離血紅蛋白是因紅細胞破裂所致。
2.4 海藻糖及保存設備對豬全血 MCV 的影響 MCV 是指單個紅細胞的平均體積,可以反映紅細胞的形變情況。圖5為海藻糖及保存設備對豬全血 MCV 的影響。從圖中可見,各組的 MCV 均呈上升趨勢,與現有的研究結果一致[13]。成熟紅細胞的主要功能是負責運輸。為了方便運輸,紅細胞的細胞膜內只有水、血紅蛋白,沒有細胞核、細胞器,因此紅細胞維持活動只能靠攝取葡萄糖。血液離體后血漿中的葡萄糖有限,如在保存液中過量添加葡萄糖又會導致胞外滲透壓增加。在保存過程中紅細胞代謝需要依靠持續消耗血漿中有限的葡萄糖來維持,葡萄糖酵解減少首先會導致胞外滲透壓持續降低,在達到滲透平衡的過程中紅細胞不斷吸水導致膨脹變大。此外,葡萄糖的減少還會導致維持紅細胞形態所必需的能量供應中斷,并且還會伴有乳酸產生,乳酸堆積致使?pH 下降,?pH 過低又進一步導致紅細胞無法維持自身的正常形態[14],紅細胞變形、體積增大,最后致使紅細胞脹破,胞內的水和血紅蛋白最終流向血漿。冰箱中0.05 mol ·L?1海藻糖組的?MCV 明顯低于其他組,0.50 mol ·L?1海藻糖組的細胞形態維持得相對較好。恒溫槽中0.50 mol ·L?1海藻糖組的?MCV 相較于其他組的上升更慢。計算保存末期各組紅細胞的溶脹率,冰箱中對照組的為10.5%,0.05、0.25、0.50 mol ·L?1海藻糖組的分別為6.5%、9.8%、7.9%;恒溫槽中對照組的為11.9%,0.05、0.25、0.50 mol ·L?1海藻糖組的分別為10.2%、11.1%、7.3%。冰箱中0.50 mol ·L?1海藻糖組的溶脹率高于恒溫槽中相應濃度組的,其余3組的溶脹率也均低于恒溫槽中相應濃度組的,其中0.05 mol ·L?1海藻糖組的溶脹率在8組中最小。
2.5 海藻糖及保存設備對豬全血 HCT 的影響
HCT 指單位容積內紅細胞的占比,是由血細胞分析儀測量出的?RBC 和?MCV 相乘得到,它可以反映紅細胞的積壓及聚集程度。圖6為海藻糖及保存設備對豬全血?HCT 的影響。從圖中來看,冰箱和恒溫槽中對照組和0.25 mol ·L?1海藻糖組的?HCT 在前8天均不同程度地下降。從數據來看,這是因為在前8天這兩組的?RBC 下降速度較快,而?MCV 增加緩慢,兩者乘積減少導致?HCT呈下降趨勢;從微觀來看,由于紅細胞對保存環境的不適應造成前期相當一部分紅細胞出現損傷,且紅細胞前期聚集性不強,分布較為均勻,紅細胞占比下降,因此 HCT 降低。第12~20天,對照組和0.25 mol ·L?1海藻糖組的?HCT 又不同程度地緩慢上升,這是因為它們的?RBC 在這段時間內變化趨于平穩,MCV 增大,紅細胞堆積加劇[15],從而造成?HCT 上升。0.05 mol ·L?1 海藻糖組的?HCT 在整個保存期間相對于其他組更為平穩,這是因為0.05 mol ·L?1海藻糖組的?RBC 前期相對穩定,且?MCV 增幅較小。在保存末期?RBC 大幅下降導致對照組、0.05和0.25 mol ·L?1海藻組的?HCT 均明顯下降。保存期間0.50 mol ·L?1海藻組的?RBC 持續快速下降,而其?MCV 相對平穩,造成該組的?HCT 在整個保存期間持續下降。在第28天時,冰箱和恒溫槽中0.50 mol ·L?1海藻組的?HCT 均顯著低于其余3組(r<0.05)。對冰箱和恒溫槽中對照組,0.05、0.25 mol ·L?1海藻糖組的?HCT 依次進行方差分析,冰箱中各組的方差分別為0.52、0.44、0.56,恒溫槽中各組的方差分別為0.43、0.39、0.48。總體來看,恒溫槽中?HCT 的數據比冰箱中的更為穩定,8組中恒溫槽中0.05 mol ·L?1海藻糖組的?HCT 最為穩定。
2.6 海藻糖及保存設備對豬全血 WBC 的影響
白細胞的主要功能是防衛作用,血液標本長時間放置會導致白細胞脆性增大,使白細胞受到破壞。圖7為海藻糖及保存設備對豬全血?WBC 的影響。從圖中可見,各組的?WBC 均持續下降。冰箱中0.05 mol ·L?1海藻糖組的?WBC 下降速度比其他3組的慢,其他3組的?WBC 差別不大,第20天時各組的?WBC 開始低于標準值的最低值1.1×1010L?1。恒溫槽中0.05 mol ·L?1海藻糖組的?WBC 下降速度最慢,0.50 mol ·L?1海藻糖組的?WBC 在第20天開始低于標準值最低值。第24天時對照組的?WBC(1.05× 1010 L?1)和0.25 mol ·L?1海藻糖組的?WBC(1.04×1010 L?1)也均開始低于標準值最低值;第28天時?0.05 mol ·L?1海藻糖組的?WBC(1.04×1010 L?1)開始低于標準值的最低值。相同濃度海藻糖組中,恒溫槽中各組?WBC 下降速度更慢,其中0.25 mol ·L?1海藻糖組的?WBC 下降速度顯著低于冰箱中的4組(r<0.05)。
2.7 海藻糖及保存設備對豬全血 FHb 的影響
FHb 是評價血液保存效果的重要指標。隨著時間延長,紅細胞出現不同程度的破損,釋放血紅蛋白,導致?FHb 增加。圖8為海藻糖及保存設備對豬全血?FHb 的影響。從圖中可見,各組的?FHb 均呈上升趨勢。保存前期各組的?FHb 均緩慢上升,第20天后各組的?FHb 上升速度均不同程度增加。前16天冰箱中4組的?FHb 差別較小,第16天后各組的?FHb 差別明顯,其中0.05 mol ·L?1 海藻組的?FHb 上升速度開始小于其他3組,其值顯著低于其他3組(r<0.05)。從第4天開始,恒溫槽中0.25、0.50 mol ·L?1海藻糖組的?FHb 高于對照組,其中0.05 mol ·L?1海藻糖組的?FHb 在保存期間顯著低于其他3組(r<0.05)。第28天時恒溫槽中0.05 mol ·L?1海藻糖組的?FHb 開始低于冰箱中的4組,且其值與這4組的值之間均有顯著性差異(r<0.05)。保存末期冰箱和恒溫槽中0.25、0.50 mol ·L?1海藻糖組的?FHb 均迅速升高。高濃度海藻糖會造成細胞膜通透性增加,致使血紅蛋白滲漏,這可能是高濃度海藻糖組的?FHb 高于對照組的原因。
2.8 海藻糖及保存設備對豬全血溶血率的影響
溶血率是評判血液保存效果最直接的指標,溶血率升高是紅細胞破損的表現。圖9為海藻糖及保存設備對豬全血溶血率的影響。從圖中可見,各組的溶血率均持續升高,兩種保存設備中0.05 mol ·L?1海藻糖組的溶血率均明顯低于其他3組,而0.50 mol ·L?1海藻糖組的溶血率最高。前20天,各組溶血率緩慢上升,從第20天開始,各組的溶血率均明顯上升,這與?FHb 的變化情況相同。前20天各組之間無顯著性差異(r>0.05),保存末期冰箱中0.05 mol ·L?1海藻糖組的溶血率顯著低于其他3組(r<0.05),而0.50 mol ·L?1 海藻糖組的溶血率顯著高于其他3組(r<0.05)。恒溫槽中各組的情況與冰箱中的相同。保存末期恒溫槽中0.05 mol ·L?1海藻糖組的溶血率低于冰箱中相同濃度海藻糖組的,恒溫槽中0.50 mol ·L?1海藻糖組的溶血率低于冰箱中相同濃度海藻糖組的,對照組和0.25 mol ·L?1海藻糖組的溶血率也均低于冰箱中的。
3 結 論
通過研究不同濃度海藻糖和不同保存設備對豬全血冷藏品質的影響發現,適量濃度(0.05 mol ·L?1)的海藻糖可以起到穩定細胞膜的作用,維持細胞自身形態,同時低濃度海藻糖可以增加細胞膜剛性,延長紅細胞的保存時間,延緩紅細胞損傷,適用于4℃下的血液保存;高濃度(0.50 mol ·L?1)海藻糖雖然減少了紅細胞的溶脹,使紅細胞更能維持自身的形態,然而紅細胞一直處于高滲透壓環境中會導致紅細胞損傷增加,并且高濃度海藻糖使血液的?pH 下降速度過快,使紅細胞的胞外環境更加惡劣,整體來看不適用于血液的長期保存。
海藻糖濃度相同時,短期內冰箱和恒溫槽中保存的血液質量差別不大,但隨著保存時間的延長,冰箱內長期不穩定的溫度使細胞膜結構松散,血紅蛋白外漏、MCH 降低、FHb 升高加快,紅細胞內容物減少,同時也造成 MCV 上升速度有所減緩。此外,胞內血紅蛋白的減少使得紅細胞內部結構發生變化,在通過血細胞分析儀檢測激光束時無法檢測到其光散射次數和電脈沖信號的改變,導致檢測結果中 RBC 減少,而恒溫槽中溫度的精準控制則可避免這些問題。
綜上所述,在豬全血中加入適量濃度(0.05 mol ·L?1)海藻糖并保存在溫度更加穩定的環境中可以有效提高全血的保存品質。
參考文獻:
[1] NESSEN S C, EASTRIDGE B J, CRONK D, et al. Fresh whole blood use by forward surgical teams in Afghanistan is associated with improved survival compared to component therapy without platelets[J]. Transfusion, 2013, 53(S1):107S -113S.
[2] GURNEY J M, SPINELLA P C. Blood transfusion management in the severely bleeding military patient[J].Current Opinion in Anaesthesiology, 2018, 31(2):207-214.
[3]?OPIELKA M, SOBOCKI B, MIERZEJEWSKA P, et al. The effect of trehalose on intracellular and extracellular nucleotide metabolism. A pilot study[J]. Nucleosides, Nucleotides & Nucleic Acids, 2020, 39(10?12):1400-1409.
[4]何迎粉, 何榮榮, 劉敦華, 等.海藻糖與釀酒酵母乙醇耐受性相關性的研究進展[J].中國釀造 , 2020, 39(11):1-4.
[5] MAHMUD S A, HIRASAWA T, SHIMIZU H, et al. SB-P2-High constitutive trehalose is required for resistance to multiple stresses in Saccharomyces cerevisiae[J]. Journal of Bioscience and Bioengineering, 2009, 108(S1):S169.
[6]趙永斌, 于長春, 李新華.工業生產中豬血溶血因素的研究[J].吉林師范大學學報(自然科學版), 2015, 36(4):138-141.
[7]王芳.紅細胞制品儲存期末溶血率的測定與分析[J].臨床輸血與檢驗, 2016, 18(1):26-27.
[8]魏蕾.保存時間對庫存去白細胞懸浮紅細胞血液指標變化的影響[J].中國醫藥指南, 2020, 18(22):15-17.
[9] YANG H, KIM W, BAE J, et al. Effects of irradiationand leukoreduction on down-regulation of CXCL-8 and storage lesion in stored canine whole blood[J]. Journal of Veterinary Science, 2019, 20(1):72-78.
[10]鄧梅英.貯存期紅細胞懸液質量變化及保存的研究概述[J].華夏醫學, 2009, 22(4):783-785.
[11]鄧梅英, 寧芳, 蔣利星.血液保存中血紅蛋白、紅細胞和紅細胞壓積參數變化[J].中國醫藥導報 , 2012, 9(18):110-111.
[12]駱群, 韓瑋, 劉景漢.海藻糖在血液保存中的作用[J].臨床輸血與檢驗, 2006, 8(3):167-170.
[13]錢明, 郭兆旺, 湯艷平.血常規標本的保存時間對測定結果的影響[J].中國實用醫藥, 2011, 6(20):57-58.
[14]李寧, 曾光群, 劉昊天, 等.全血標本保存時間對血常規結果的影響[J].中國現代醫生, 2015, 53(13):94-95, 99.
[15]鐘銳, 劉華, 王紅, 等.添加不同比例的 MAP 保存液對拉薩地區懸浮紅細胞保存質量的影響[J].中國輸血雜志, 2015, 28(7):780-783.

