阻斷T細胞
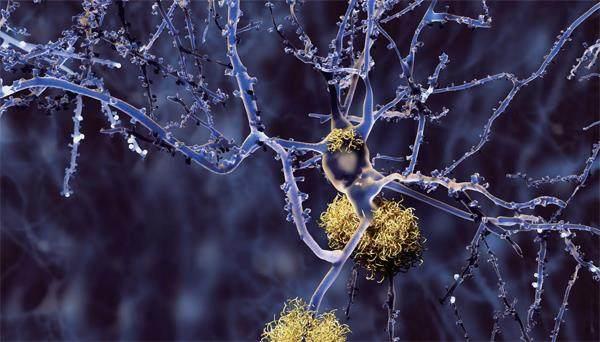
神經細胞軸突上的淀粉樣蛋白斑
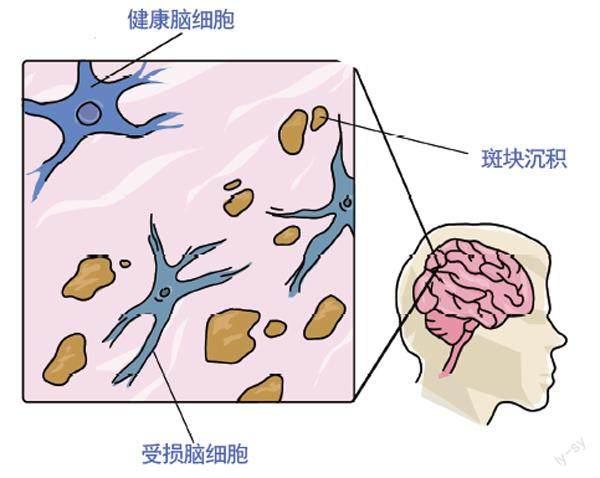
阿爾茨海默病病理(示意圖)
阿爾茨海默病很嚴重
阿爾茨海默病是一種影響記憶力、思考能力和行為能力的神經退行性疾病。它是導致癡呆的最常見疾病,而癡呆是指會干擾患者日常活動、降低其獨立生活能力的一種綜合征。阿爾茨海默病的典型特征是蛋白質在大腦中異常堆積,由此形成的蛋白斑會損害并殺死腦細胞。
隨著病情發展,阿爾茨海默病患者可能出現意識模糊、失去方向感、性格改變、表達困難的癥狀,最終導致難以執行基本身體功能。雖然目前仍無法治愈阿爾茨海默病,但通過藥物和生活方式干預有助于改善癥狀,延緩病情發展。
阿爾茨海默病的發展有兩個階段。在第一階段,淀粉樣蛋白斑開始形成。這些蛋白斑可堆積數十年,而不會對腦健康有明顯影響。但最終,τ蛋白開始聚集,這標志著第二階段開始。自此,病情迅速惡化:大腦萎縮,神經細胞死亡,神經退化蔓延,患者開始出現思考和記憶困難。
T細胞在其中很關鍵
科學家已經對小神經膠質細胞(大腦的常駐免疫細胞)及其在阿爾茨海默病中的作用進行了深入探索。隨著淀粉樣蛋白斑的堆積,這些細胞被激活但功能失調,而一旦τ蛋白開始聚集,小神經膠質細胞功能失調更嚴重,由此引起神經退化程度加重,病程便會加速。
但除了小神經膠質細胞之外,還有沒有其他免疫細胞會加重神經退化呢?為尋找答案,科學家最近檢測了模擬人類阿爾茨海默病的轉基因實驗鼠的腦中免疫細胞,目的是尋找在病情發展過程中免疫細胞群體的改變。
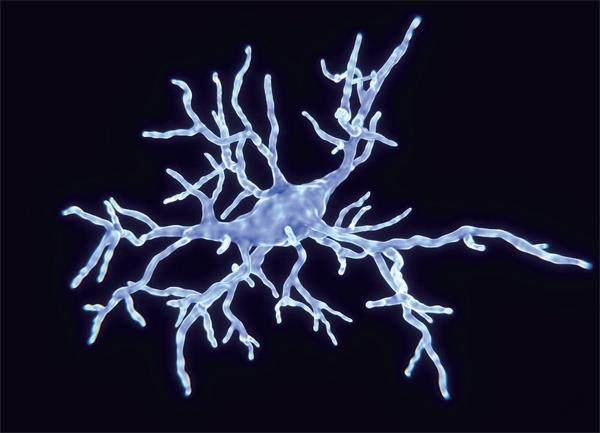
小神經膠質細胞(示意圖)
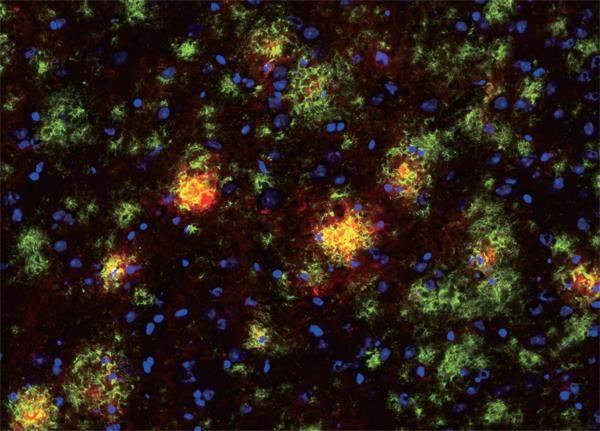
在這幅阿爾茨海默病實驗鼠腦部的免疫熒光照片中,綠色為淀粉樣蛋白斑,紅色為小神經膠質細胞
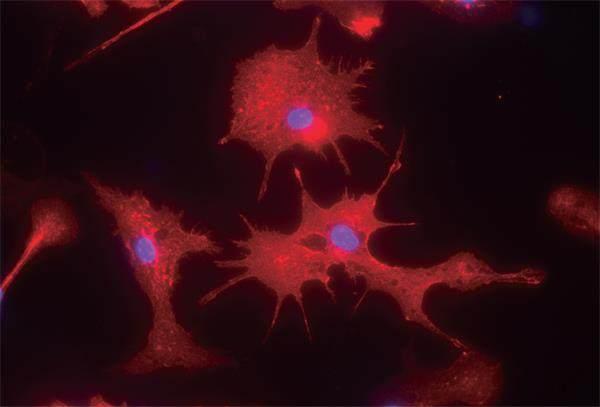
這幅免疫熒光照片顯示了分離自阿爾茨海默病實驗鼠腦部的小神經膠質細胞
為了模擬病情處于不同階段的阿爾茨海默病患者,科學家讓其中兩組實驗鼠出現廣泛的淀粉樣蛋白沉積,但它們沒有出現腦萎縮。代表晚期病情階段的第三組實驗鼠,在出生后九個半月就出現τ蛋白堆積、腦萎縮、神經退化和行為異常。第四組實驗鼠沒有出現任何蛋白堆積,也沒有出現認知能力下降,它們作為對照組。
科學家發現,與腦中淀粉樣蛋白堆積的實驗鼠或對照組實驗鼠比較,腦中τ蛋白堆積的實驗鼠腦中的T細胞多得多,而且在神經退化最嚴重和小神經膠質細胞濃度最高的腦區T細胞最多。科學家也注意到,在死于阿爾茨海默病的患者大腦中,τ蛋白堆積和神經退化的腦區中T細胞也最多。
對實驗鼠的進一步研究發現,小神經膠質細胞和T細胞這兩類免疫細胞共同創造了一種會促進神經損傷的炎性環境。小神經膠質細胞釋放的化合物會把T細胞從血液中吸引到大腦中并激活它們;T細胞釋放的化合物則推動小神經膠質細胞進入更能促進發炎的模式。一旦清除小神經膠質細胞或T細胞,切斷兩者之間的“惡毒”聯系,腦損傷程度就明顯降低。例如,當腦中τ蛋白堆積的實驗鼠被給予一種抗體以消除腦中的T細胞,它們腦中的炎性小神經膠質細胞就減少了,神經退化和腦萎縮程度降低,筑巢能力和記憶力明顯提升。
拓寬治療思路
目前有超過20項與免疫系統有關的阿爾茨海默病臨床試驗正在進行中,這凸顯了對科學家來說越來越重要的一個事實:免疫過程在引發阿爾茨海默病等疾病的過程中有重要作用。正在研發的許多阿爾茨海默病免疫藥物都是針對小神經膠質細胞,因為這些細胞在錯誤時間被激活或以錯誤方式被激活都會損傷腦組織。
上述新研究則發現,如果能阻止T細胞進入大腦,就能大大減輕神經退化。這個事實讓科學家興奮,因為雖然他們已經付出大量努力來尋找通過影響τ蛋白或小神經膠質細胞來防治神經退化的療法,但之前他們并未調查過T細胞在這當中的作用。也就是說,科學家現在找到了一種認識和防治阿爾茨海默病的新策略。
T 細胞是“雙刃劍”:既有好作用,也有不好的作用(示意圖)
現有的阿爾茨海默病藥物療效有限(示意圖)
上述新發現可能意味著,預防神經退化、治療阿爾茨海默病及與τ蛋白有關的其他疾病的一個新途徑,就是針對T細胞。事實上,這個新途徑有可能帶來該類型治療方面的大變革。在這項新研究之前,科學家已經知道該類型病患者大腦中的T細胞數量明顯增加,但他們并不確定這些T細胞是不是神經退化的誘因。
目前已有針對T細胞的藥物被廣泛使用,例如芬戈莫德常被用來治療大腦和脊髓的一種自體免疫疾病——多發性硬化癥。科學家推測,作用于T細胞、在動物實驗中很有效的一些藥物可能將進入阿爾茨海默病等神經退行性疾病的臨床試驗。
NR與阿爾茨海默病
一種天然膳食補充劑——煙酰胺核糖(簡稱NR)在進入人體后很容易轉化為煙酰胺腺嘌呤二核苷酸(簡稱NAD+),而NAD+對于細胞修復和受損DNA的修復很重要。隨著人體衰老或患上慢性病,人體內的NAD+會逐漸減少。NAD+的減少還被認為與肥胖、吸煙等有關。
最近,科學家在一項研究中發現,人在攝入NR之后血液中的NAD+含量會上升。但不清楚的是,NR是否會進入人體的其他組織。還有一些研究發現,NR能降低血壓。但對于NR能否進入大腦等器官并具有治療效應,科學家也不清楚。
測量大腦中NAD+水平的難度很大。核磁共振等技術在這方面有用,但只能間接測量,而且操作難度高,費用也高。而在最近進行的一項新實驗中,科學家測量的是源自神經元、最終進入血液中的一些微粒——細胞外囊泡中的NAD+。這些囊泡能提供大腦疾病的血液標志物,并能提供神經元的“活檢”結果,讓科學家能很難得地一窺神經元內部信息。
科學家說,每個細胞外囊泡在其表面都有一個獨特的分子標志,這些包括蛋白質在內的標志能提供囊泡的來源線索。在新實驗中,科學家選擇的囊泡都攜帶大腦神經元特征的標志物,因此科學家能確定在這些囊泡中測到的NAD+水平能反映神經元內部的情況,也就是能反映大腦內的情況。
科學家檢測首批臨床試驗的樣本后發現,細胞外囊泡中NAD+的水平在人體攝入NR六周后升高,而神經退化的一些生物標志物也發生了改變。尤其是在NAD+增多的人身上,與阿爾茨海默病有關的淀粉樣蛋白和τ蛋白等生物標志物發生了改變。
科學家還發現,神經退化的生物標志物與NAD+含量直接相關。如果NAD+含量上升,疾病的生物標志物改變更大。這說明NAD+不僅進入了大腦,而且有可能對代謝及多個互相關聯的通道有正面作用。
這些血液標志物中的一部分可能被用來確定NAD+缺失是否為阿爾茨海默病及其他神經退化性疾病的原因之一。在不久的將來,這類測試有可能變得大眾化。
科學家已開始一項為期12周的給予認知輕度損傷的老年人以NR的實驗,由此觀察NR是否對減輕認知能力下降有效。目前所有的阿爾茨海默病藥物效果都不太明顯,不能阻止病情發展。因此,進行這項新研究的科學家希望NR最終能被證明對改善阿爾茨海默病等疾病的癥狀及病程有作用。

