野生松鼠源屎腸球菌的致病性與耐藥性分析
胡秀花,孫芷馨,趙夢洋,謝佳琪,王 敏,陳海良,葛 昕,劉天龍*,王少林*
(1.中國農業大學動物醫學院,獸醫公共衛生安全全國重點實驗室,北京 100193;2.嶺南現代農業科學與技術廣東省實驗室,廣州 510642;3.北京野生動物園,北京 102602)
腸球菌屬于革蘭陽性菌,呈圓形或橢圓形,廣泛存在于人和動物的消化道中,屬于條件致病菌[1-2]。腸球菌不僅可引起尿路感染、皮膚軟組織感染,還可引起危及生命的腹腔感染、敗血癥、心內膜炎和腦膜炎等[3],目前已成為院內感染的主要病原菌之一,其中最主要的病原菌為糞腸球菌和屎腸球菌,約占腸球菌感染的90%[4]。
腸球菌因其特殊的生物學特性,對臨床常用的多數β-內酰胺類、氨基糖苷類等抗菌藥物具有天然耐藥性,同時由于臨床抗菌藥物的不規范使用,腸球菌在抗菌藥物的選擇性壓力下進化出多種耐藥機制,使腸球菌的臨床耐藥情況變得更為嚴峻。而隨著人醫臨床多重耐藥腸球菌感染率的升高及耐萬古霉素腸球菌(VRE)的出現,腸球菌感染在臨床治療中的困難程度逐漸加大[5-6]。在2015—2020年的中國細菌耐藥監測(CARST)中,人醫臨床上耐萬古霉素腸球菌(VRE)的檢出率均在1.5%以上,而在這些檢出VRE中,屎腸球菌的比例普遍高于糞腸球菌[7-9]。同樣,在獸醫臨床中,豬、禽、羊等動物中分離到的腸球菌也普遍存在多重耐藥特征[10-16]。此外,研究表明,腸球菌可在人源和動物源之間進行傳播[17],這無疑對人類健康構成了一定的威脅,因此做好動物源的腸球菌監測工作十分必要。
腸球菌致病能力主要是依靠其毒力因子及生物被膜的產生。目前已發現的毒力因子包括細胞溶血素、心內膜炎抗原、蛋白明膠酶等。動物源腸球菌普遍同時攜帶多種毒力基因,尤其在患病動物中[18-19]。而近年來,動物因感染腸球菌死亡的報道不斷增多[20-23],其中也包括野生動物感染屎腸球菌發病的報道[24-25],提示野生動物園管理者要對腸球菌感染引起一定的重視。
本研究通過對北京野生動物園一只突發死亡的成年雄性赤腹松鼠進行病理剖檢及細菌學鑒定,并對分離得到的屎腸球菌進行致病性和耐藥性分析,以期為野生松鼠的疾病治療和預防提供重要的參考依據。
1 材料與方法
1.1 材料
1.1.1 病料 動物來源于北京大興野生動物園獸醫院,采集病死赤腹松鼠的心、肝、脾、肺、腎以及腹腔積液。
1.1.2 主要培養基及試劑與儀器 腦心浸液瓊脂培養基(BHA)、腦心浸液肉湯培養基(BHI)購自北京陸橋生物科技有限公司;血清型引物、16S通用引物均購自北京擎科生物科技有限公司;1×Taq酶,瓊脂凝膠粉,GL2000 Marker均購自北京擎科生物科技有限公司;細菌基因組提取試劑盒購自北京創優美生物科技有限公司;腦心浸液瓊脂培養基(BHA)、腦心浸液肉湯培養基(BHI)均按照培養基說明書進行配制。
1.2 方法
1.2.1 病理剖檢 對死亡赤腹松鼠進行大體剖檢觀察并進行記錄,并對動物的肝、脾、肺、心、腎等主要臟器進行取樣后置入4%甲醛固定,48 h后進行石蠟切片及HE染色并在光學顯微鏡下進行組織病理學觀察。
1.2.2 細菌分離鑒定 使用無菌接種環將死亡赤腹松鼠肝、脾、肺、心、腎無菌接種于普通營養瓊脂,37 ℃恒溫培養18~24 h后觀察瓊脂板上細菌生長情況,挑取不同形態的單一菌落在BHA進行純化培養,挑取純化后單一菌落至BHI中37 ℃、200 r·min-1培養18~24 h。后將純化好的分離菌株送北京諾賽測序公司進行菌種鑒定。
1.2.3 基因組提取 按照細菌基因組提取試劑盒方法提取分離菌株基因組。
1.2.4 種屬基因及毒力基因擴增 16S特異性基因、毒力基因esp、agg、gelE、cylA、cylB、cylM、efaAfs、efaAfm、ASA、CYT、ace引物參考文獻[25-28]設計,由北京擎科科技有限公司合成,引物信息如表1。PCR擴增體系25 μL:模板1 μL,上、下游引物各0.5 μL,滅菌水10.5 μL,2×TaqMaster Mix 12.5 μL。擴增條件:95 ℃預變性5 min;95 ℃變性1 min、退火(退火溫度如表1)30 s、72 ℃延伸90或45 s(16S rRNA和agg基因引物為90 s,其他為45 s),30個循環;72 ℃再延伸10 min。
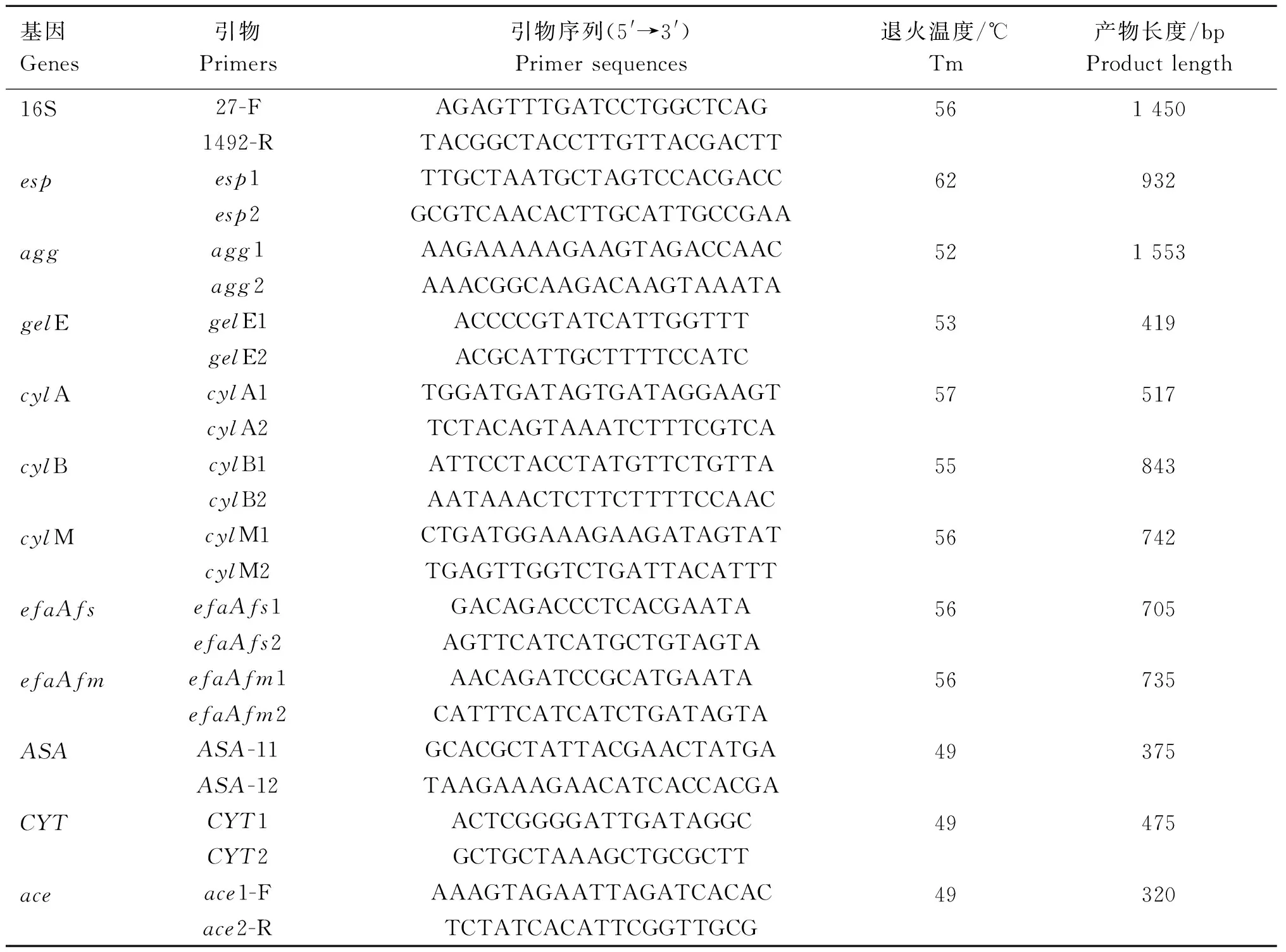
表1 引物信息Table 1 Primer information
1.2.5 藥物敏感性試驗 按照CLSI (M100 S2 6、 M45 A2、 VET01 A4)標準中微量肉湯稀釋法進行藥敏試驗,質控菌株為糞腸球菌ATCC 29212。
1.2.6 全基因組測序 分離菌株按照分離部位分別命名為CFSS2012-G、CFSS2012-Fei、CFSS2012-Fu和CFSS2012-P。試劑盒提取分離菌株的基因組送北京賽默百合科技有限公司進行全基因組測序,使用SPAdes 3.9.0軟件進行拼接,后將全基因組序列在CGE(Center for Genomic Epidemiology)網站上進行MLST、毒力基因及耐藥基因的搜索比對,并使用Harvast 1.1.2進行核心基因組單核苷酸多態性(SNPs)分析。
1.2.7 致病性試驗 從4株屎腸球菌中選取其中一株作為代表株進行動物致病性試驗。選取6~8周齡SPF級的BALB/c雌鼠共32只,每組8只,分為4組,根據預試驗結果分別設攻菌劑量為1×109、2×109、4×109CFU的試驗組和對照組;試驗組每只小鼠注射0.5 mL菌液,對照組每只小鼠注射0.5 mL的PBS (pH 7.2~7.4)。每隔24 h對所有小鼠觀察一次,觀察一周。觀察期間對死亡小鼠進行剖檢,并在無菌條件下對其肺、肝、脾以及腹腔進行病原菌分離。
2 結 果
2.1 病理剖檢觀察
大體病變可見,肺腫大,肺左葉有一黃豆大小的氣腫且存有一定程度的自溶(圖1A);腹壁和腹腔部分臟器發黑,右腎腫大(圖1B);脾發黑質軟(圖1C);腹腔內有少量積水(圖1D)。
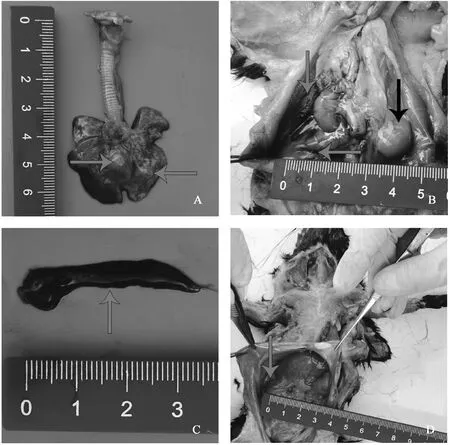
A. 肺(紅色箭頭所指為肺氣腫部位);B. 腎(紅色箭頭所指為腎發黑部位,黑色箭頭所指為腫大的右腎);C. 脾(紅色箭頭所指可見脾發黑);D. 腹腔(紅色箭頭所指為腹腔積水)。掃描文章首頁OSID碼可查看彩圖A. Lung (the red arrow points to the emphysema); B. Kidney (red arrow points to the blackened part of the kidney, black arrow points to the enlarged right kidney); C. Spleen (the red arrow points to the blackened spleen); D. Abdominal cavity (the red arrow points to the hydroperitoneum).The color pictures can be found by scanning the OSID code on the front page of the article圖1 肺、腎、胸腔、腹腔大體剖檢示意圖Fig.1 Schematic diagram of the gross autopsy of the lungs, kidneys, thoracic cavity and abdominal cavity
組織病理學檢查結果顯示,低倍鏡下,肺可見部分肺泡腔融合形成大的“空洞”(圖2A藍色箭頭),肺泡腔內可見大量纖維素樣滲出物(圖2A棕色箭頭),細胞成分增多,局部可見藍染的細菌菌叢(圖2A黑色箭頭),血管內可見大量炎性細胞以及紅細胞(圖2A綠色箭頭);腎臟可見腎間質內藍染的細菌菌叢(圖2C黑色箭頭),部分腎小管喪失了原有結構(圖2C紅色箭頭)。高倍鏡下,肺臟小血管內可見藍染的成串狀的菌叢(圖2B黑色箭頭),肺泡腔內含有大量粉染的纖維素樣滲出物和巨噬細胞、漿細胞、淋巴細胞等炎性細胞(圖2B藍色箭頭);腎可見藍染的細菌菌叢(圖2D黑色箭頭)主要位于腎間質,部分腎小管上皮細胞脫離基底膜(圖2D藍色箭頭)。肝、脾、心等臟器未見明顯異常。
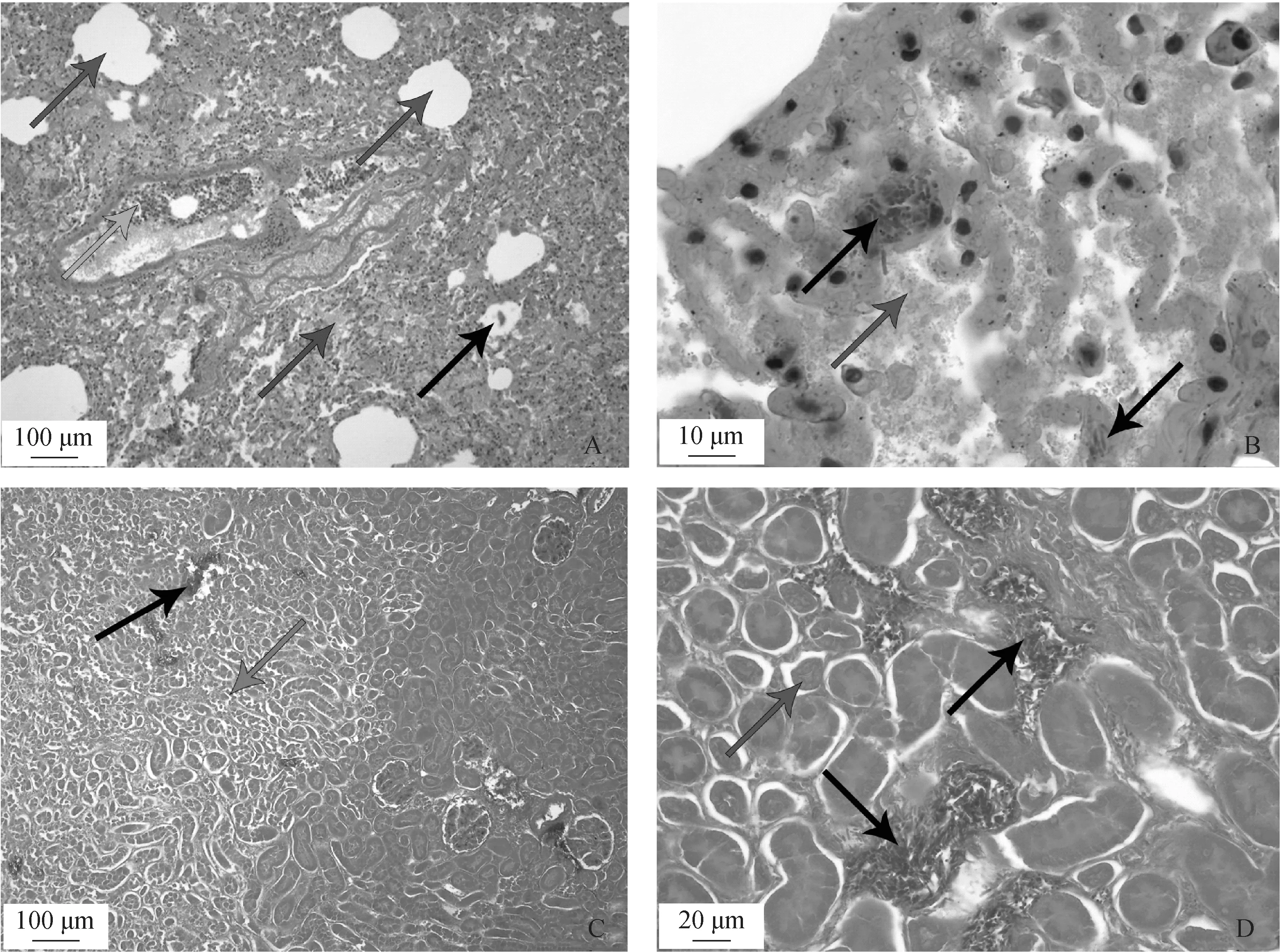
A. 肺(標尺=100 μm)(藍色箭頭所指為低倍鏡下由肺泡腔融合形成的“空洞”,棕色箭頭所指為低倍鏡下纖維素樣滲出物,黑色箭頭所指為低倍鏡下藍染菌叢,綠色箭頭所指為低倍鏡下大量炎性細胞及紅細胞);B. 肺(標尺=10 μm)(黑色箭頭所指為高倍鏡下肺小血管內藍染串狀菌叢,藍色箭頭所指為高倍鏡下肺泡腔內粉染纖維素滲出物和炎性細胞);C. 腎(標尺=100 μm)(黑色箭頭所指為低倍鏡下藍染菌叢,紅色箭頭所指為低倍鏡下失去原有結構的腎小管);D. 腎(標尺=20 μm)(黑色箭頭所指為高倍鏡下腎間質內藍染菌叢,藍色箭頭所指為高倍鏡下脫離基底膜的腎小管上皮細胞)。掃描文章首頁OSID碼可查看彩圖A.Lung (bar=100 μm) (blue arrows point to the "cavities" formed by the fusion of alveolar spaces under low magnification, brown arrow points to fibrinoid exudates under low magnification, black arrow points to Blue-stained flora under low magnification, green arrow points to a large number of inflammatory cells and red blood cells under low magnification); B. Lung (bar=10 μm) (black arrows point to blue-stained streak flora in small blood vessels of the lung under high magnification, and blue arrow points to powder-stained fibrin exudates and inflammatory cells in alveolar cavity under high magnification) ; C. Kidney (bar=100 μm) (black arrow points to blue-stained flora under low magnification microscope, red arrow points to renal tubule that has lost its original structure under low magnification microscope); D. Kidney (bar=20 μm) (black arrows point to the blue-stained flora in the renal interstitium under high magnification microscope, and the blue arrow points to the renal tubular epithelial cells detached from the basement membrane under high magnification microscope).The color pictures can be found by scanning the OSID code on the front page of the article圖2 高低倍鏡下腎、肺的組織切片示意圖Fig.2 Schematic diagram of tissue sections of kidney and lung under high and low magnification
2.2 菌株鑒定
在BHA純化培養之后可見形態單一,大小均等的白色不透明菌落。革蘭染色可見圓形或橢圓形、呈單個或成對或短鏈狀排列的革蘭陽性球菌。16S rDNA序列在GenBank上Blast比對結果顯示:與NCBI登載的GenBank中屎腸球菌的16S rDNA序列相似性均在98%~99%。
2.3 種屬基因及毒力基因檢測
16S PCR擴增出1 450 bp的片段,與屎腸球菌大小一致,毒力基因PCR擴增出efaAfm的條帶,片段大小為735 bp。PCR擴增圖如圖3、4所示。
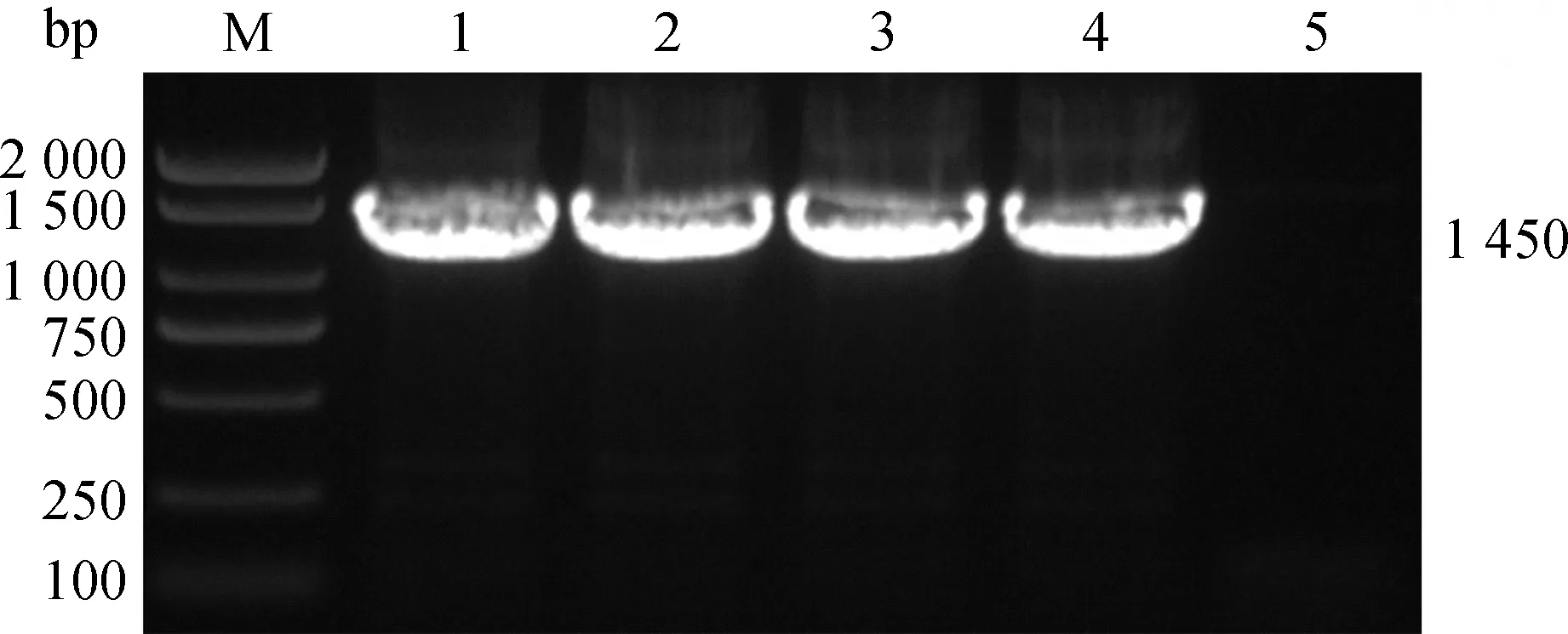
M. DL2000 DNA相對分子質量標準;1. 肺;2. 腹腔;3. 肝;4. 脾;5.陰性對照M. DL2000 DNA marker;1.Lung;2.Abdominal cavity;3.Liver;4.Spleen;5.Negative control圖3 16S PCR鑒定結果Fig.3 16S PCR identification results
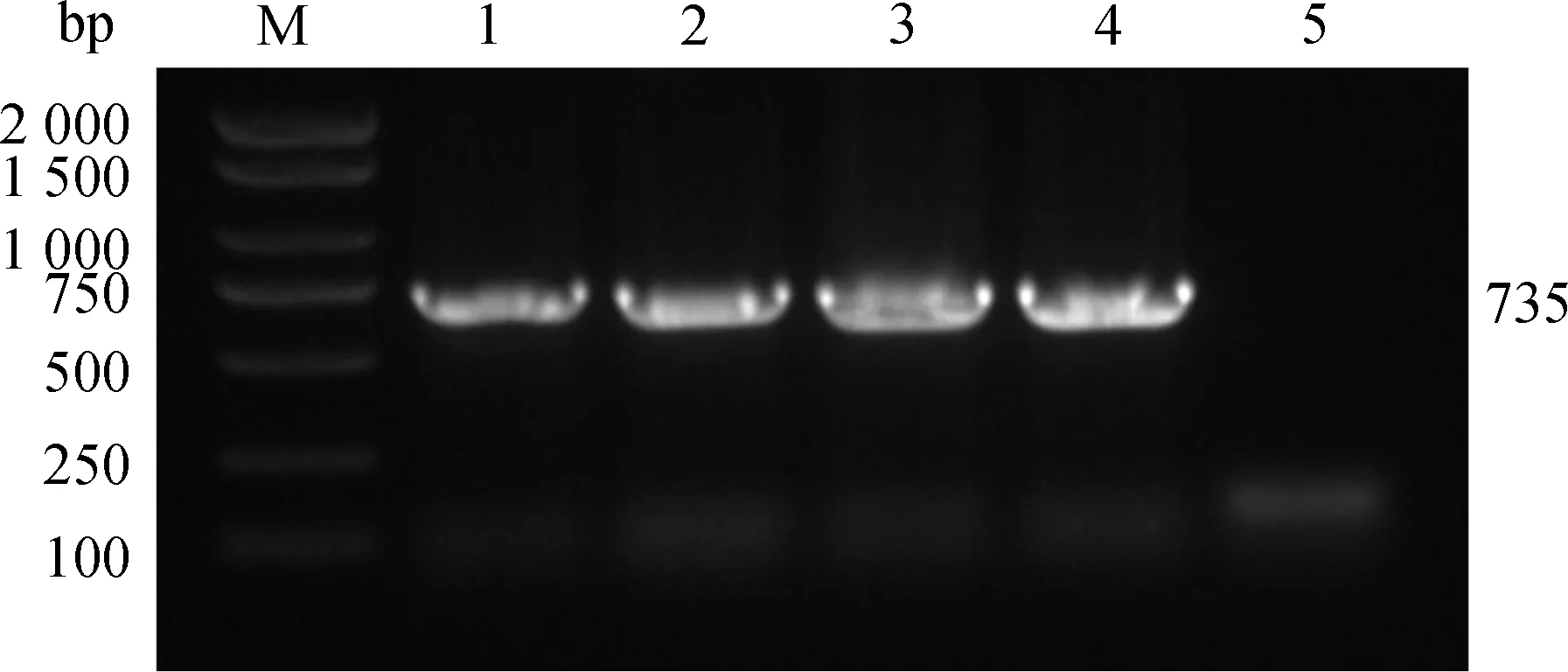
M. DL2000 DNA相對分子質量標準;1. 肺;2. 腹腔;3. 肝;4. 脾;5.陰性對照M. DL2000 DNA marker;1. Lung;2. Abdominal cavity;3.Liver;4. Spleen;5. Negative control圖4 efaAfm毒力基因PCR鑒定結果Fig.4 efaAfm virulence gene PCR identification
2.4 耐藥表型判定
參考CLSI(M100 S2 6、 M45 A2、 VET01 A4)標準判定細菌藥物敏感性,結果表明4株菌株的藥敏試驗結果完全一致,如表2所示,均對磺胺異惡唑、泰妙菌素高度耐藥,對紅霉素、克林霉素、頭孢西丁、氧氟沙星、替米考星、四環素低度耐藥,對青霉素、恩諾沙星、頭孢噻呋、萬古霉素、多西環素、氟苯尼考、慶大霉素、利奈唑胺、苯唑西林、復方新諾明敏感,質控菌株糞腸球菌ATCC 29212藥敏結果在質控范圍內。
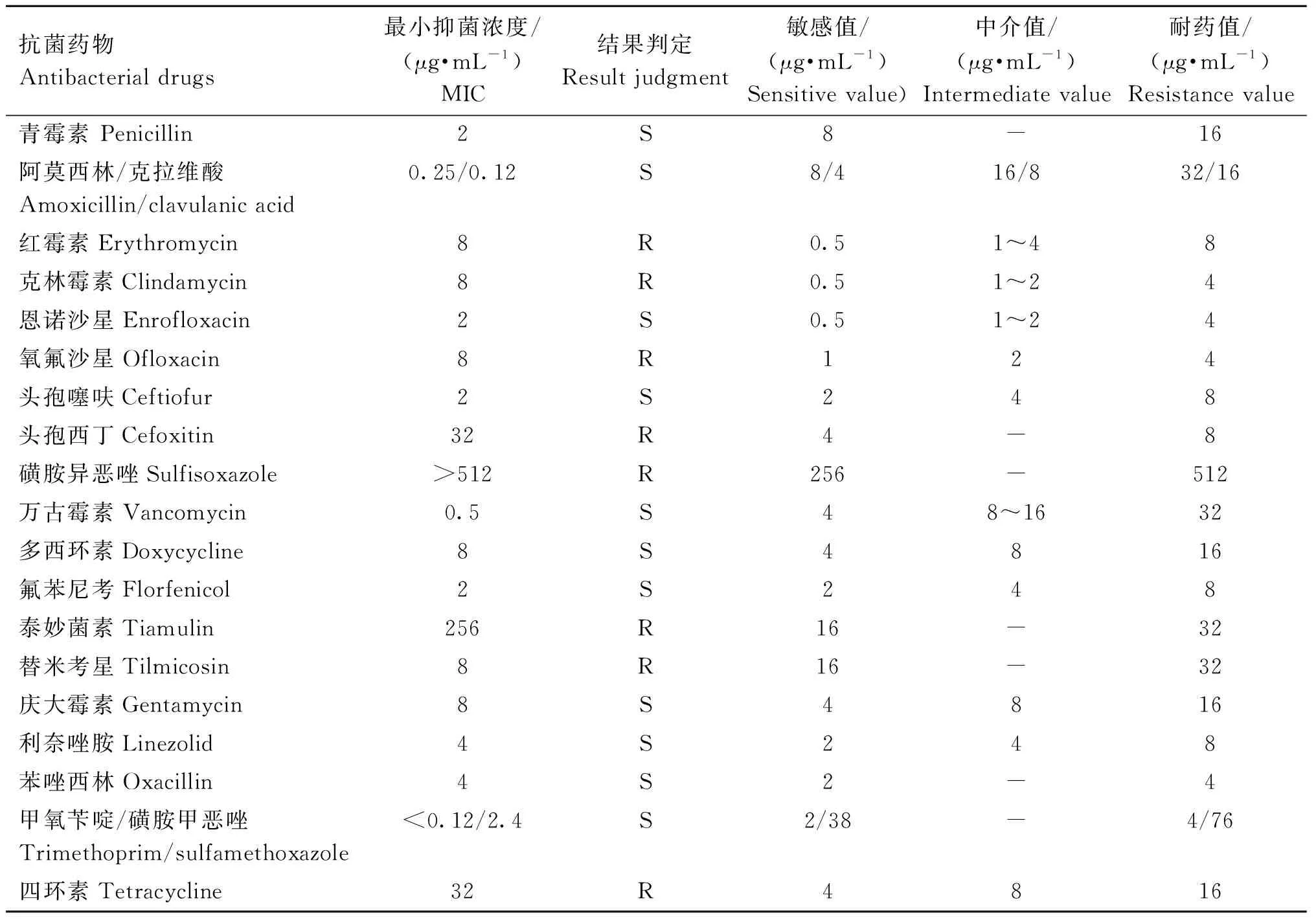
表2 藥敏試驗結果Table 2 Bacterial susceptibility test results
2.5 全基因組數據分析
全基因組序列分析顯示,4株屎腸球菌均屬于ST-324型,且菌株之間SNPs ≤22,如圖5所示;毒力基因和耐藥基因比對結果顯示,菌株均攜帶毒力基因efaAfm和acm、四環素耐藥基因tetM及大環內酯類耐藥基因msrC,與毒力基因PCR擴增結果及藥敏結果基本保持一致。

圖5 不同臟器分離菌株的SNP差異Fig.5 SNP differences of strains isolated from different organs
2.6 致病性分析
1×109CFU劑量組小鼠攻菌24 h后呈現被毛凌亂,精神萎靡狀態,后慢慢恢復正常狀態,未見死亡情況,1周后對1×109CFU劑量組未死亡小鼠剖檢可見肝表面蒼白,細菌分離可見屎腸球菌典型菌落生長,其他臟器未見明顯變化,未分離出細菌;2×109CFU劑量組小鼠攻菌24 h后精神萎靡,被毛凌亂,眼部出現黏液,48 h后全部死亡,后進行剖檢可見大腸充滿氣體,肝、脾出現淤血現象,細菌分離可見屎腸球菌典型菌落生長;4×109CFU劑量組所有小鼠攻菌24 h后全部死亡,身體呈現四肢僵硬,眼部分泌有較多黏液,進行剖檢可見小鼠肝、脾、肺均出現淤血現象,大腸被大量氣體充滿,細菌分離可見屎腸球菌典型菌落生長;對照組未見典型菌落生長。由試驗組3個不同劑量的試驗結果可知,分離屎腸球菌的半數致死量為1×109~2×109CFU,具有一定的致病性。
3 討 論
本研究從野生動物園死亡赤腹松鼠的肝、肺、脾以及腹腔積液中分離鑒定到4株屎腸球菌,全基因組測序分析顯示同屬于ST-324型,且SNPs差異較小,該型在人類醫院臨床中曾被報道過[29-30],動物源中尚未見有該型的相關報道。藥敏結果顯示分離菌株對大環內酯類、四環素類等具有一定的耐藥性,這或許與分離菌株攜帶四環素耐藥基因tetM和大環內酯類耐藥基因msrC有關。tetM是腸球菌的一種核糖體保護蛋白基因,也是介導腸球菌四環素耐藥的主要基因之一[31]。msrC是腸球菌通過編碼ABC型轉座子蛋白基因,從而介導大環內酯類藥物耐藥的基因,研究表明此基因存在于大部分屎腸球菌的染色體上,而在小部分的屎腸球菌中未發現有此基因的存在[32],同時,此基因也被證明在屎腸球菌對抗大環內酯類藥物中具有保護作用,但其確切功能還有待進一步研究[33]。此外,藥敏結果顯示分離菌株對磺胺類、截短側耳類藥物具有高耐藥表型,但全基因組測序并未發現有相關耐藥基因,其耐藥機制還需進一步研究。
研究表明,屎腸球菌在機體免疫力低下時可從腸道轉移至機體其他組織器官并進行黏附聚集引起機體發病[34-35]。而在本研究中全基因組測序發現,分離菌株攜帶毒力基因efaAfm的同時還攜帶acm基因。efaAfm基因是一種主要編碼屎腸球菌心內膜炎抗原的可促進腸球菌在宿主體內定殖的毒力因子[36];acm基因編碼的黏附素主要在宿主細胞受損時發揮作用,能夠介導屎腸球菌黏附膠原蛋白和層黏連蛋白,定植宿主體內,從而引起感染[37]。這兩種毒力基因的存在無疑在一定程度上增加了屎腸球菌入侵動物機體的能力。
由于微生物培養只在有氧條件下進行了細菌培養,故不能排除厭氧菌及其他微生物致病的可能性,但動物致病性試驗顯示分離菌株具有一定的致病性,在不良的生活環境下(如寒冷、饑餓或打架受傷)仍具有感染機體致病的潛在風險,提醒野生動物園工作人員要加強對野生赤腹松鼠的飼養環境管理。同時,本研究為野生動物園內赤腹松鼠屎腸球菌感染的研究提供了相關數據,為野生動物園預防赤腹松鼠屎腸球菌感染提供一些科學依據,也為其他野生動物的細菌性感染疾病的診斷提供參考。
4 結 論
本研究從死亡赤腹松鼠內臟組織中分離到屎腸球菌,經全基因組測序分型鑒定均為ST-324,致病性試驗表明分離菌株具有一定的致病能力,結合組織病理學檢查結果推測,赤腹松鼠死亡原因為屎腸球菌入侵機體內多器官并進入血液循環,從而引起機體敗血癥導致宿主死亡。

