分離自屠宰場的肺炎克雷伯菌的耐藥性分析
趙菲菲,李 杰,韓 寧,謝仕廷,曾振靈*
(1.華南農業大學獸醫學院,廣州 510642;2.廣東省獸藥研制與安全評價重點實驗室,廣州 510642;3.國家獸醫微生物耐藥性風險評估實驗室,廣州 510642)
肺炎克雷伯菌(Klebsiellapneumonia) 屬腸桿菌科、克雷伯菌屬的革蘭陰性菌,兼性厭氧,無鞭毛,有較厚的莢膜,已成為僅次于大腸埃希菌的第二大條件致病菌[1]。近年來,由于飼養管理不規范、免疫抑制性疾病頻發、濫用抗生素、畜舍飼養密度不合理等,肺炎克雷伯菌對常用抗菌藥物的耐藥性日益嚴重,不但呈現多重耐藥(multidrug resistant,MDR)現象,且分離率呈逐年上升趨勢[2-3],因而限制了細菌感染的治療選擇。同時,肺炎克雷伯菌可致使豬、牛、羊、雞、水貂、狐貍等動物及人發病,臨床上通常表現為腦膜炎、肺炎、敗血癥、支氣管炎等多種病癥,造成巨大的經濟損失[4-6]。
1875年,Edwin Klebs首次在一例肺炎患者的氣道分泌物中分離得到肺炎克雷伯菌;1882年,肺炎克雷伯菌由德國微生物學家和病理學家Carl Friedlander首次報道,因此該細菌一度被稱為Friedl?nder菌[7];1989年和1990年夏秋季,C型肺炎克雷伯氏桿菌病在福建省福州地區部分豬場暴發[8];高倞[9]對河南駐馬店地區患呼吸道疾病豬肺、鼻拭子等74份樣本中分離得到43株肺炎克雷伯菌,研究發現菌株對氨芐西林、阿莫西林、大觀霉素等7種藥物耐藥性較高,耐藥率均在51.2%以上,且呈現多重耐藥性。歐冠標等[10]對廣西南寧地區采集存欄生豬肛拭子樣品125份及宰后生豬肉類樣品50份,分別分離得到32及4株肺炎克雷伯菌,發現其對四環素、氯霉素耐藥性最高。譚耀榮等[11]從發病母豬組織中分離得到一株肺炎克雷伯菌,菌株接種在血瓊脂培養基上會發生α溶血現象,且具有多重耐藥性,能夠使小鼠在22 h內死亡,表明其具有嚴重的耐藥性和強致病性。
為了解豬源肺炎克雷伯菌的耐藥情況,本試驗2021年3月從廣州市白云區某屠宰場采集豬肺樣本150份,通過對菌株的形態學觀察、khe基因PCR檢測,篩選并鑒定出116株肺炎克雷伯菌。通過對116株肺炎克雷伯菌血清型、耐藥性、耐藥基因和毒力基因進行檢測,為豬源肺炎克雷伯菌的防控提供參考依據。
1 材料與方法
1.1 試驗材料
1.1.1 樣品來源 本試驗在2021年3月于廣州市白云區某屠宰場(豬來源于廣東省、湖南省和江西省)采集豬肺樣本150份,質控菌株大腸埃希菌ATCC 25922由本藥理教研室保存。
1.1.2 主要試劑 LB營養肉湯、麥康凱肌醇阿東醇羧芐西林均購于海博生物技術有限公司,MH瓊脂購于廣東環凱微生物科技有限公司,引物、DNA Marker均購于擎科生物技術有限公司,2×PCR Mix購于東盛生物科技有限公司,核酸染料購于廣州藍澤生物科技有限公司,革蘭染色液購于北京索萊寶科技有限公司,瓊脂糖購于西班牙Biowest公司,氨芐西林(含量96.0%)、美羅培南(含量98.0%)、四環素(含量95.0%)等均購于大連美倫生物技術有限公司。
1.1.3 主要儀器 渦旋儀購于杭州海沛儀器有限公司,恒溫搖床購于上海智城分析儀器制造有限公司,PCR儀購于蘇州東勝興業科學儀器有限公司,核酸電泳儀購于上海天能科技有限公司,數控恒溫培養箱、高速冷凍離心機等均購于賽默飛世爾科技公司。
1.2 試驗方法
1.2.1 細菌的分離與純化 無菌操作取豬肺樣本置于LB營養肉湯中,恒溫37 ℃、180 r·min-1培養12~16 h用于增菌,再將菌液劃線接種于麥康凱肌醇阿東醇羧芐西林瓊脂培養基,置于37 ℃恒溫培養箱中,培養18 h后挑取呈粉色、菌落濕潤、黏液樣、拉動呈絲狀的疑似菌落轉接于麥康凱肌醇阿東醇羧芐西林瓊脂培養基中進行純化,最后挑取純化后的單菌落于麥康凱肌醇阿東醇羧芐西林瓊脂中進行增菌培養,刮取菌苔于30%甘油肉湯中,-20 ℃保存,備用。
1.2.2 形態學觀察 一般通過革蘭染色進行形態學觀察及鑒別菌株。取擦拭干凈的載玻片,滴加一滴生理鹽水,取純培養在麥康凱肌醇阿東醇羧芐西林瓊脂培養基中的單菌落涂布在載玻片中,烤片固定,經結晶紫初染(1 min,水洗)、碘液媒染(1 min,水洗)、95%乙醇脫色(20 s,水洗)、番紅液復染(2 min,水洗)后,鏡檢觀察菌株形態。
1.2.3 樣品DNA提取 利用煮沸法[12]提取細菌DNA模板。取增菌培養的菌液50 μL復蘇后,置于103 ℃恒溫金屬浴中加熱15 min,轉放-20 ℃冰箱中冰浴15 min,高速冷凍離心機中12 000 r·min-1離心2 min,吸取上清液,即為DNA模板,-20 ℃保存,備用。
1.2.4 細菌PCR鑒定 參照參考文獻[13]報道的特異性引物(表1),以提取的樣品DNA模板進行khe基因擴增,預擴增片段大小為428 bp。PCR擴增體系(總體積為20 μL):2×PCR Mix 10 μL,上、下游引物各0.5 μL,DNA模板2 μL,ddH2O 7 μL。PCR擴增程序:95 ℃預變性5 min;95 ℃變性30 s,54 ℃退火30 s,72 ℃延伸30 s,共30個循環;72 ℃再延伸5 min,4 ℃保存。擴增后反應產物經1%的瓊脂糖電泳檢測,將陽性產物送至廣州擎科生物技術有限公司進行測序。

表1 細菌分離鑒定及血清型分型引物Table 1 Primers for bacterial isolation, identification and serotype identification in this study
1.2.5 血清型分型 根據文獻[14]設計合成引物,采用PCR方法擴增6種常見的莢膜血清型(K1、K2、K5、K20、K54、K57),引物序列見表1。PCR擴增程序:98 ℃預變性3 min;98 ℃變性15 s,Tm退火15 s,72 ℃延伸20 s,共30個循環;72 ℃再延伸5 min,8 ℃保存。擴增后反應產物經1%的瓊脂糖電泳檢測,將陽性產物送至廣州擎科生物技術有限公司進行測序,結果提交 NCBI(https://blast.ncbi.nlm.nih.gov/)比對。
1.2.6 藥敏試驗 根據美國臨床實驗室標準化委員會(CLSI)標準,以大腸埃希菌ATCC 25922為質控菌,利用瓊脂擴散法檢測13種抗菌藥物對肺炎克雷伯菌分離株的最小抑菌濃度(minimum inhibitory concentration,MIC)[15]。檢測的抗菌藥物:氨芐西林、頭孢他啶、頭孢噻肟、美羅培南、黏菌素、慶大霉素、阿米卡星、四環素、多西環素、替加環素、環丙沙星、恩諾沙星、復方新諾明。
1.2.7 耐藥基因的檢測 根據文獻[16-19]設計合成引物,對超廣譜β-內酰胺酶基因(extended spectrum β-lactamases,ESBLs)(blaCTX-M1)、碳青霉烯類耐藥基因(blaKPC-2、blaNDM-1、blaNDM-5)、四環素類耐藥基因(tetA、tetB)、磺胺類耐藥基因(sul1、sul2)、喹諾酮類耐藥基因(oqxA、qnrB、aac(6′)-Ib-cr)進行PCR擴增,PCR擴增引物序列見表2。

表2 肺炎克雷伯菌耐藥相關基因的PCR引物Table 2 PCR primers for drug-resistant genes of Klebsiella pneumoniae
1.2.8 毒力基因的檢測 根據文獻[16,20-22]設計合成引物,利用PCR擴增技術檢測8種常見的毒力基因,包括莢膜多糖生成調節基因(rmpA),鐵載體基因(entB、iucA、iroN),菌毛定植黏附基因(ycfM、fimH、mrkD),脂多糖形成相關基因(wabG),PCR擴增引物序列見表3。

表3 肺炎克雷伯菌毒力相關基因的PCR引物Table 3 PCR primers for virulence genes of Klebsiella pneumoniae
2 結 果
2.1 肺炎克雷伯菌分離及鑒定結果
無菌狀態下將分離株劃線培養于麥康凱肌醇阿東醇羧芐西林平板,可見紅色、較大且黏稠的菌落,用接種環挑取時有拉絲的現象。革蘭染色鏡檢菌體呈現紅色短桿狀,單個排列,偶見兩個鏈狀排列,符合肺炎克雷伯菌的形態特征(圖1A);樣本通過DNA提取及PCR鑒定,116個樣品擴增出大小約428 bp的特異性條帶,分離率為77.3%,測序結果經過比對分析,確定分離株為肺炎克雷伯菌(圖1B),其中,共84株檢出常見的血清型,以K57型(59株,50.9%)為主,其次為K5型(20株,17.2%)和K2型(4株,3.5%),未檢出K1、K20和K54型(圖1C)。
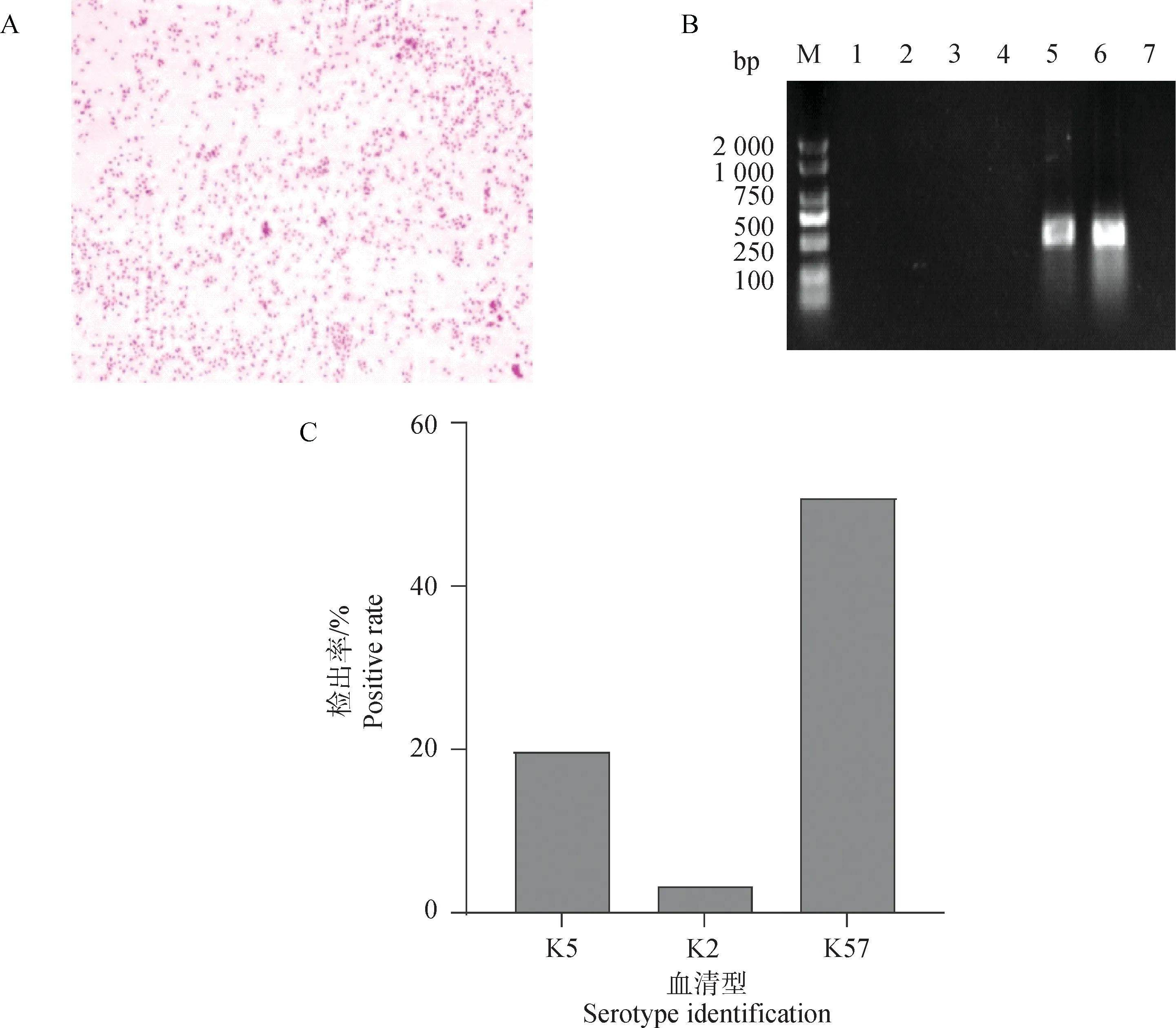
A.革蘭染色鏡檢結果(100×);B.部分分離菌株khe基因鑒定結果(M.DNA相對分子質量標準;1~7.分離菌株);C.常見血清型鑒定結果A. The results of Gram stain microscopy (100×); B. The results of khe gene identification in some isolates(M.DNA marker; 1-7. Isolates);C. The results of common serotype identification圖1 細菌分離鑒定結果Fig.1 The results of bacterial isolation and identification
2.2 藥敏試驗
通過瓊脂擴散法,對116株肺炎克雷伯菌進行13種抗菌藥物的MIC檢測。結果顯示,116株肺炎克雷伯菌分離株對四環素、多西環素、氨芐西林及復方新諾明的耐藥率較高,分別為96.6%、95.7%、95.7%及94.0%;其次是慶大霉素和環丙沙星,耐藥率均為25.0%;對頭孢噻肟、替加環素、頭孢他啶和阿米卡星的耐藥率較低,分別為4.3%、2.6%、1.7%和1.7%;對美羅培南、黏菌素和恩諾沙星均敏感(見圖2)。藥物敏感性試驗結果表明分離株多重耐藥現象較為嚴重,其中耐4種抗生素的菌株最多,占比59.5%,且僅有一株菌表現為對所有檢測藥物敏感(表4)。

圖2 肺炎克雷伯菌藥敏試驗結果Fig.2 The results of Klebsiella pneumoniae drug sensitivity test
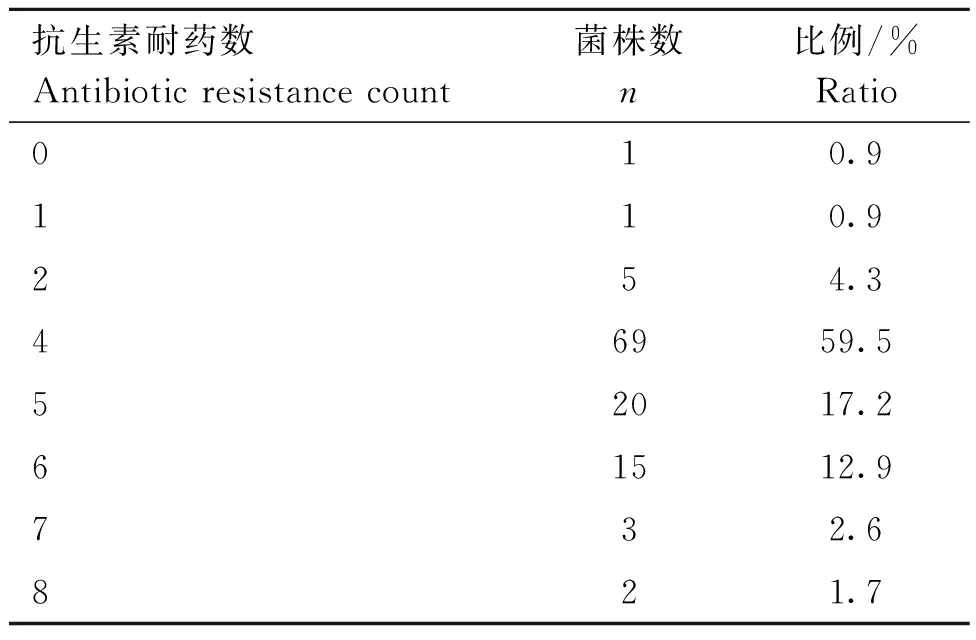
表4 分離株多重耐藥攜帶率分析結果Table 4 The results of multidrug resistance carrying rate analysis of isolates
2.3 耐藥基因檢測
本研究對116株肺炎克雷伯菌進行了常見的11個耐藥基因的檢測,結果顯示,磺胺類耐藥基因sul2的檢出率為60.3%(70/116),碳青霉烯酶基因blaNDM-1和blaNDM-5的檢出率均為0.9%(1/116),與藥敏結果中復方新諾明的高耐藥率以及美羅培南高敏感一致;喹諾酮類耐藥基因oqxA的檢出率為59.5%(69/116)(圖3)。
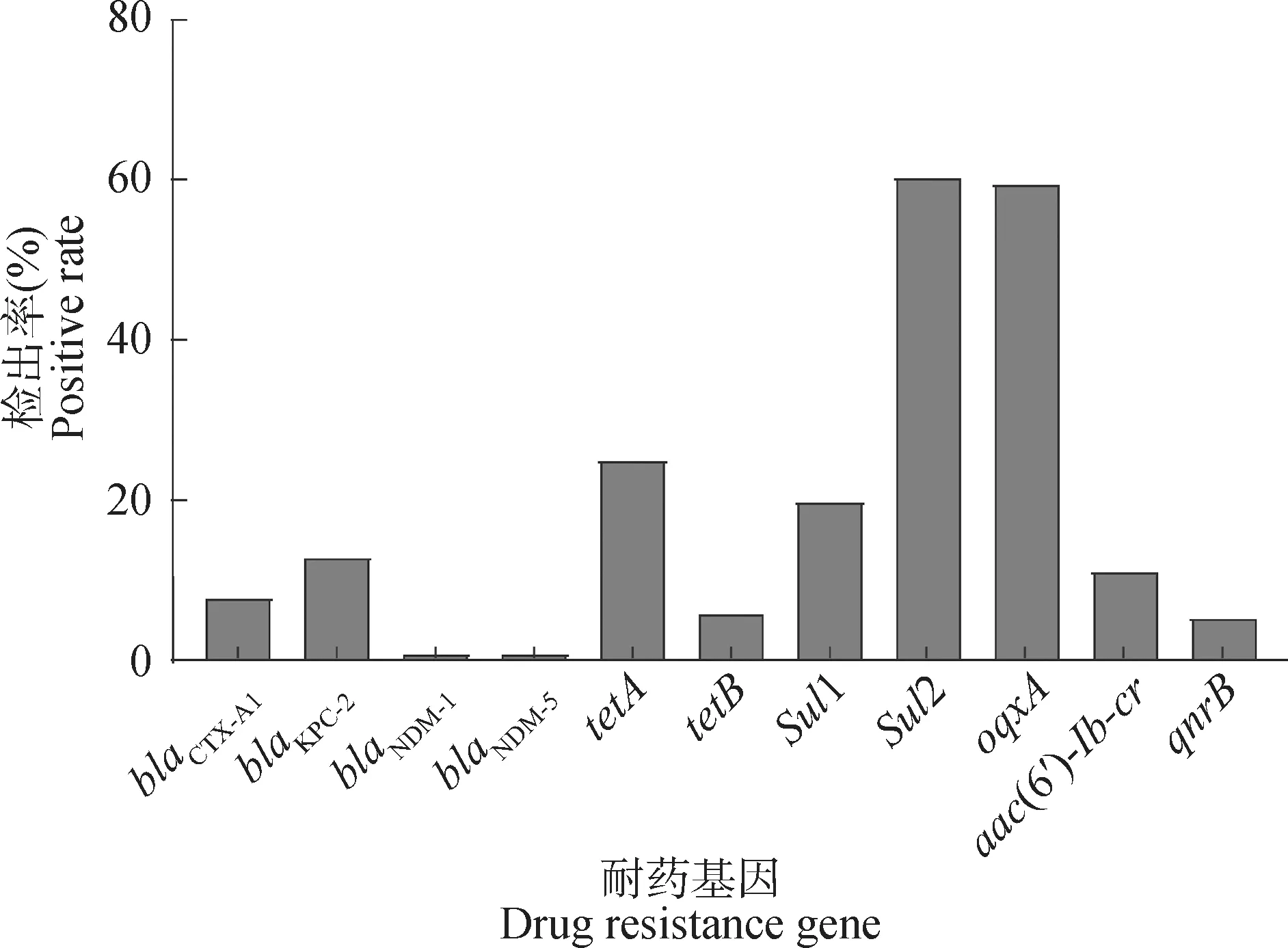
圖3 耐藥基因檢測結果Fig.3 The result of drug resistance genes
2.4 毒力基因檢測結果
116株肺炎克雷伯菌中8種毒力基因檢出率:莢膜多糖生成調節基因rmpA的檢出率為7.8%,鐵載體基因entB、iucA、iroN的檢出率分別為78.4%、61.2%及1.7%,菌毛定值與黏附基因ycfM、fimH、mrkD的檢出率分別為87.1%、35.3%及62.9%,脂多糖形成相關基因wabG的檢出率為56.0%(圖4)。
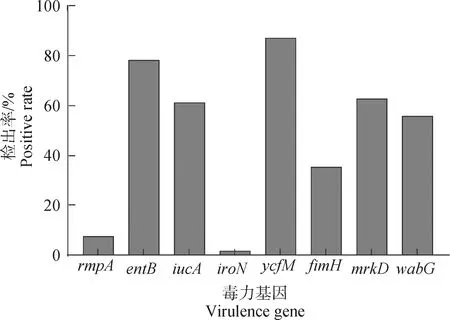
圖4 毒力基因檢測結果Fig.4 The result of virulence genes
3 討 論
近年來,隨著我國養殖業的迅猛發展,由感染肺炎克雷伯菌而引發臨床動物發病的報道也越來越多,給養殖企業帶來巨大的經濟損失[23]。由于肺炎克雷伯菌的感染與呼吸道疾病相關[24],因此本試驗以豬肺為采集對象,共分離到116株肺炎克雷伯菌,分離率(77.3%)較高。血清型檢測發現,其中84株(72.4%)為常見血清型,有32株(27.6%)為未分型菌株,表明存在其他血清分型,需進一步鑒定。根據毒力特點肺炎克雷伯菌可分為經典型和高毒力型。因此,本研究通過PEG-344基因[25]鑒定高毒力肺炎克雷伯菌,然而在116株臨床分離株中無高毒力型肺炎克雷伯菌(結果未顯示)。這表明該屠宰場雖然肺炎克雷伯菌的分離率偏高,但分離株致病性弱。
肺炎克雷伯菌感染機體的過程與其存在的毒力基因相關,如鐵載體、菌毛、莢膜、脂多糖等。因此本試驗通過PCR對116株分離株進行8個毒力基因檢測,毒力基因檢測結果顯示,菌毛定值與黏附基因ycfM檢出率最高(87.1%),其次是鐵載體基因entB(78.4%),這與Farzana等[26]報道的1株致新生兒極高病死率的高毒力多重耐藥天花克雷伯菌類似,鐵攝取系統、菌毛等典型毒力因子檢出率都較高。此外,翟祎夢等[27]研究表明,鐵攝取對細菌毒力至關重要,ent基因對促進細菌生長和提高其在特定條件的競爭優勢具有重要作用。
近年來,由于大量使用抗生素,肺炎克雷伯菌會產生抗生素水解酶,耐藥菌株不斷出現,導致使用抗生素防治肺炎的難度逐漸加大[28]。通過藥敏結果發現,116株肺炎克雷伯菌對四環素、多西環素、氨芐西林、復方新諾明耐藥率較高,耐藥率均在90%以上,與此4種抗菌藥物大量用于豬的疾病防治密切相關;對美羅培南、黏菌素和恩諾沙星均敏感;對其他藥物耐藥率為1.7%~25.0%。董瑞和孫曉[29]對滄州地區養豬場中分離出的肺炎克雷伯菌耐藥性進行研究時,發現對氨芐西林、多西環素和磺胺類藥物的耐藥率均超過90%;劉海林[30]研究表明,從河南新鄉分離的肺炎克雷伯菌對一代頭孢類、磺胺類藥物和四環素耐藥性較強,均與本研究結果一致。從分離菌株的多重耐藥結果來看,耐4種抗生素的分離菌株最多,占分離菌的59.5%,與林星宇等[31]報道的結果一致。
鑒于豬場耐藥情況嚴重,為了解肺炎克雷伯菌分離株耐藥基因攜帶情況,本試驗共測定ESBLs、碳青霉烯類、四環素類、磺胺類、喹諾酮類5大類耐藥基因,其中,磺胺類耐藥基因檢出率最高,sul2檢出率為60.3%,oqxA為59.5%。有趣的是,喹諾酮類耐藥基因的高檢出率和低耐藥率表現不一致,可能是這些耐藥基因在菌體內未表達。此現象與尹澤東等[32]報道的大腸桿菌質粒介導的喹諾酮耐藥基因檢出率與耐藥相關性的研究一致。
綜上所述,目前肺炎克雷伯菌在豬場中有一定的流行趨勢,并且出現不同程度的耐藥現象。尤其是對四環素類、β-內酰胺類以及磺胺類抗生素耐藥嚴重,且呈多重耐藥現象。因此建議在生產實踐中要合理使用抗生素,選用敏感藥物如恩諾沙星、黏菌素,避免耐藥性的產生。同時應加強飼養管理,創造良好的養殖環境,提高動物機體免疫力,完善飼養程序,提高經濟效益。
4 結 論
通過對廣東省廣州市某屠宰場豬源肺炎克雷伯菌進行調查,發現來自廣東省、湖南省、江西省的養殖場中肺炎克雷伯菌感染較為嚴重。定期對養殖場開展致病性肺炎克雷伯菌的檢測和耐藥性檢測,有助于減少疾病的發生,并為豬源肺炎克雷伯菌感染的防控提供參考依據。

