深板層角膜移植術治療感染性角膜穿孔臨床療效分析
郝珍珍,李海燕,喬玉春,李悅璇,駱 非
(河北省張家口市第四醫院,河北 張家口 075000)
角膜穿孔是由感染性角膜炎、神經營養性角膜炎(NTK)、外傷和炎癥性疾病或持續性上皮缺損(PED)引起角膜基質融化導致的一種疾病,嚴重威脅視力。為恢復眼球完整性及避免眼內炎或繼發性青光眼的發生,需適當的醫療措施干預[1]。感染性角膜穿孔的治療過程復雜,眼科醫師需依據患者不同情況按照個體化原則及時選擇最佳治療方案。目前,臨床多采用穿透性角膜移植術治療多種原因所致的角膜穿孔,但是深板層角膜移植(deep anterior lamellar keratoplasty,DALK)對供體角膜要求較低,且保存方式多樣如新鮮保存、冷凍保存及生物工程角膜等,符合我國角膜供體稀缺的國情[2]。我們探討了DALK治療感染性角膜潰瘍穿孔的臨床療效,現報道如下。
1 資料與方法
1.1 一般資料
選取2017-08—2019-06月張家口市第四醫院收治的40例(40眼)感染性角膜炎并發穿孔的患者,患者因感染性角膜炎所致角膜全層穿透致使眼內容物部分或全部脫出,出現眼睛流熱淚并伴視力突然、急劇下降。其中男20例,女20例;年齡36~81歲,平均(62.8±9.7)歲;平均病程(15.35±13.28)d;穿孔范圍3~5 mm;穿孔平均直徑(3.59±0.43)mm;穿孔位置:旁中心22例,中心4例,周邊10例及角膜緣4例;角膜保存方法:使用無水氯化鈣保存人角膜植片面積2.25~9.00 mm2,平均(4.83±1.65)mm2;術前視力0.01~4.7,平均(1.75±0.91)。納入標準:真菌性角膜炎、單純皰疹病毒(HSK)引起的角膜炎及細菌性角膜炎所致的角膜穿孔。排除標準:免疫原因及外傷或其他非感染因素導致的角膜穿孔或沒有角膜穿孔的眼睛。
本研究經醫院倫理委員會批準。所有患者均告知手術風險及術后并發癥,患者及家屬對研究內容知情同意并簽署知情同意書。
1.2 手術方法
40例患者均行深板層角膜移植術,給予患者內眼術前準備,麻醉成功后開瞼器開瞼,聚維酮碘消毒液(0.45%)沖洗結膜囊1次,生理鹽水沖洗結膜囊1次,根據角膜潰瘍灶的面積選擇相應直徑的環鉆,以潰瘍灶為中心應用環切鉆制作板層植床,根據潰瘍深度用尖刀片清除角膜病灶剖切至深基質層或后彈力層;在角膜緣用15°穿刺刀做前房穿刺口并注入粘彈劑,若存在虹膜嵌頓需分離并還納嵌頓的虹膜重新形成前房;供體角膜復水,剖除供體角膜內皮層,根據病情選擇合適直徑的環鉆,制作植床與植片,角膜植片直徑比植床直徑大0.25~0.50 mm;應用10—0尼龍線將植片與植床縫合,間斷縫合6~12針,埋藏線結,乳酸鈉林格液形成前房,指測眼壓Tn,手術結束。以上手術步驟均由同一醫師完成。
術后治療:患者術后1個月內局部應用抗生素滴眼液,嚴密觀察角膜植片上皮愈合情況,若角膜上皮未修復需佩戴角膜繃帶鏡,同時應用促進角膜上皮愈合的滴眼液及眼膏,上皮完全愈合后給予激素類滴眼液及抗排斥滴眼液,至少持續應用1年。真菌性角膜潰瘍所致穿孔患者術后持續應用抗真菌藥物連續6個月以上,確定真菌未復發后可停用藥物。病毒性角膜潰瘍穿孔患者需每日口服抗病毒藥物至少持續口服1年。所有患者均隨訪12個月。
1.3 觀察指標
眼球完整性(tectonic integrity)、術前及術后1、3、6、12個月的最佳矯正視力(best spectacle-corrected visual acuity)、屈光度(dioptre)包括球鏡(sphere)與柱鏡屈光度(cylinder)、內皮細胞密度(endothelial cell density)及術后并發癥情況。
移植成功標準:清除感染組織,恢復眼球完整性。感染復發:角膜潰瘍復發和(或)檢測出與手術前相同的病原體或微生物。
1.4 統計學方法
2 結 果
所有患者深板層角膜移植術均成功,典型病例見圖1。
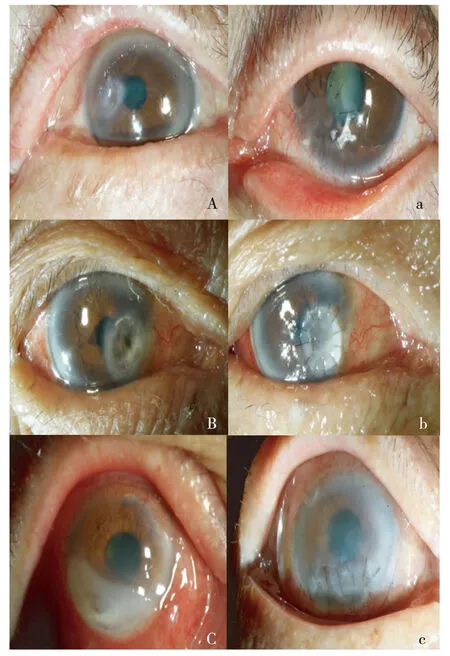
注:A、B、C為DALK術前;a、b、c為DALK術后。
2.1 角膜穿孔原因
所有患者均經微生物學檢查、角膜刮片染色和角膜共聚焦顯微鏡檢查,其中病毒感染21例(52.5%),真菌感染15例(37.5%),細菌感染4例(10%)。
2.2 眼球完整性
隨訪期間所有患者均維持了眼球完整度,均未出現再次穿孔及再次角膜移植及其它移植物情況,未出現眼球摘除患者。
2.3 術前術后視力、屈光度及內皮細胞數量比較
40例患者平均最佳矯正視力術后1個月及術后3個月與術前比較差異均無統計學意義(P>0.05),術后6、12個月與術前比較差異均有統計學意義(P<0.05),術后1個月與術后3個月視力比較差異無統計學意義(P>0.05),術后1個月與術后6、12個月比較差異有統計學意義(P<0.05),術后3個月與術后6、12個月視力比較差異有統計學意義(P<0.05),術后6個月與術后12個月比較差異無統計學意義(P>0.05)。40例患者球鏡屈光度、柱鏡屈光度角膜移植術前術后比較差異無統計學意義(P>0.05)。角膜內皮細胞密度(ECD)術前術后比較差異無統計學意義(P>0.05)(表1)。
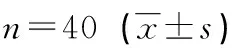
表1 視力、屈光度和角膜內皮細胞密度術前術后比較
2.4 術后并發癥的情況
隨訪期內未出現感染復發病例。術后第1天雙前房1例,術后逐漸自行消退;術后第3天高眼壓1例,給予降眼壓滴眼液治療眼壓逐漸下降到正常,之后未出現高眼壓情況;術后3個月出現角膜植片排斥反應1例,給予醋酸潑尼松龍滴眼液每日6次,他克莫司滴眼液每日3次,治療3 d后角膜植片水腫減輕,之后隨訪未再發生排斥;術后3個月發生并發性白內障1例,影響視力,后行白內障超聲乳化摘除術聯合人工晶體植入術治愈。
3 討 論
引起角膜穿孔的原因較多,在我國最常見的病因是真菌、病毒和細菌等感染性因素所致的角膜炎,角膜穿孔一旦發生,尤其是大于3 mm的穿孔需緊急恢復眼球完整性以避免更嚴重的后果。目前手術治療方法主要有羊膜移植術、Tenon囊及結膜瓣覆蓋術、角膜組織粘合劑、膠原蛋白交聯、板層角膜移植術、穿透性角膜移植術、角膜基質透鏡聯合羊膜移植術等[1]。羊膜移植的特性是抗炎、抗血管生成、抗纖維化、抗菌和促進上皮形成,控制上皮愈合或導致基質溶解的持續炎癥,在感染性角膜炎治療中主要控制小角膜穿孔(最大3 mm)并延遲緊急角膜移植術,但羊膜易溶解,需反復手術,且新鮮羊膜易發生感染[3]。Tenon囊及結膜瓣覆蓋術不需要任何供體組織,消除了排斥或感染的風險,但術后視力恢復效果不佳,且無法提供足夠的構造支撐,特別是在超過3mm的較大穿孔中可能導致角膜擴張或葡萄腫,嚴重血管化的缺點導致后續光學角膜移植術中移植物排斥風險增高[4]。組織粘合劑具有剛性、不可彎曲性質,不能滲透流體和代謝物,因此仍作為異物存在,而且其非生物可吸收性、缺乏透明度和粗糙的表面限制了下層組織愈合,影響視力,眨眼時可引起不適[5]。膠原蛋白交聯為感染性角膜炎的輔助治療方法,對淺表潰瘍有益,可防止晚期微生物性角膜炎角膜融化,減少或避免需要進行角膜移植術的概率及前房積膿增加的可能[6]。穿透性角膜移植術被認為是較大面積穿孔感染性角膜潰瘍的有效治療方法,對供體角膜內皮細胞密度及質量的要求極高,術后常存在排斥反應,需長期應用抗排斥藥物,且新鮮角膜材料稀缺[7]。角膜基質透鏡聯合羊膜移植術是在緊急情況和供體短缺情況下治療角膜潰瘍和穿孔的有效方法,但關于角膜潰瘍穿孔大小與基質透鏡的厚度選擇尚在進一步研究中,目前相關研究樣本量較小,且對并發癥的研究亦較少[8]。深板層角膜移植術切削感染壞死角膜組織暴露后彈力層,可極大程度維持患者眼球的完整性,同時保留了部分自身內皮細胞,降低了角膜內皮排斥反應的風險及術后角膜內皮細胞數量大量丟失的可能性[9-10]。
本研究中,我們應用無水氯化鈣保存的干燥角膜組織治療感染性角膜潰瘍穿孔,潰瘍穿孔范圍3~5 mm,術中保留大部分內皮及基質層,降低了術后排斥率及感染復發率。干燥的角膜組織易于保存,存取方便,等待時長短,且在穿孔范圍較小的情況下可以多人應用一個完整角膜組織,可在一定程度上緩解患者經濟壓力。術中角膜組織復水比較容易,后期隨訪發現移植的角膜組織逐步透明,不僅實現眼球完整性的重塑,也改善了外觀。患者術后6、12個月視力較術前明顯提高。術后隨訪雖然出現不同情況的并發癥,經過治療均得到有效緩解。應用DALK治療感染性角膜潰瘍穿孔取得了較好效果。
綜上,對于穿孔范圍較大,應用結膜瓣移植及羊膜移植效果不佳及新鮮角膜組織稀缺的情況下,DALK治療感染性角膜潰瘍伴穿孔有效、安全,可控制感染、恢復患者眼球完整性,值得臨床推廣應用。

