銅陽(yáng)極泥脫銅渣中鉛的高效浸出試驗(yàn)研究
王佳寅,韓 慶,南君芳,李斌川,陳建設(shè),劉奎仁
(1.東北大學(xué) 有色金屬資源循環(huán)利用沈陽(yáng)市重點(diǎn)試驗(yàn)室,遼寧 沈陽(yáng) 110819;2.東北大學(xué) 冶金學(xué)院,遼寧 沈陽(yáng) 110819;3.國(guó)投金城冶金有限責(zé)任公司,河南 靈寶 472500)
銅陽(yáng)極泥是銅電解精煉的副產(chǎn)品之一,其中含有Au、Ag等有價(jià)金屬,具有一定回收價(jià)值[1-2]。其處理工藝主要包括傳統(tǒng)火法、卡爾多爐、全濕法、半濕法和選冶聯(lián)合法等[3]。其中,銅陽(yáng)極泥半濕法處理工藝因具有成本低、污染小等優(yōu)點(diǎn)[4],相比其他方法應(yīng)用更廣泛,其主要流程為硫酸化焙燒脫硒—酸浸脫銅—氯化分金—亞鈉分銀—金銀還原與精煉[5]。
脫銅渣是銅陽(yáng)極泥經(jīng)過(guò)硫酸化焙燒和酸浸脫銅2個(gè)工序所產(chǎn)生的重要中間產(chǎn)物之一,通常含有大量賤金屬化合物[6-8],其中PbSO4質(zhì)量分?jǐn)?shù)可達(dá)20%[9]。在提取貴金屬過(guò)程中,Pb2+進(jìn)入溶液會(huì)形成PbO覆蓋在Au、Ag表面,對(duì)Au、Ag溶解起到抑制作用,阻礙其浸出[10];在后續(xù)氯化金離子的還原過(guò)程中,鉛等雜質(zhì)會(huì)干擾其還原電位,對(duì)還原過(guò)程產(chǎn)生不利影響[11];此外,脫銅渣中大量的PbSO4極易導(dǎo)致所得金屬產(chǎn)品中鉛含量超標(biāo)[12]。目前,有關(guān)銅陽(yáng)極泥脫銅渣濕法脫鉛的研究鮮見(jiàn)報(bào)道。
濕法提鉛方法主要有堿浸法、氯鹽法和碳酸鹽轉(zhuǎn)化—酸浸法。堿浸法脫鉛存在堿度要求高、浸出過(guò)程選擇性差、浸出液黏度較大且成分復(fù)雜等問(wèn)題[13-14],不利于脫銅渣中有價(jià)金屬的富集;用碳酸鹽轉(zhuǎn)化—酸浸法從金礦焙燒酸浸渣中脫鉛,鉛轉(zhuǎn)化率與浸出率分別可達(dá)97%和83%[15-16],但該工藝流程復(fù)雜,酸浸過(guò)程選擇性較差,不適用于脫銅渣中鉛的脫除;采用NaCl-HCl體系對(duì)陽(yáng)極泥脫銅渣進(jìn)行二段脫鉛,脫鉛率較高,金浸出率也能得到大幅提升,但該體系選擇性較差,浸出液成分復(fù)雜,有價(jià)金屬分離困難[17]。因此,探尋一種選擇性強(qiáng)、浸出效果好的高效浸出劑對(duì)脫銅渣脫鉛具有重要意義。
乙二胺四乙酸二鈉(EDTA-2Na)是常用的螯合劑之一,其性質(zhì)穩(wěn)定且無(wú)氧化還原性,多用于鑒定金屬離子和改善土壤中重金屬超標(biāo)問(wèn)題[18]。脫銅渣中多數(shù)有價(jià)金屬主要以單質(zhì)、金屬氧化物或其他復(fù)雜化合物形式存在,鉛則主要以簡(jiǎn)單離子化合物PbSO4形式存在,溶液中EDTA有效配體極易與重金屬陽(yáng)離子螯合,且EDTA-2Na對(duì)Pb2+具有較強(qiáng)的螯合作用。試驗(yàn)研究了用以EDTA-2Na從脫銅渣中浸出PbSO4,考察了EDTA-2Na用量、浸出時(shí)間、浸出溫度、溶液pH和液固體積質(zhì)量比對(duì)Pb浸出率的影響,并探討了浸出動(dòng)力學(xué)。
1 試驗(yàn)部分
1.1 試驗(yàn)原料、試劑與設(shè)備
脫銅渣:來(lái)自某黃金冶煉廠陽(yáng)極泥處理過(guò)程,破碎球磨至過(guò)100目篩,其主要化學(xué)成分見(jiàn)表1,脫銅渣XRD分析結(jié)果如圖1所示。脫銅渣中Pb的存在形式主要為PbSO4,Te的主要存在形式為堿溶性TeO2和Ag2Te,渣中還存在少量微溶于水的Ag2SO4,為避免其進(jìn)入溶液,需加入少量NaCl,使Ag富集于渣中。

圖1 脫銅渣的XRD圖譜

表1 脫銅渣的主要成分 %
試驗(yàn)試劑:乙二胺四乙酸二鈉、氫氧化鈉、鹽酸、九水硫化鈉,均為分析純,國(guó)藥集團(tuán)化學(xué)試劑有限公司。
試驗(yàn)設(shè)備:PHS-25型電位-pH計(jì),上海儀電科學(xué)儀器股份有限公司;DF101S型集熱式磁力攪拌器,鞏義市予華儀器有限責(zé)任公司;DZF-6050型真空干燥箱,上海精宏實(shí)驗(yàn)設(shè)備有限公司;SHB-Ⅲ型循環(huán)水式多用真空泵,南京科爾儀器設(shè)備有限公司;UPT-Ⅱ型優(yōu)普純水機(jī),四川優(yōu)普超純科技有限公司;D8 ADVANCE型X射線衍射儀(XRD),德國(guó)布魯克公司;AL104型電子天平,上海滬粵明科學(xué)儀器有限公司;FMS36型ICP-OES光譜儀,德國(guó)斯派克分析儀器公司。
1.2 試驗(yàn)原理
脫銅渣中Pb的主要物相為PbSO4。EDTA與Pb的配合物穩(wěn)定性常數(shù)的對(duì)數(shù)(lgKf)為18.04[19],配合比例為1∶1,而PbSO4溶度積常數(shù)的負(fù)對(duì)數(shù)(-lgKsp)為7.80,前者遠(yuǎn)大于后者,說(shuō)明EDTA-Pb的穩(wěn)定性高于PbSO4,即PbSO4可溶解于EDTA-2Na溶液。另外,脫銅渣中微溶的Ag2SO4也會(huì)進(jìn)入溶液,加入適量NaCl,反應(yīng)生成AgCl沉淀,將Ag富集到渣中,涉及的主要化學(xué)反應(yīng)如下:

(1)

(2)
1.3 試驗(yàn)方法
試驗(yàn)在300 mL燒杯中進(jìn)行,向烘干后的燒杯中按設(shè)定浸出劑用量和液固體積質(zhì)量比依次加入EDTA-2Na、去離子水、NaCl。將燒杯置于集熱式磁力攪拌器內(nèi)(400 r/min,±0.1 ℃)開(kāi)始升溫,用NaOH和HCl調(diào)溶液pH,同時(shí)使用pH計(jì)進(jìn)行監(jiān)測(cè)。待pH與溫度達(dá)到預(yù)定值后,將脫銅渣加入到燒杯中,開(kāi)啟攪拌并計(jì)時(shí),攪拌過(guò)程中調(diào)pH在設(shè)定值范圍內(nèi)。每隔一定時(shí)間過(guò)濾少量溶液,量取定量溶液經(jīng)王水消解,稀釋至一定濃度范圍送檢,按照式(3)計(jì)算Pb浸出率。試驗(yàn)結(jié)束后進(jìn)行抽濾,濾渣經(jīng)去離子水洗滌之后密封保存,向?yàn)V液中加入與鉛物質(zhì)的量等量的Na2S進(jìn)行硫化沉鉛,沉鉛后過(guò)濾收集濾液密封備用。
(3)
式中:x—鉛浸出率,%;ρt—浸出t時(shí)間時(shí)溶液中鉛質(zhì)量濃度,g/L;V0—初始溶液體積,L;m—脫銅渣質(zhì)量,g;w—脫銅渣中鉛質(zhì)量分?jǐn)?shù),%。
2 試驗(yàn)結(jié)果與討論
2.1 n(EDTA)/n(Pb)對(duì)脫銅渣中Pb浸出率的影響
試驗(yàn)條件:溶液pH=5,浸出時(shí)間120 min,液固體積質(zhì)量比4/1,浸出溫度為323 K。n(EDTA)/n(Pb)對(duì)脫銅渣中Pb浸出率的影響試驗(yàn)結(jié)果如圖2所示。可以看出:隨n(EDTA)/n(Pb)增大,脫銅渣中Pb浸出率升高,當(dāng)n(EDTA)/n(Pb)為2/1時(shí),Pb浸出率可達(dá)99%。EDTA配體與Pb2+按1/1進(jìn)行螯合,但脫銅渣中含有大量可溶性金屬離子(Cu2+、Bi3+等),這些離子可與Pb2+發(fā)生配位競(jìng)爭(zhēng)而進(jìn)入溶液,故需加入足量EDTA以確保Pb的螯合浸出效果。因此,確定適宜的n(EDTA)/n(Pb)為2/1,即EDTA濃度為0.351 mol/L。

圖2 n(EDTA)/n(Pb)對(duì)脫銅渣中Pb浸出率的影響
2.2 溶液pH對(duì)脫銅渣中Pb浸出率的影響
試驗(yàn)條件:n(EDTA)/n(Pb)=2/1,浸出時(shí)間120 min,液固體積質(zhì)量比4/1,浸出溫度323 K。溶液pH對(duì)脫銅渣中Pb浸出率的影響試驗(yàn)結(jié)果如圖3所示。

圖3 溶液pH對(duì)脫銅渣中Pb浸出率的影響
由圖3看出:pH<5時(shí),隨pH升高,脫銅渣中Pb浸出率快速升高;pH升至5時(shí),Pb浸出率接近100%。這是因?yàn)樵诓煌琾H條件下,EDTA-2Na(記作Na2H2Y)在溶液中的存在形式變化較大:pH較低時(shí),溶液中大量H+與Na2H2Y配體結(jié)合,形成不具有螯合作用的H4Y,導(dǎo)致EDTA-2Na溶液的螯合浸出能力大幅降低;pH=5時(shí),溶液中EDTA的有效配體主要為H2Y2-、HY3-和Y4-,其可與Pb2+按1∶1比例進(jìn)行螯合,達(dá)到浸出Pb的目的。因此,確定適宜溶液pH為5。
2.3 液固體積質(zhì)量比對(duì)脫銅渣中Pb浸出率的影響
試驗(yàn)條件:n(EDTA)/n(Pb)=2/1,浸出時(shí)間120 min,溶液pH=5,浸出溫度323 K。液固體積質(zhì)量比對(duì)脫銅渣中Pb浸出率的影響試驗(yàn)結(jié)果如圖4所示。

圖4 液固體積質(zhì)量比對(duì)脫銅渣中Pb浸出率的影響
由圖4看出,隨液固體積質(zhì)量比增大,脫銅渣中Pb浸出率呈上升趨勢(shì):液固體積質(zhì)量比增至4/1時(shí),Pb浸出率達(dá)拐點(diǎn);之后隨液固體積質(zhì)量比進(jìn)一步增大,Pb浸出率升幅變緩。因此,確定適宜的液固體積質(zhì)量比為4/1。
2.4 浸出時(shí)間對(duì)脫銅渣中Pb浸出率的影響
試驗(yàn)條件:溶液pH=5,n(EDTA)/n(Pb)=2/1,液固體積質(zhì)量比4/1,浸出溫度323 K。浸出時(shí)間對(duì)脫銅渣中Pb浸出率的影響試驗(yàn)結(jié)果如圖5所示。

圖5 浸出時(shí)間對(duì)脫銅渣中Pb浸出率的影響
由圖5看出:隨浸出時(shí)間延長(zhǎng),脫銅渣中Pb浸出率升高;浸出120 min時(shí),Pb浸出率可達(dá)99%;繼續(xù)延長(zhǎng)浸出時(shí)間,Pb浸出率不變。因此,確定適宜浸出時(shí)間為120 min。
2.5 溫度對(duì)脫銅渣中Pb浸出率的影響
試驗(yàn)條件:溶液pH=5,n(EDTA)/n(Pb)=2/1,浸出時(shí)間為120 min,液固體積質(zhì)量比4/1。溫度對(duì)脫銅渣中Pb浸出率的影響試驗(yàn)結(jié)果如圖6所示。

圖6 溫度對(duì)脫銅渣中Pb浸出率的影響
由圖6看出:浸出溫度為303 K,脫銅渣中Pb浸出率約為93%,隨浸出溫度升高,Pb浸出率有所升高;溫度升至323 K時(shí),Pb浸出率達(dá)99%左右,溫度繼續(xù)升高,Pb浸出率變化不大。因此,確定適宜的浸出溫度為323 K。
2.6 驗(yàn)證試驗(yàn)
綜合上述結(jié)果,確定最佳浸出條件為:n(EDTA)/n(Pb)=2/1,溶液pH=5,液固體積質(zhì)量比4/1,浸出溫度323 K,浸出時(shí)間120 min。在該條件下重復(fù)進(jìn)行3次驗(yàn)證試驗(yàn),結(jié)果見(jiàn)表2。

表2 驗(yàn)證試驗(yàn)結(jié)果
由表2看出:在最佳浸出條件下,Pb浸出率可穩(wěn)定在99%左右;貴金屬Au和Ag損失很小,可進(jìn)一步加以富集。
2.7 浸出動(dòng)力學(xué)分析
浸出過(guò)程是發(fā)生在固-液非均相體系中的復(fù)雜反應(yīng),由于原料顆粒足夠細(xì)小,可以將其認(rèn)為是一個(gè)致密的細(xì)小球型顆粒,且浸出過(guò)后仍然殘留有固相顆粒,因此浸出過(guò)程符合典型的未反應(yīng)核收縮模型(縮核模型)特征[20-23]。在該模型中,浸出過(guò)程主要受以下步驟影響:(內(nèi)、外)擴(kuò)散、界面化學(xué)反應(yīng)、擴(kuò)散與界面化學(xué)反應(yīng)混合作用。式(4)~(7)分別描述了反應(yīng)速率受液相邊界層外擴(kuò)散控制、固相產(chǎn)物層內(nèi)擴(kuò)散控制、界面化學(xué)反應(yīng)控制和混合控制的浸出動(dòng)力學(xué)規(guī)律。
x=kt;
(4)
(5)
(6)
(7)
式中:x—脫銅渣中Pb浸出率,%;t—反應(yīng)時(shí)間,min;k—反應(yīng)速率常數(shù),min-1。
在排除液相邊界層外擴(kuò)散控制(式(4))的前提下,根據(jù)式(5)~(7)對(duì)圖6中的數(shù)據(jù)進(jìn)行擬合,結(jié)果分別如圖7~9所示。

圖7 不同溫度下對(duì)浸出時(shí)間t的擬合曲線

圖8 不同溫度下對(duì)浸出時(shí)間t的擬合曲線
由上述擬合結(jié)果可知:圖9中數(shù)據(jù)擬合的相關(guān)系數(shù)均大于0.98,表明該浸出過(guò)程受擴(kuò)散與化學(xué)反應(yīng)混合控制。采用Arrhenius方程(式(8))對(duì)不同溫度下速率常數(shù)k進(jìn)行擬合,結(jié)果如圖10所示,計(jì)算可得該浸出反應(yīng)表觀活化能為17.93 kJ/mol。
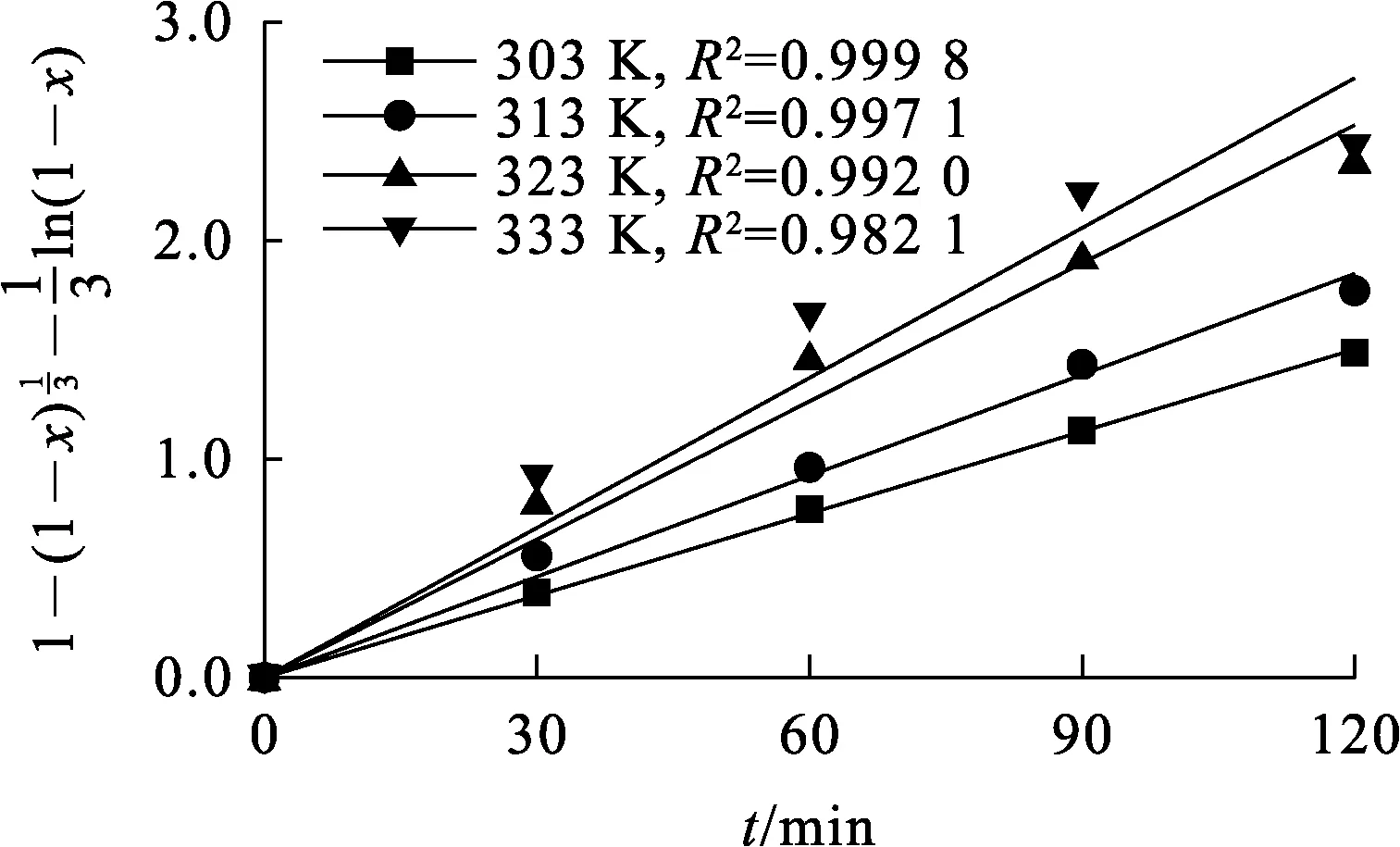
圖9 不同溫度下對(duì)浸出時(shí)間t的擬合曲線
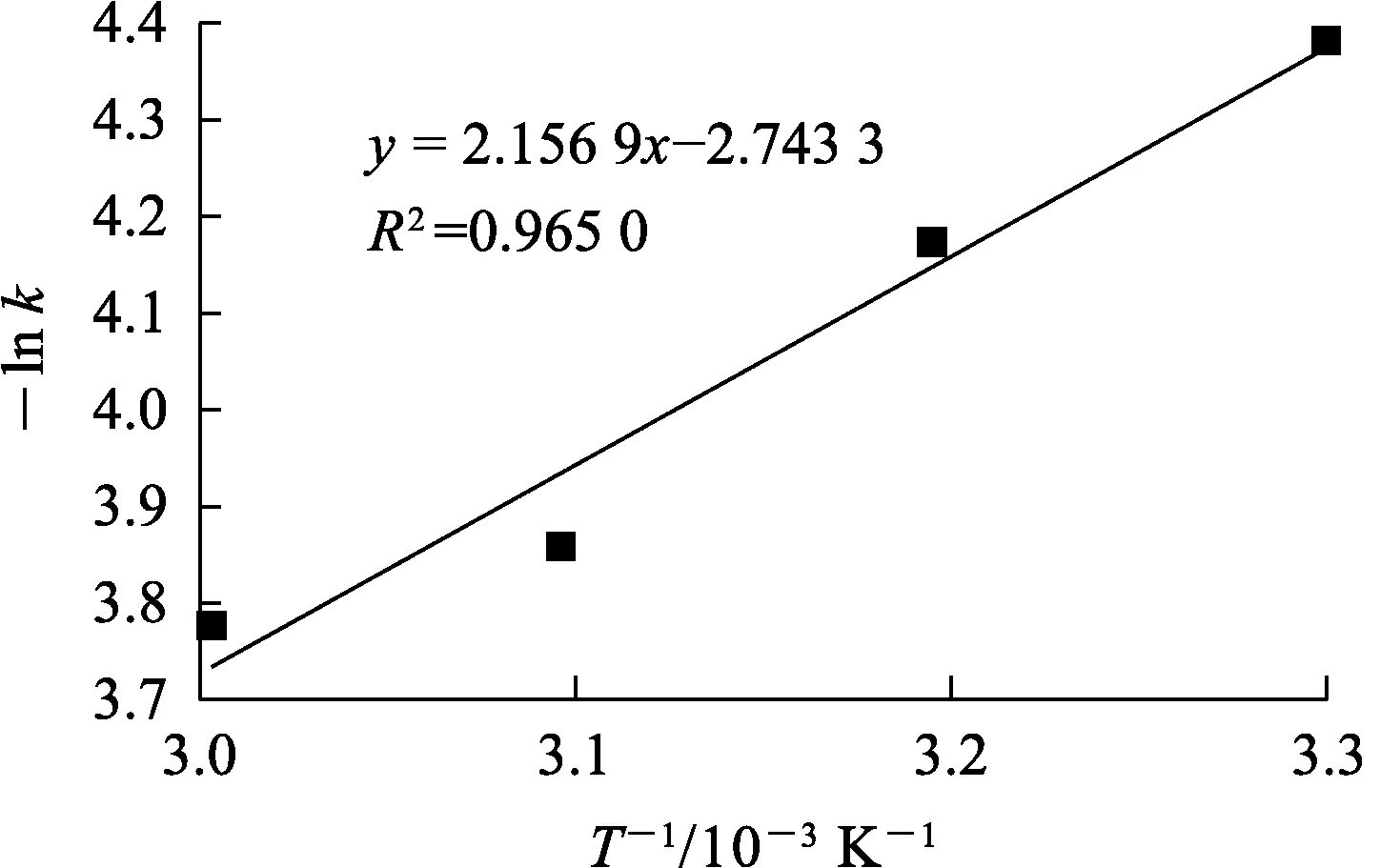
圖10 -ln k與T-1的關(guān)系曲線
(8)
式中:k—化學(xué)反應(yīng)速率常數(shù),min-1;A—頻率因子,min-1;R—理想氣體常數(shù),8.314 J/(mol·K);Ea—表觀活化能,kJ/mol。
3 結(jié)論
采用乙二胺四乙酸二鈉(EDTA-2Na)從銅陽(yáng)極泥脫銅渣中浸出鉛是可行的。在pH=5、n(EDTA)/n(Pb)=2/1、液固體積質(zhì)量比4/1、浸出溫度323 K、浸出時(shí)間120 min最優(yōu)條件下,鉛浸出率可達(dá)99%,且渣中貴金屬基本不損失,可實(shí)現(xiàn)脫銅渣中鉛元素的高效浸出。浸出過(guò)程符合未反應(yīng)核收縮模型,受擴(kuò)散與化學(xué)反應(yīng)混合控制,表觀活化能為17.93 kJ/mol。該法選擇性較強(qiáng),浸出效果較好,浸出效率高,后續(xù)浸出液可經(jīng)沉鉛后回收再利用,可為銅陽(yáng)極泥半濕法工藝脫鉛提供了一種新途徑。

