瞬時受體電位香草酸亞型1在缺血性中風機制及相關中藥的研究進展
張鴻瑞 高 穎,2 賴新星,2 高永紅 曹克剛,2 許穎智,2 薛冰潔,2 李丹溪,2 劉珍洪,2
(1 北京中醫藥大學東直門醫院,北京,100700; 2 北京中醫藥大學中醫腦病研究院,北京,100700)
中風是世界第二大致死疾病,亦是我國成人致死的首要原因,中風帶來的負擔日益加重[1]。其中,缺血性中風(Ischemic Stroke,IS)占70%以上。腦組織缺血后誘發能量衰竭、細胞內鈣超載、興奮性毒性、神經炎癥、血腦屏障損傷、氧化應激等一系列復雜的級聯損傷,最終導致細胞程序性凋亡和腦組織永久性壞死[2]。其中Ca2+穩態破壞(Ca2+內流所致鈣超載)發生較早,是腦缺血后級聯損傷的上游關鍵環節,與興奮性毒性和神經炎癥等病理事件串擾互作[3-5]。既往N-甲基-D-天冬氨酸(N-methyl-D-aspartic Acid,NMDA)和α-氨基-3羧基-5-甲基-4-異口惡唑丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic Acid,AMPA)谷氨酸受體被認為是中風后神經元Ca2+內流的主要受體,大量神經保護劑的研發以NMDA和AMPA受體為靶標。然而NMDA和AMPA拮抗劑的臨床試驗均因治療窗口窄和不良反應而未能顯示出預期的效果[6]。近年來,誘導Ca2+內流的非谷氨酸機制越來越受到關注。其中鈣通道瞬時受體電位香草酸亞型1(Transient Receptor Potential Vanilloid 1,TRPV1)不僅參與中風后鈣穩態,而且對興奮性毒性、神經炎癥等病理過程發揮重要調控作用,成為神經保護藥物研發的新興靶標[7]。TRPV1屬于瞬時受體電位通道(Transient Receptor Potential,TRP)家族,1997年由諾爾貝生理學或醫學獎獲得者David Julius教授從大鼠背根神經節(Dorsal Root Ganglia,DRG)中發現并克隆。TRPV1可被外源性物質如辣椒素、大麻素等激活,也可被熱刺激(>43 ℃)、H+(pH<6.0)等傷害性刺激和內源性物質激活[8]。另外,相關研究陸續發現調控TRPV1激活/抑制是中藥發揮抗缺血損傷的重要機制。本文將從TRPV1參與IS的病理機制及中風中藥中TRPV1激動劑/抑制劑進行梳理,挖掘臨床防治IS的新策略。
1 TRPV1的結構及分布
1.1 結構 TRP家族是一類位于細胞膜上的非選擇性陽離子通道,首個TRP通道由COSENS和MANNING[9]在果蠅中發現。TRP通道在哺乳動物中共有28個成員,根據氨基酸序列的同源性分為TRPC、TRPV、TRPM、TRPA、TRPML及TRPP 6個亞群[10]。TRP通道均由4個相同或相似的亞基組成,每個亞基中跨膜結構域S1~S4組成傳感區,S5與S6之間有供離子通過的孔道環,位于細胞內的N端與C端,在不同的亞群中存在結構差異[10]。人類TRPV1基因位于染色體17p13,編碼形成839個氨基酸95 kD大小的TRPV1蛋白[11]。N端的33個氨基酸殘基形成可與鈣調蛋白結合的3個親水性錨蛋白重復序列;C端的TRP樣結構域中Glu684-Arg721被認為是TRPV1四聚體化的相關區域[12]。
1.2 分布 TRPV1在神經元、小膠質細胞等腦組織中廣泛分布[13]。腦血管內皮細胞中也發現有TRPV1的表達[14]。另外,海馬CA1~CA3區、齒狀回的錐體神經元、小腦皮質及多數浦肯野細胞的胞體和軸突周圍,以及基底神經節、丘腦、下丘腦、大腦腳、腦橋核、導水管周圍灰質與小腦齒狀核均發現TRPV1的表達[15]。
2 TRPV1在IS病理發生中的作用
2.1 鈣超載 Ca2+在神經元興奮性、突觸可塑性及程序性細胞死亡中發揮重要作用,Ca2+升高影響IS神經功能預后[16]。缺血后Ca2+大量內流引起鈣超載,激活半胱氨酸蛋白酶,降解細胞骨架蛋白、膜受體和代謝相關酶[17]。鈣超載還導致谷氨酸釋放,過度激活谷氨酸受體,產生興奮性毒性,最終導致神經元死亡[16]。同時,細胞內Ca2+通過電壓依賴性陰離子通道和Ca2+單向轉運體進入線粒體,胞質鈣濃度升高可引發線粒體鈣超載[16,18]。線粒體鈣超載導致線粒體功能障礙,線粒體腫脹、外膜破裂,釋放促凋亡蛋白,誘導神經元凋亡[19]。此外,細胞內Ca2+還通過激活氧合酶,影響線粒體Ca2+穩態和能量代謝等,促進活性氧(Reactive Oxygen Species,ROS)產生,誘導氧化應激[17]。TRPV1作為非選擇性陽離子通道,主要滲透Ca2+和Na+,PCa/PNa為9.6[20]。辣椒素是TRPV1的典型激動劑,半數應濃度(Median Effective Concentration,EC50)為39.1 nmol/L[8]。谷氨酸刺激NMDA受體過度激活,誘發Ca2+內流。在培養的大鼠皮層神經元中,3 μmol/L辣椒素預處理1 h可以明顯降低谷氨酸誘發的鈣內流,并且下調NMDA的表達豐度,在TRPV1敲除神經元中這種作用消失,提示辣椒素依賴TRPV1作用來降低谷氨酸誘發的鈣內流和下調NMDA表達[20]。TRPV1過度激活是有害的,可以導致線粒體Ca2+穩態失衡,破壞線粒體膜電位,誘導ROS產生和細胞色素C釋放增加,導致細胞凋亡[21]。辣椒素持續激活TRPV1后,可導致通道脫敏,抑制Ca2+內流[22]。TRPV1激活促進鈣超載和TRPV1激動劑辣椒素抑制鈣超載這二者之間的矛盾,目前更多學者認為辣椒素抑制鈣超載主要是由TRPV1脫敏所致[23]。
2.2 興奮性毒性 谷氨酸是中樞神經系統中主要的興奮性神經遞質,介導興奮性突觸傳遞,過高的谷氨酸水平可引發興奮性毒性,導致中風后神經元死亡[24]。鈣超載與興奮性毒性相互影響,中風后鈣超載引起神經元去極化,釋放谷氨酸,持續激活突觸后NMDA受體等谷氨酸受體,導致Ca2+內流再次增加,形成細胞內Ca2+升高與谷氨酸異常釋放的惡性循環[16]。IS后遲發性細胞死亡與經NMDA受體內流的Ca2+誘發的興奮性毒性密切相關[25]。辣椒素不僅可調節谷氨酸釋放,還可調節NMDA受體谷氨酸受體的表達,緩解IS后興奮性氨基酸毒性損傷。大鼠大腦中動脈閉塞(Middle Cerebral Artery Occlusion,MCAO)手術前3 h腹腔注射辣椒素(0.2 mg/kg),24 h進行氣相色譜-質譜聯用技術(Gas Chromatography-mass Spectrometry,GC-MS)代謝組檢測,發現辣椒素預處理后皮質谷氨酸恢復至正常水平,推測辣椒素通過降低興奮性氨基酸的釋放發揮神經保護作用[26]。在培養的大鼠皮層神經元中,不同劑量的辣椒素(3 μmol/L、10 μmol/L)預處理30 min可以抑制谷氨酸誘導的興奮性毒性。辣椒素處理0.5 h后可降低MCAO大鼠大腦梗死周圍區NMDA受體亞基GluN1的蛋白豐度,60 min后降低GluN2B的蛋白豐度,保護大腦皮質神經元免于興奮性毒性損傷[20]。TRPV1基因敲除小鼠中,辣椒素抑制谷氨酸誘導的興奮性毒性的作用消失,提示辣椒素依賴TRPV1機制來抑制興奮性毒性。
2.3 神經炎癥 中風后繼發的神經炎癥可導致細胞死亡。源自于免疫介質的促炎信號激活小膠質細胞、星形膠質細胞等腦固有免疫細胞,釋放白細胞介素-1(Interieukin-1,IL-1)、腫瘤壞死因子-α(Tumor Necrosis Factor-α,TNF-α)等炎癥介質導致炎癥反應損傷,并促進其他炎癥細胞向缺血區域浸潤,加劇腦損傷[27]。小膠質細胞同時也分泌IL-10等抗炎因子發揮保護作用[28]。側腦室注射辣椒平可抑制磷酸化c-Jun氨基末端激酶(p-c-Jun N-terminal Kinase,p-JNK)和磷酸化p38促分裂原活化的蛋白激酶(p38 Mitogenactivated Protein Kinase,p-p38MAPK)表達[29],抑制TRPV1,降低MCAO小鼠IL-1β的表達并減少杏仁核小膠質細胞的激活,減輕炎癥反應[30]。TRPV1拮抗劑AMG517和AMG9810可降低IS后血清TNF-α水平,提高血清IL-10水平,減少IS后炎癥反應,抑制神經元死亡,降低腦梗死體積[31-32]。AMG9810還可通過抑制梗死周圍區域Toll樣受體2和Toll樣受體4的mRNA表達,緩解神經功能障礙[33]。核因子κB、p38MAPK與JNK信號通路參與神經炎癥并導致不同程度的缺血后神經損傷。電針預處理降低MCAO大鼠神經元TRPV1的表達,抑制核因子κB轉錄活性和p38MAPK激活,抑制氧化應激損傷、降低炎癥介質的產生[34-35],這些研究都提示TRPV1與神經炎癥之間存在正相關,即激活TRPV1可促進神經炎癥;抑制TRPV1可減輕神經炎癥,實現神經保護作用。但有研究報告短暫性大腦中動脈阻塞(Transient Middle Cerebral Artery Occlusion,tMCAO)大鼠灌胃50 mg/kg、100 mg/kg辣椒素可增加海馬組織TRPV1表達,減少TNF-α、IL-1β分泌,通過MAPK/環氧合酶-2(Cyclooxygenase,COX-2)信號通路抑制小膠質細胞的過度活化[36]。但辣椒素減少炎癥介質分泌是否依賴TRPV1機制尚需要進一步驗證。
2.4 自噬 IS發生后神經元、膠質細胞及腦內皮細胞均可發生自噬,清除受損的細胞器及蛋白質,但不足或過度的自噬可破壞細胞穩態,導致細胞死亡[37]。一方面TRPV1促進自噬,消除自噬不足狀態,達到神經保護作用。TRPV1激動劑辣椒素可通過促進氧糖剝奪/復氧(Oxygen-glucose Deprivation/Re-oxygenation,OGD/R)小膠質細胞自噬,降低缺血再灌注損傷導致的小膠質細胞炎癥損傷[38],TRPV1抑制劑iRTX則拮抗OGD/R小膠質細胞自噬,加重氧化應激誘導的小膠質細胞凋亡[39]。另一方面,當自噬過度激活時,可通過抑制TRPV1發揮神經保護作用。辣椒平可下調小鼠腦杏仁核區自噬相關蛋白Beclin-1和微管相關蛋白輕鏈3(Light Chain Protein 3,LC3),并可能通過激活調控自噬的主要信號通路磷脂酰肌醇3激酶(Phosphoinositide 3-kinase,PI3K)/蛋白激酶B(Protein Kinase B,AKT)/哺乳動物雷帕霉素靶蛋白(Mammalian Target of Rapamycin,mTOR)通路,抑制自噬的過度激活,發揮神經保護作用[40]。
2.5 腦血流 IS后缺血再灌注損傷導致血管收縮和擴張的物質釋放失衡,內皮素、血管緊張素Ⅱ、血栓素A2等縮血管物質大量釋放,一氧化氮、前列環素等擴血管物質釋放減少,導致微血管收縮-舒張功能失調。內皮型一氧化氮合酶(Endothelial Nitric Oxide Synthase,eNOS)在腦血流維持和中風預防中具有顯著作用,辣椒素激活蛋白激酶A,促進eNOS磷酸化,改善腦基底動脈內皮依賴性血管舒張功能,擴張腦動脈,延緩中風的發生[14]。腦缺血會損害大腦中動脈的肌源性反應,辣椒素預處理可改善大腦中動脈遠端肌源性張力,降低梗死體積[41-42]。辣椒素可通過增加大腦中動脈平均血流速度,降低搏動指數,產生與蝶腭神經節電刺激類似的增強側支血流作用[43]。因此,TRPV1能夠改善血管動力學,維持腦組織血液循環,促進側支循環,調節腦血流。此外,TRPV1對血腦屏障不利,TRPV1拮抗劑辣椒平可緩解缺血再灌注后血腦屏障通透性的改變,保護血腦屏障[44]。
2.6 保護性低溫 低溫可降低需氧量、保障貯能、提高細胞存活率,不同程度地促進神經系統新陳代謝與神經遞質釋放,被認為是腦缺血缺氧損傷頗具價值的神經保護療法[45]。TRPV1通道可調節體溫,保護缺血缺氧腦組織。二氫辣椒堿(Dihydrocapsaicin,DHC)激活TRPV1可誘導體溫降低,減輕皮質梗死及繼發產生的丘腦損傷,抑制星形膠質細胞增殖,保護神經元,并促進IS后遠期神經功能的恢復[46]。低劑量DHC聯合物理降溫可降低ROS,抑制細胞凋亡,減輕神經功能障礙,高劑量DHC則沒有表現出神經保護作用[45]。TRPV1激動劑Rinvanil激活TRPV1受體同樣可減少tMCAO小鼠O2消耗量,降低體溫,從而減輕缺血性腦損傷[47]。然而,內源性TRPV1選擇性激動劑N-油酰多巴胺誘導的低體溫則未觀察到積極的治療作用[48]。不同種類及劑量TRPV1激動劑誘導低溫的神經保護作用存在一定差異,可能由于TRPV1受體結構具有復雜性,導致在不同條件下激活TRPV1時可能同時誘導大量細胞內Ca2+進入、谷氨酸釋放,產生興奮性毒性和氧化應激等有害反應。見圖1。
3 TRPV1與中藥
我國中藥普及度高,患者依從性好,潛在受益人群廣泛,中國國家卒中登記結果顯示,70.6%的IS住院患者使用中醫藥治療[49]。目前已有多種具有神經保護作用的中藥成分被證實為TRPV1的激動劑/抑制劑。
3.1 激動劑 吳茱萸中吳茱萸堿與吳茱萸次堿被發現可激活TRPV1。吳茱萸堿促進TRPV1通道依賴的星形膠質細胞保護性自噬[50];吳茱萸次堿激活DRG中的TRPV1,增加降鈣素基因相關肽(Calcitonin Generelated Peptide,CGRP)的表達,降低血壓[51]。生姜主要成分6-姜酚通過促進TRPV1/FAF1復合物解離介導的自噬抑制核苷酸結合寡聚化結構域樣受體蛋白3(Nucleotide-binding Oligomerization Domain-like Receptor Protein 3,NLRP3)炎癥小體和凋亡[52]。羌活水提物及醇提物中均含有TRPV1激動劑,通過激活TRPV1發揮作用[53]。此外,胡椒堿與大蒜素均對TRPV1有激活作用,并能對抗缺血性腦損傷[54-57]。臨床IS常用藥全蝎與蜈蚣被發現可激活TRPV1,但其抗缺血腦損傷作用是否依賴TRPV1機制需要深入探究[58-60]。見表1。
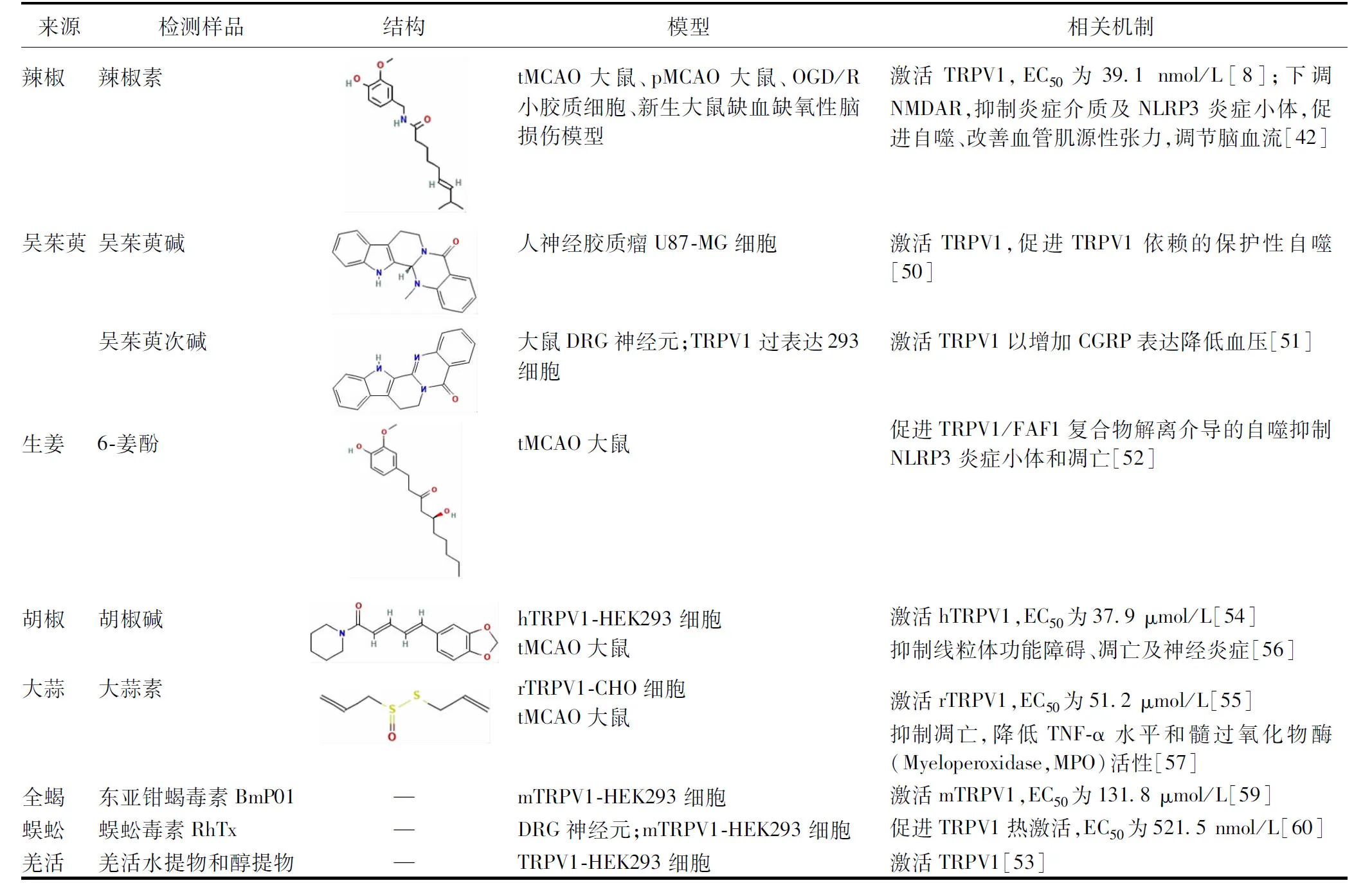
表1 中藥TRPV1激動劑在IS中的作用
3.2 抑制劑 TRPV1抑制劑中亦具有神經保護作用。天然冰片可下調海馬CA1、CA3區中TRPV1的表達,促進神經遞質γ-氨基丁酸的釋放,減少海馬神經元的損傷[61]。龍血竭中的劍葉龍血素A、B,可通過拮抗TRPV1減輕興奮性谷氨酸毒性,保護血腦屏障功能,抑制神經細胞凋亡[62]。牡荊素通過抑制TRPV1受體的過度激活,減少缺血缺氧性腦損傷新生小鼠腦梗死的體積[63]。黃芩苷及大黃素在體外均可下調DRG神經元中TRPV1 mRNA的表達水平并抑制細胞內Ca2+水平升高[64-65]。枇杷葉提取物及其有效成分熊果酸可抑制辣椒素誘導TRPV1穩轉細胞中的Ca2+內流[66]。葛根素可抑制DRG中TRPV1表達,抑制神經性疼痛[67]。此外,中藥大黃、黃連,中藥成分川芎嗪、阿魏酸、芍藥苷均可抑制TRPV1[68-72]。見表2。

表2 中藥TRPV1抑制劑在IS中的作用
4 小結
TRPV1作為TRP家族中的一類非選擇性陽離子通道,主要轉運Ca2+和Na+。激活TRPV1后脫敏,可抑制谷氨酸誘導的鈣超載及興奮性毒性,抑制TRPV1則可緩解神經炎癥。TRPV1激活還可促進自噬發生,在機體自噬不足時發揮神經保護作用。此外,激活TRPV1可維持腦血流,誘導保護性低溫,降低腦組織缺血損傷。TRPV1的多途徑調控作用為IS新藥的研發提供新思路。
5 討論
自辣椒素受體成功克隆以及冷凍電鏡解析其結構后,靶向TRPV1的研究成為全世界關注的熱點。TRPV1具有一個顯著性特征:脫敏,包括急性脫敏和快速脫敏[81]。急性脫敏即隨著激動劑刺激時間的延長,誘發的TRPV1電流振幅不斷減小;快速脫敏即指重復、短時間使用激動劑刺激,TRPV1電流振幅逐漸減小。脫敏與細胞內Ca2+水平變化密切相關[81]。TRPV1脫敏特性被認為是其發揮神經保護作用的重要策略[23,82]。辣椒素結合在蛋白的細胞內側位置以激活TRPV1通道。
目前的研究支撐辣椒素依賴TRPV1機制來抑制谷氨酸誘導的鈣超載及下調NMDA的表達,抑制興奮性毒性,極有可能由TRPV1脫敏所致[23]。其次,激活TRPV1具有促炎作用,抑制TRPV1可降低神經炎癥[32]。另外,TRPV1促進自噬,這個功能是否發揮神經保護作用取決于機體狀態,當機體自噬不足時,激活TRPV1發揮保護作用[38]。當自噬過度激活,則抑制TRPV1發揮抗缺血損傷作用[40]。此外,激活TRPV1誘導Ca2+內流引起eNOS的磷酸化從而誘導NOS產生和促進CGRP的釋放被認為是引起血管舒張的2條重要途徑。TRPV1還能夠促進側支循環維持腦血流,誘導保護性低溫,發揮神經保護作用[42,45]。總之,激動TRPV1并不能一直發揮神經保護作用。因此,臨床在選擇TRPV1相關藥物時應該緊密結合病理狀態。同時TRPV1激動劑可增加血腦屏障的通透性,可能增加出血風險,對于腦出血患者需謹慎使用[83]。
另外,TRPV1可預防中風的發生。有研究表明激活TRPV1能減少泡沫細胞的形成,抑制中風危險因素動脈粥樣硬化,延遲易卒中型自發性高血壓大鼠中風發作,延長生存時間[14,84]。近年來,越來越多的臨床研究認為辣椒素在中風后遺癥期具備良好的應用前景[85-86]。目前已有大量可作用于TRPV1受體的藥物被證實具有潛在的神經保護作用,靶向TRPV1已然成為IS藥物研發的新策略。
利益沖突聲明:無。

