谷氨酸棒桿菌和大腸桿菌生物合成L-甲硫氨酸的代謝工程改造研究進展
柳羽哲,江澤沅,高 欣,曾 琦,王鈺盛,劉曉婷,閔偉紅
(吉林農業大學食品科學與工程學院,小麥和玉米深加工國家工程實驗室,吉林 長春 130118)
L-甲硫氨酸又稱L-蛋氨酸,于1923年被Mueller在分離酪蛋白過程中發現[1],與L-賴氨酸、L-蘇氨酸及L-異亮氨酸同屬天冬氨酸族氨基酸是生命體必需的唯一含硫氨基酸[2]。在生物體內L-甲硫氨酸具備重要生理生化功能,在DNA、蛋白質合成、催化功能調節和蛋白質翻譯后修飾等過程中發揮著不可或缺的作用[3];作為合成前體和體內代謝中間體發揮重要作用,參與乙烯和多胺類物質合成,并參與細胞生長發育過程[4];還可以經過其代謝物S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)間接調節多種代謝過程,如作為甲基供體參與核酸、磷脂、蛋白質、腎上腺素、褪黑素、肌酸和其他化合物的代謝合成[5]。L-甲硫氨酸的生產方法主要包括化學合成法、生物酶拆分法、微生物發酵法[6-7]。目前,工業化生產L-甲硫氨酸的主要方式為化學合成法——丙烯醛法[8],但該方法產物為DL-混合型甲硫氨酸,存在分離困難、生產成本高、反應復雜、副產物多以及工業污染較嚴重的問題。酶拆分法生產L-甲硫氨酸所需底物較為昂貴,產生污染排放較大,不適合商業化生產。利用微生物發酵生產L-甲硫氨酸具有原料來源廣、環境友好且生產成本低的優點[9],目前隨著代謝工程策略及合成生物學工具的開發,微生物發酵法生產L-甲硫氨酸外的其他天冬氨酸族氨基酸已實現工業化[2,10]。由于L-甲硫氨酸合成途徑存在復雜的反應及多級調控機制,L-甲硫氨酸尚未實現大規模的發酵生產。研究人員及生產商將研究目標投向探究微生物發酵法替代化學合成法工業生產L-甲硫氨酸的可能性。獲得L-甲硫氨酸菌株的傳統方式是利用誘變篩選或基于代謝控制發酵原理構建,但通過誘變獲得的菌株在工業化發酵生產過程中容易出現發酵狀態不穩定、菌體營養缺陷、生產水平低等問題[11]。近年來,隨著代謝工程研究的深入,通過代謝工程優化通量并最終優化生物過程,在選育氨基酸生產菌株方面應用愈發豐富,代謝工程育種已成為誘變育種的有效替代策略。在氨基酸生產代謝工程改造過程中谷氨酸棒桿菌(Corynebacterium glutamicum)、大腸桿菌(Escherichia coli)等模式微生物已成為主要宿主[12-13]。本文對L-甲硫氨酸在C.glutamicum和E.coli中的生物代謝合成途徑及調控網絡機制、L-甲硫氨酸代謝工程改造策略的研究進展進行綜述,旨在為L-甲硫氨酸代謝工程的進一步探究提供理論依據。
1 L-甲硫氨酸的生物合成途徑及代謝網絡調控機制
1.1 L-甲硫氨酸生物合成途徑
L-甲硫氨酸的生物合成途徑包括兩個部分:中心代謝途徑和天冬氨酸族氨基酸共同途徑[14]。在中心代謝過程中,葡萄糖首先經糖酵解途徑和戊糖磷酸途徑生成磷酸烯醇式丙酮酸和丙酮酸,隨后在磷酸烯醇式丙酮酸羧化酶(phosphopyruvate carboxylase,PEPC)和丙酮酸羧化酶作用下羧化生成草酰乙酸,在天冬氨酸氨基轉移酶作用下生成L-天冬氨酸。隨后L-天冬氨酸進入天冬氨酸族氨基酸共同途徑,在天冬氨酸激酶(aspartokinase,AK)作用下L-天冬氨酸生成磷酸天冬酰胺,磷酸天冬酰胺在天冬氨酸半醛脫氫酶(aspartate semialdehyde dehydrogenase,ASD)催化下生成天冬氨酸半醛,天冬氨酸半醛隨后進入兩個途徑——L-賴氨酸合成途徑以及L-甲硫氨酸及L-蘇氨酸合成途徑。在高絲氨酸脫氫酶(homoserine dehydrogenase,HSD)催化下天冬氨酸半醛生成L-高絲氨酸,進入L-甲硫氨酸的分支代謝途徑。在L-甲硫氨酸生物合成的第一個特異性反應中,首先L-高絲氨酸的γ-羥基被激活,在C.glutamicum和E.coli中分別以乙酰輔酶A和琥珀酰輔酶A作為酰基底物用于這一激活步驟。C.glutamicum中通過高絲氨酸乙酰轉移酶(homoserine acetyltransferase,HAT)完成高絲氨酸的酰基化,生成的中間代謝產物為O-乙酰-L-高絲氨酸,對于硫的同化有兩條途徑可供選擇,可以半胱氨酸作為硫的供體,或以硫化氫為硫的供體,前者在胱硫醚γ合成酶和胱硫醚β裂解酶催化下生成胱硫醚和高半胱氨酸,后者在O-乙酰-L-高絲氨酸硫化酶作用下直接合成高半胱氨酸[15]。E.coli中高絲氨酸琥珀酰轉移酶(homoserine transsuccinylase,HTS)催化琥珀酰輔酶A和高絲氨酸縮合反應合成O-琥珀酰高絲氨酸。E.coli中只有一條硫化途徑,是以半胱氨酸為硫源,琥珀酰高絲氨酸和半胱氨酸在琥珀酰高絲氨酸裂解酶(succinyl homoserine lyase,SHL)的作用下生成胱硫醚,胱硫醚在胱硫醚裂解酶作用下生成高半胱氨酸。L-甲硫氨酸生物合成的最后一步是分別由VB12依賴型甲硫氨酸合成酶(methionine synthase,MS)和VB12非依賴型MS催化完成,前者以葉酸循環途徑產生的5-甲基-四氫葉酸為甲基供體,后者以絲氨酸分解代謝產生的5-甲基-四氫呋喃為甲基供體,為高半胱氨酸提供甲基從而合成L-甲硫氨酸,具體合成途徑如圖1所示。

圖1 L-甲硫氨酸生物合成途徑Fig.1 L-Methionine biosynthesis pathway
1.2 L-甲硫氨酸代謝網絡調控機制
L-甲硫氨酸生物合成途徑在C.glutamicum和E.coli中生物合成中間體和調節機制存在異同。在E.coli中,PEPC受到更復雜的激活和抑制作用,包括蘋果酸和天冬氨酸的反饋抑制作用。相比而言,C.glutamicum中PEPC在磷酸烯醇式丙酮酸到草酰乙酸的回補反應中發揮作用,但天冬氨酸對該酶并無調控作用[16]。
在天冬氨酸族氨基酸共同途徑中,AK作為關鍵限速酶,在E.coli中包含同工酶AKI、AKII和AKIII 3 種,分別由lysC、thrA和metL基因編碼,受L-賴氨酸、L-蘇氨酸及產物L-甲硫氨酸的反饋調節[9],3 個基因均在轉錄水平上受到調控,但只有lysC和thrA相關酶受其代謝途徑L-賴氨酸和L-蘇氨酸的反饋控制。在C.glutamicum中,僅含有1 種AK,由lysC基因編碼,受到分支途徑L-賴氨酸和L-蘇氨酸的協同反饋抑制[17]。ASD由asd基因編碼,在E.coli中其受到L-賴氨酸、L-蘇氨酸及L-甲硫氨酸的反饋阻遏,但在C.glutamicum中該酶不受終產物的抑制。HSD是天冬氨酸族氨基酸共同途徑的第二個關鍵酶,在E.coli中含有兩個同型雙功能酶AKI-HSDI和AKII-HSDII,分別由thrA和metL基因編碼,其活性受蘇氨酸的抑制[18]。在C.glutamicum中HSD是一種單功能酶,由hom基因編碼,其表達受到產物L-甲硫氨酸反饋阻遏,由于其結構C-末端ACT結構域的存在,對L-蘇氨酸的反饋抑制較為敏感[19]。在E.coli中HTS由metA基因編碼,在C.glutamicum中HAT由metX基因編碼,表達及活性均受產物L-甲硫氨酸和代謝物SAM所抑制。VB12依賴型MS和VB12非依賴型MS分別由metH基因編碼和metE基因編碼[20]。SAM是在S-腺苷甲硫氨酸合成酶(S-adenosylmethioninesynthetase,SAMS)催化下由L-甲硫氨酸和ATP反應生成,在C.glutamicum和E.coli中SAMS由metK基因編碼,其合成受L-甲硫氨酸反饋抑制[21]。C.glutamicum和E.coli中L-甲硫氨酸合成途徑的具體反饋調節信息如圖2、3所示。
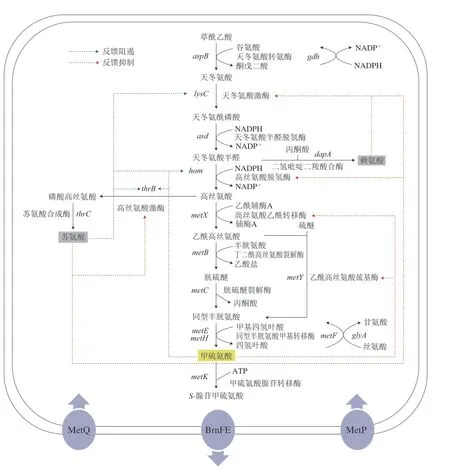
圖2 C.glutamicum中L-甲硫氨酸反饋調節Fig.2 Feedback regulation of L-methionine in C.glutamicum
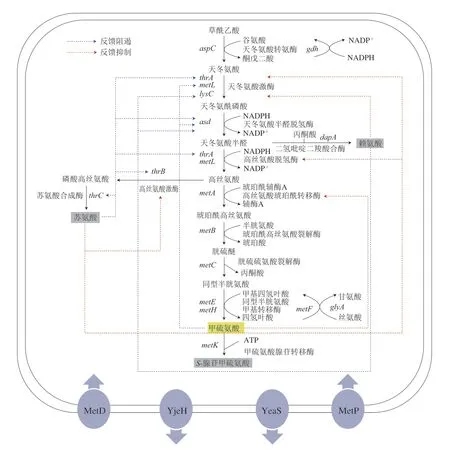
圖3 E.coli中L-甲硫氨酸反饋調節Fig.3 Feedback regulation of L-methionine in E.coli
L-甲硫氨酸生產菌經代謝工程生物合成途徑改造后,胞內氨基酸過量積累會使其代謝途徑中一些關鍵酶的催化活性受到抑制,降解途徑中的前體利用率增加,導致菌株生長受影響[22]。通過隨機突變或基因組DNA文庫的表型篩選、轉錄組學分析和序列相似性搜索技術可以確認L-甲硫氨酸的轉運蛋白,對其合理利用可調節L-甲硫氨酸的攝入和輸出[23]。在E.coli中,存在MetD和MetP兩條專一性L-甲硫氨酸的胞內運輸系統。MetD操縱子包含metN、metI、metQ,分別編碼腺苷三磷酸結合盒轉運蛋白(ABC轉運蛋白元件)——ATP酶、L-甲硫氨酸滲透酶和L-甲硫氨酸結合蛋白,MetD能夠運輸甲硫氨酸及其結構類似物[24]。E.coli中向胞外運輸甲硫氨酸存在YeaS和YjeH兩個系統。YeaS屬于RhtB運輸蛋白家族,其表達受亮氨酸調控蛋白Lrps的調節。YjeH屬氨基酸-多胺-膽堿運輸蛋白家族,類似于YeaS轉運系統的作用機制,通過增強E.coli對L-甲硫氨酸及其結構類似物的抵抗能力,促進菌體內多余L-甲硫氨酸的主動排出,從而降低胞內L-甲硫氨酸的濃度[25]。E.coli中MetJ是L-甲硫氨酸合成的重要阻遏蛋白,可抑制metL、metA、metB、metC和metE基因的表達。與MetJ不同,MetR是一類轉錄激活因子,過表達后可有效促進L-甲硫氨酸的合成。在C.glutamicum中BrnFE系統可催化L-甲硫氨酸的主動輸出[26]。C.glutamicum對L-甲硫氨酸的吸收包括兩個轉運蛋白復合體MetD和MetP,調控L-甲硫氨酸由胞內向胞外的轉運,其中MetD由metN、metI和metQ組成的基因簇編碼,屬于ABC轉運蛋白超家族MUT亞家族,其表達受轉錄因子mcbR調控;MetP由metP和metS基因編碼,屬于鈉離子能量偶聯轉運體家族,其表達形式為組成型表達[27]。
2 L-甲硫氨酸合成途徑代謝工程改造
根據代謝工程改造菌株提高目標氨基酸產量的“進、通、截、堵、出”五字策略[10],依據目標氨基酸代謝合成途徑及網絡調控機制,代謝工程L-甲硫氨酸改造策略主要包括以下5 個方面:1)解除代謝途徑對關鍵酶的反饋作用;2)阻斷或削弱支路代謝途徑;3)中心代謝調控網絡的優化;4)增強輔助因子的供應;5)轉運系統的優化。
2.1 解除代謝途徑對關鍵酶的反饋作用
如前所述,C.glutamicum和E.coli中L-甲硫氨酸合成途徑存在多分支、多水平的反饋調節,許多關鍵酶受相應代謝物的反饋抑制或(和)反饋阻遏。反饋抑制指在生物合成過程中代謝途徑終產物對相關酶引起的活性抑制調節[28]。生物合成途徑的終產物達到一定水平時對代謝途徑關鍵酶表達量的調節會引起反饋阻遏[29]。在菌株發酵產氨基酸的正向代謝工程中,解除代謝途徑關鍵酶受到的反饋調節可有效促進目標產物L-甲硫氨酸的合成,代謝流的疏通可作為一種策略提高L-甲硫氨酸產量[30]。
L-賴氨酸和L-蘇氨酸合成途徑作為L-甲硫氨酸合成的分支代謝途徑,分別通過天冬氨酸-4-半醛和L-高絲氨酸實現代謝流的競爭[31]。除來自于末端代謝產物的反饋抑制,L-甲硫氨酸合成途徑中還有一些關鍵酶受胞內中間代謝產物的抑制作用。在E.coli中AK的表達分別受L-蘇氨酸、L-賴氨酸和L-甲硫氨酸的反饋調節[9],其中lysC和thrA及由其編碼的AK分別受到L-賴氨酸和L-蘇氨酸的反饋阻遏和反饋抑制,metL受到L-甲硫氨酸反饋阻遏。在C.glutamicum中由lysC編碼的AK表達受L-蘇氨酸和L-賴氨酸的協同反饋阻遏[32],在酶活力水平上受L-賴氨酸和L-蘇氨酸的反饋抑制。C.glutamicum中構建AK定點突變體A279T和G359D,其中A279T突變體氨基酸由疏水性變為親水性致使AK分子構象改變,與配體間的非共價鍵作用被打破,G359D的突變使Arg151與底物結合位點Glu74之間無法形成離子鍵,可在一定程度上解除L-蘇氨酸和L-賴氨酸對AK的反饋阻遏[33-34]。在E.coli中HSD作為雙功能酶由thrA和metL編碼,其中基因thrA在轉錄水平上受L-蘇氨酸抑制。在C .glutamicum中,HSD活性受L-蘇氨酸的反饋抑制,其表達受到產物L-甲硫氨酸反饋阻遏,在構建C.glutamicum產L-甲硫氨酸菌株中,將HSD第377位的甘氨酸突變為谷氨酸,可消除L-蘇氨酸對HSD的反饋抑制[35]。E.coli中HTS由metA基因編碼,除受L-甲硫氨酸抑制外,其表達還受下游代謝產物SAM抑制,將HTS的第896位堿基由A突變為G或第71位堿基由C突變為A,能夠解除末端產物L-甲硫氨酸和SAM的反饋抑制[36]。
2.2 阻斷或削弱支路代謝途徑
在天冬氨酸族氨基酸共同途徑中,碳流通過天冬氨酸-β半醛和L-高絲氨酸后流向分支代謝途徑,阻斷或削弱分支代謝途徑可有效調節碳源更多流向目標氨基酸L-甲硫氨酸代謝途徑,實現L-甲硫氨酸產量的提升。主要方法包括:L-蘇氨酸和L-賴氨酸營養缺陷型的篩選,弱化L-蘇氨酸和L-賴氨酸的合成;敲除dapA和thrB基因阻斷L-蘇氨酸和L-賴氨酸的合成。C.glutamicum中,敲除基因thrB可以獲得L-蘇氨酸營養缺陷型菌株,在阻斷碳流流向L-蘇氨酸途徑的同時解除L-蘇氨酸對AK和HSD的協同反饋抑制作用[35,37-38]。在C.glutamicumATCC13032中通過對基因thrB敲除阻斷L-蘇氨酸合成途徑,對dapA中起始密碼子ATG用GTG代替,弱化L-賴氨酸合成途徑,與野生型對比,C.glutamicum工程菌L-甲硫氨酸產量增加3 倍,最終達到2.99 g/L[38]。在E.coliW3110中,通過敲除thrBC基因構建L-蘇氨酸營養缺陷型菌株,L-甲硫氨酸產量由不可檢測提升至0.008 g/L[39]。E.coliK-12/pKD46菌株中,dapA基因缺失后代謝物L-甲硫氨酸產量提高2.61 倍[40]。
2.3 中心代謝調控網絡的優化
一直以來,L-甲硫氨酸中心代謝途徑碳分布不平衡是迫切需要解決的問題,其阻礙了代謝物生物合成產量和產率的進一步提高。中心代謝調控網絡的優化主要包括碳源利用途徑的優化、副產物合成途徑的敲除、模塊化代謝工程和全局轉錄機器工程等[41]。通過細菌的轉錄、代謝組學分析可以了解菌株代謝并為后期改造提供重要線索。通量平衡分析(flux balance analysis,FBA)的使用能夠精確地計算和分析比對代謝網絡內產物的理論得率和最佳代謝途徑[42]。通過系統分析策略對中心代謝和選定的L-甲硫氨酸生物合成途徑中的80 個基因表達進行抑制或上調,利用代謝組學數據進一步揭示了中心代謝通量分布更均勻的最優菌株L-甲硫氨酸生物合成途徑,將L-甲硫氨酸生物合成途徑模塊化,同時進行迭代遺傳修飾以揭示多層限制并逐步提高L-甲硫氨酸產量,最終達到16.86 g/L[43]。L-甲硫氨酸工程菌培養發酵過程中,在發酵培養基中添加Ca2+,FBA結果表明添加CaCO3加強了三羧酸循環,使細胞內ATP濃度增加了39.28%,檸檬酸合成酶和氧化磷酸化途徑的調節是L-甲硫氨酸過量生產的重要原因,碳、ATP和輔因子通量的重新分布與E.coliW3110-BL協同改善L-甲硫氨酸生物合成效率,產量達到1.48 g/L,比未添加Ca2+的對照組高57.45%[44]。
2.4 增強輔助因子的供應
輔助因子的供給和平衡能夠避免阻礙代謝途徑,對目標氨基酸的合成效率也發揮重要作用,是氨基酸代謝工程的一個重要影響因素。相比于其他氨基酸,合成L-甲硫氨酸需要更多的輔助因子NADPH,是合成L-賴氨酸的2 倍,合成L-谷氨酸的8 倍[38]。NADPH在C.glutamicum和E.coli中以不同的方式提供。C.glutamicum中NADPH主要通過磷酸戊糖途徑中由zwf編碼的葡萄糖-6-磷酸脫氫酶以及由gnd編碼的6-磷酸葡萄糖酸脫氫酶協同催化合成。在E.coli中主要通過利用膜結合的轉氫酶完成從NADH到NADPH的轉化。增強NADPH的供應最常用的策略是重新分配糖酵解和磷酸戊糖途徑之間的代謝流量比。在C.glutamicum中將zwf基因727位點的G突變為A,gnd基因1 083位點的T突變為C,解除葡萄糖-6-磷酸脫氫酶和6-磷酸葡萄糖酸脫氫酶的反饋抑制,并異源過表達E.coli中基因gapC,細胞內NADPH水平增加448.2%,L-甲硫氨酸產量增加64.1%[45]。第二種策略是通過糖酵解產生NADPH,通過改變天然NAD依賴性甘油醛3-磷酸脫氫酶編碼基因gapA對NADP的輔酶特異性[46]。第三種策略是過量表達來自E.coli的整合煙酰胺核苷酸轉氫酶,膜結合轉氫酶編碼基因PntAB可促進NADP+向NADPH的轉化[47]。過量的NADPH會被用于代謝途徑中其他代謝物的合成,僅通過NADPH的供應促進L-甲硫氨酸的生產是有限的,利用系統代謝工程進一步提高L-甲硫氨酸產量非常必要[45]。
2.5 轉運系統的優化
用于分子轉運的載體蛋白在氨基酸代謝生物合成途徑中發揮著重要作用。L-甲硫氨酸在胞內合成后,需要盡快將合成的多余甲硫氨酸運輸到胞外,避免在胞內過量積累產生一定毒性使細胞死亡,防止L-甲硫氨酸過量引起的反饋抑制和反饋阻遏,同時有利于L-甲硫氨酸后續提取工藝的進行[48]。對L-甲硫氨酸分泌和吸收運輸協同的改造可以促進L-甲硫氨酸的胞內合成,有利于胞外積累。研究發現可通過在E.coli中敲除metN、metI、metQ基因弱化L-甲硫氨酸胞內MetD運輸系統的轉運,過表達YjeH轉運蛋白編碼基因yjeH能夠加強胞外轉運能力,但會影響菌株生長[49]。在E.coli中YeaS運輸系統的編碼基因yeaS過表達,可提升L-甲硫氨酸胞外運輸的能力[24]。對E.coli中異源引入基因cysBT149P替換E.coli內源cysB從而構建突變菌株能夠有效地解除CysB激活蛋白調控cys操縱子的調控,促進L-甲硫氨酸生物合成途徑中硫代謝相關基因的表達,提高代謝物的產量[25]。對C.glutamicum中硫代謝途徑調控因子mcbR基因進行敲除或修飾,可解除其對菌株生產能力的阻遏,使L-甲硫氨酸產量提升[37]。MetD運輸系統的表達也受轉錄因子mcbR的調控,敲除基因簇中任意基因均能夠使MetD運輸系統喪失活性[38]。C.glutamicum中過表達L-甲硫氨酸分泌系統BrnFE能使L-甲硫氨酸產量提高[37]。C.glutamicum中Lrp作為一種轉錄調控因子可影響L-甲硫氨酸的合成,通過對胞內L-甲硫氨酸濃度的響應,激活轉運蛋白BrnFE表達從而穩定胞內L-甲硫氨酸濃度[50]。在未來,結合可見光熒光響應官能團與目的轉運蛋白融合進一步改進生物傳感器的方法,可更好地用于了解細胞內L-甲硫氨酸代謝通量[23,51]。
3 L-甲硫氨酸生物合成進展
在過去的20 年里,L-甲硫氨酸在C.glutamicum和E.coli中代謝途徑和調控機制得到深入研究,人們在改進L-甲硫氨酸發酵方面不斷做出努力和貢獻。
隨著L-甲硫氨酸代謝途徑的確認,研究人員首先集中于利用基因表達調控及突變株的選育以提高L-甲硫氨酸產量。Moeckel等[52]對一株已改造的賴氨酸生產菌株中metX和metY基因過表達,弱化產物對HAT及乙酰高絲氨酸硫基酶的反饋抑制,強化L-甲硫氨酸合成途徑,最終積累量達到16 g/L。Maier等[53]在一株抗反饋抑制E.coli中敲除編碼阻遏蛋白基因metJ,并過量表達運輸蛋白編碼基因yjeH,強化合成途徑及運輸基因的表達,L-甲硫氨酸產量達到4.8 g/L。Kr?mer等[54]通過代謝途徑分析預測C.glutamicum和E.coli在L-甲硫氨酸的生產上有巨大潛力。隨后該團隊對C.glutamicum代謝途徑中調節L-甲硫氨酸生物合成和硫同化的重要基因mcbR進行敲除,使L-甲硫氨酸積累量達到3.4 g/L[55]。Park等[35]對一株已解除賴氨酸反饋抑制的C.glutamicum進行改造,通過敲除蘇氨酸途徑關鍵酶編碼基因thrB以弱化支路途徑,并提高HSD的表達量削弱反應中間代謝物帶來的反饋抑制,在搖瓶發酵后測定胞外L-甲硫氨酸積累量為2.9 g/L。
酶的定向進化、基因敲除、基因過表達等方法在L-甲硫氨酸發酵生產過程中得到廣泛應用后,研究人員漸漸投身于合成途徑的完善與整合。Qin Tianyu等[37]敲除C.glutamicum中mcbR基因釋放合成途徑相關基因的轉錄抑制,上調metX轉錄水平,過表達homFbr、lysCFbr及運輸蛋白編碼基因brnFE,增加前體供應并增加L-甲硫氨酸胞外濃度,最終L-甲硫氨酸產量達到6.3 g/L。李瑩[56]以C.glutamicumATCC13032為出發菌株,敲除編碼產物主要吸收系統基因metD,通過誘變解除末端代謝產物對甲硫氨酸合成途徑的反饋抑制作用,敲除thrB基因以阻斷L-蘇氨酸合成,對dapA、lysC、pyc基因進行定點突變以削弱分支代謝途徑并解除相關酶的反饋抑制,過表達來自丙酮丁醇梭菌的外源基因gapC,從而增強胞內NADPH供應,最終L-甲硫氨酸產量達到9.88 g/L。Huang Jianfeng等[57]以E.coliW3110為出發菌株,敲除阻遏蛋白基因MetJ、向胞內運輸L-甲硫氨酸的運輸蛋白基因MetI、過量表達metAFbr和運輸蛋白基因yjeH以提高碳流流向目標產物,加強胞外運輸能力,并用Na2S2O3為硫源,5 L發酵罐補料發酵48 h,L-甲硫氨酸終產量達到9.75 g/L。
由于L-甲硫氨酸代謝途徑存在復雜的基因表達與調控,通常只能進行局部代謝調控而較難實現對全局代謝的調控。近幾年隨著代謝工程策略與合成生物學工具的發展,以系統和全局的方式促進L-甲硫氨酸生產的相關研究逐漸顯現。Huang Jianfeng等[43]以E.coliW3110 IJ/pA*H為研究對象,基于CRISPR-Cas9技術對中心代謝途徑和氨基酸生物合成途徑進行系統分析,進一步揭示包括轉錄調節、變構調節、同型半胱氨酸甲基化、甲基四氫葉酸(tetrahydrogen folic acid,CH3-THF)供應、o-琥珀酰-L-高絲氨酸供應和L-絲氨酸在內的限制L-甲硫氨酸生物合成的6 層瓶頸,代謝組學分析結果表明,多個基因修飾能有效地重新分配代謝通量,促進L-甲硫氨酸的生物合成。魏磊[58]利用CRISPR-Cas9技術對L-甲硫氨酸合成過程的阻遏因子metJ及其競爭途徑——賴氨酸和蘇氨酸合成途徑的lysA和thrC以及sucCD進行敲除,同時定點改造AK編碼基因為產物反饋抑制不敏感型的lysCmut和thrAmut,將植物中的胱硫醚-γ-合成酶基因cgs和高半胱氨酸甲基轉移酶基因hmt和甲硫氨酸甲基轉移酶基因mmt組合在已改造后的菌株中進行過表達,L-甲硫氨酸產量最終達804 mg/L,是野生型的12 倍。Niu等[59]用FBA對重組E.coliW3110分批發酵L-甲硫氨酸的代謝通量進行分析,估算不同溶氧條件下細胞內的通量分布,發現在30%溶解氧水平下獲得的L-甲硫氨酸生產通量高于其他溶解氧水平。Zhu Wenyuan等[60]利用發酵與生物催化相結合的方法生產L-甲硫氨酸,將經系統分析優化構建的o-琥珀酰基-L-高絲氨酸生產菌E.coliW3110(DE3)ΔIJB*TrcmetL/pTrc-metAfbr-Trc-thrAfbr-yjeH經發酵提取上清液,在o-琥珀酰基-L-高絲氨酸巰基酶和甲硫醇鈉存在的情況下轉化為L-甲硫氨酸,降低菌株修飾難度,使L-甲硫氨酸產量達21.1 g/L。研究人員不斷利用C.glutamicum和E.coli進行L-甲硫氨酸代謝途徑的改造,然而合成L-甲硫氨酸的多層次調控和復雜性尚未得到解決,對L-甲硫氨酸的大規模生產之間仍然存在一些差距。隨著科學技術的不斷發展,現有研究很大程度擴展了對L-甲硫氨酸生物合成多層次多級調控的認識,并為工業化生產L-甲硫氨酸奠定基礎。表1匯總了部分L-甲硫氨酸代謝途徑改造策略。

表1 L-甲硫氨酸代謝途徑改造策略部分匯總Table 1 Summary of L-isoleucine metabolic pathway modification strategies
吉林農業大學食品科學與工程學院酶分子改造及食品營養分子調控團隊通過定向進化酶分子改造強化關鍵酶的表達,解除或削弱代謝途徑相關酶反饋抑制,并通過代謝工程構建高產L-甲硫氨酸工程菌,致力于利用微生物發酵法提高L-甲硫氨酸產量的研究[65-69]。團隊首次發現與C.glutamicum同源相似性達99%的北京棒桿菌(C.pekinense)AK單體別構酶,揭示了單體AK別構調控機制,至今已構建了140余株突變菌株,其中酶活力最大提高99.43 倍,異源表達AK優化后構建C.glutamicum工程菌PEC-lysCm-homm-metX的L-甲硫氨酸最高產量達6.85 g/L,較原菌提高274.32%,具體AK改造后酶活力提升情況如表2所示,為系統闡明關鍵酶與蛋氨酸生物合成代謝網絡相互作用關系,為棒桿菌L-甲硫氨酸合成代謝的調節和氨基酸菌種選育提供了良好借鑒。未來,團隊將集中在現有研究成果基礎上結合CRISPR技術,深入研究多分支、多水平調控氨基酸合成途徑方法,微生物發酵方法的研究以及溶氧、pH值等發酵參數的優化,以求高效改造L-甲硫氨酸生物合成途徑,推進玉米淀粉高效生物轉化L-甲硫氨酸工業化進程。
4 結語
L-甲硫氨酸作為生命體不能自主合成的必需獨特含硫氨基酸,在食品、醫藥、動物飼料、化妝品等方面應用廣泛[75-76],具有重要的工業經濟價值。近幾年,隨著代謝工程技術與合成生物學的迅速發展,適應性進化、基因組編輯、基因表達調控等廣泛開發,研究人員已將這些方法應用于L-甲硫氨酸的生產研究中。雖然已經闡明了L-甲硫氨酸合成途徑中的代謝調控機制,但通過微生物發酵生產L-甲硫氨酸尚未實現工業化。
在目前的研究報道中,提高L-甲硫氨酸產量具體策略主要包括:優良出發菌種的選擇、高產菌株的高通量篩選、合成途徑的合理選擇以及發酵條件的優化。過表達、弱化表達、定向進化和目標基因的缺失與替換等方法已被廣泛應用于優化L-甲硫氨酸生物合成途徑。以往對于生物合成L-甲硫氨酸相關的改造研究普遍集中于對天冬氨酸族氨基酸共同途徑的代謝調控,但中心代謝途徑中碳流量和輔助因子通量變化也會直接影響L-甲硫氨酸的合成能力,后續的研究可主要著重于:1)對中心代謝調控展開更細化的討論,并在產量最大化的基礎上盡量精簡調控路線,節約實驗成本;2)目前動態調控、精確調控已成為代謝工程研究的主要策略,合理利用動態調控、精細調控代謝過程以平衡菌株生長發育過程與L-甲硫氨酸合成的關系,能夠有效調節菌株生產效率并提高L-甲硫氨酸的轉化率;3)以合理設計為前提、正向代謝工程為基礎的系統代謝工程進行綜合應用,深入應用組學數據分析方法,建立計算機高級代謝網絡模型,并加強進化、反向代謝工程在高產L-甲硫氨酸代謝工程中的研究利用以提高氨基酸菌株育種效率;4)利用多學科領域交叉聯合手段綜合運用L-甲硫氨酸代謝設計,利用計算機分析建立基因組精細代謝表達調控模型指導L-甲硫氨酸生產,結合生物傳感器、新型功能元件挖掘、CRISPR基因編輯和全基因組池CRISPR干擾等技術進行L-甲硫氨酸代謝途徑改造。隨著生物信息學與合成生物學的發展與應用,未來利用代謝工程技術生產L-甲硫氨酸將有望實現工業化,L-甲硫氨酸產業將會為人們帶來更高的經濟效益。

