紫蘇精油對熱帶假絲酵母和克魯維爾畢赤酵母的抑制及機制研究
周曉紅,蔡 婷,林籽汐,張大鳳,張 珊,向文良
(西華大學食品與生物工程學院,西華大學古法釀造生物技術研究所,四川成都 610039)
蔬菜發酵是蔬菜加工的一種重要方式,通常以附著在蔬菜表面和發酵環境中的復雜微生物為媒介,在相對封閉的池或壇中自然發酵而成[1–2]。四川泡菜是中國發酵蔬菜的典型代表,因其獨特的風味和豐富的營養價值而深受廣大消費者喜愛,被譽為“川菜之骨”。自然發酵和無二次滅菌的特點使得發酵蔬菜中腐敗微生物的存在無法避免。已有研究報道克魯維爾畢赤酵母(Pichia kluyveri)和熱帶假絲酵母(Candida tropicalis)在酸性條件下生長,并產生白色膜醭(俗稱“生花”)[3–4],打破了原有微生物生態平衡并大量繁殖,進而導致發酵蔬菜腐敗,對發酵蔬菜行業造成巨大的經濟損失。因此,控制泡菜發酵過程中的“生花”現象一直是發酵蔬菜產業迫切需要解決的重要問題。
植物精油含有豐富的天然生物堿、黃酮類化合物及單萜類物質,具有優異的生物活性,在食品工業中被廣泛用作天然防腐劑,大量研究證明大多數植物精油通常被認為是安全的(GRAS)[5]。紫蘇(Perilla frutescens)是唇形科一年生的藥食同源草本植物,通常作為“生花”抑制劑用于傳統泡菜生產[6]。紫蘇精油(Perillaessential oil,PEO)是從紫蘇葉中提取的一種復雜混合物,性質溫和、無毒,具有良好的抗氧化和抗菌活性[7]。研究發現紫蘇精油的抑菌功能主要是因為其含有生物活性次級代謝產物,如醛[8]、醇[9]、萜烯[10]等,抑菌對象主要集中在常見條件致病細菌如大腸埃希氏菌、沙門氏菌、金黃色葡萄球菌[11]和糞腸球菌[12]等,此外,也有將紫蘇精油滲入殼聚糖膜中形成一種可生物降解且環保的生物復合薄膜,極大增強其抗菌性能[13]。但目前為止,關于紫蘇精油對抑制泡菜產膜璞微生物熱帶假絲酵母和克魯維爾畢赤酵母的研究鮮有報道,對其抑菌機制也尚不明確。
基于此,本文以從傳統發酵蔬菜——四川泡菜膜璞中分離的克魯維爾畢赤酵母和熱帶假絲酵母為供試菌,探究紫蘇精油對其成膜微生物的抑制作用,并分析其主要的活性成分,通過觀察菌體的細胞形態、細胞膜的完整性、蛋白質含量及膜電位的變化揭示紫蘇精油具體的抑制機理,同時分析紫蘇精油作為“白色膜璞”抑菌劑對發酵過程中泡菜風味的影響,以期為開發高效低毒的天然提取物抑菌劑提供一定的理論基礎與科學依據。
1 材料與方法
1.1 材料與儀器
新鮮蔬菜、泡菜輔料 成都某農貿市場;干紫蘇葉 毫州市鑫榮堂有限公司;克魯維爾畢赤酵母C.tropicalisSH1、熱帶假絲酵母P. kluyveriSH2 分離自傳統蔬菜泡菜的白色膜璞;馬鈴薯葡萄糖瓊脂培養基(Potato dextrose agar,PDA)(g/L):馬鈴薯200.0、葡萄糖20.0、瓊脂20.0;馬鈴薯葡萄糖培養基(Potato dextrose broth,PDB)(g/L):馬鈴薯200.0、葡萄糖20.0;正己烷、碘化丙啶(Propidium iodide,PI)、熒光探針5(6)-羧基熒光素二酸酯(5(6)-carboxyfluorescein diacetate,cFDA) 成都市科隆化學品有限公司;羅丹明123、BCA(bicinchoninic acid assay)蛋白質試劑盒 北京市索萊寶科技有限公司;Taq DNA polymerase、10×PCR Reaction Buffer(Mg2+free)、dNTP TaKaRa 公司;其他分析純 購自成都市科隆化工試劑廠;50/30 μm DVB/CAR/PDMS 萃取頭美國Supelco 公司。
M1000 PRO 多功能酶標儀 瑞士Tecan 公司;DSY 5 000X 倒置熒光顯微鏡 重慶重光實業有限公司;994 低溫超高速離心機 Thermo Scientific 公司;Scientz-IID 超聲波細胞粉碎儀 寧波新芝生物科技股份有限公司;6890 N 氣相色譜-質譜聯用儀美國Agilent 公司;T-1 Thermoblock PCR 自動擴增儀 美國Biometra Tgradient 公司;720 BR 電泳凝膠成像分析儀 美國BIP-RAD 公司。
1.2 實驗方法
1.2.1 紫蘇精油的提取 根據《中國藥典》中揮發油提取法[14]。將干紫蘇葉粉碎,采用水蒸氣蒸餾法得到淡黃色透明的紫蘇精油,棕色瓶密封,4 ℃冰箱保存。
1.2.2 紫蘇精油中成分的測定 紫蘇精油中重要揮發性成分通過GC-MS 法進行鑒定[7]。取3 mL 的樣品于頂空萃取瓶中,置于60 ℃水浴平衡15 min,隨后插入萃取頭吸附30 min 后,從GC-MS 進樣口進樣解析5 min 后取出萃取頭,色譜條件:Rtx-5MS 色譜柱,載氣為高純度氦氣,柱箱溫度55 ℃,進樣口溫度220 ℃,分流比50:1,總流量67.4 mL/min,柱流量為1.00 mL/min,壓力為119.8 kPa。升溫程序:從55 ℃開始,保持4 min 后,以10 ℃/min 升至130 ℃,保持3 min,再以6 ℃/min 升至240 ℃,保持15 min,檢測器溫度為240 ℃。質譜條件:離子化EI 源,電離電源70 eV,離子源溫度280 ℃,接口溫度240 ℃,溶劑延遲時間2 min。
1.2.3 紫蘇精油最小抑菌濃度(MIC)和最小殺菌濃度(MFC)的測定 采用Han 等[15]方法測定PEO 對C. tropicalis和P. kluyveri的MIC 和MFC。PEO用0.1%吐溫-20 配制成6.4 μL/mL 的母液,以二倍稀釋法將精油稀釋為終濃度為0.1~6.4 μL/mL 的工作液。每個樣本加入2%C. tropicalis和P. kluyveri(1.0×106CFU/mL)30 ℃下靜置培養24 h。以添加0.1%吐溫-20 的PDB 作為陰性對照,每個濃度設置3 個平行檢測其600 nm 處吸光值。紫蘇精油的最小抑菌濃度(MIC)為實驗菌株未能生長的最小濃度,同時取100 μL 96 孔板中的菌懸液(其中紫蘇精油濃度≥MIC)涂布于PDA 培養基上,30 ℃靜置孵育36 h,以肉眼不可見真菌菌落的最小濃度為紫蘇精油對菌株的最小殺菌濃度(Minimum fungicidal concentration,MFC)。
1.2.4 紫蘇精油抑菌機理研究
1.2.4.1 紫蘇精油對細胞形態的影響 根據Xiang等[16]的方法適當調整,采用掃描電鏡(Scanning electron microscope,SEM)觀察紫蘇精油對C. tropicalisSH1 和P. kluyveriSH2 細胞外部形態的影響。將培養16 h 至對數期的菌懸液調整至約1.0×106CFU/mL,加入MIC 和MFC 的紫蘇精油,以無菌PBS(pH7.4)為對照組,均放置于30 ℃,150 r/min 搖床中培養3 h后,以4000 r/min 低溫離心5 min 收集菌體,用無菌PBS(pH7.4)洗滌3 次,沖洗完成后用2.5%(v/v)戊二醛固定5 h,再將載玻片上的細胞依次在20%、40%、60%、80%和100%乙醇中脫水數次。裹上保鮮膜扎孔置于-20 ℃預凍12 h,完成預凍后置于冷凍干燥機中-45 ℃干燥36 h,最后將帶有細胞的載玻片粘貼在載物臺上濺射鍍金后鏡檢拍照。
1.2.4.2 紫蘇精油對細胞膜完整性的影響 采用熒光倒置顯微鏡觀察菌體細胞膜的完整性,使用cFDA和PI 對實驗菌株進行染色。cFDA 熒光產物能在具有完整細胞膜的細胞中積累發射綠色熒光,而PI 只能進入破損的細胞,與DNA 結合發射出紅色熒光[17]。將菌株在PDB 中30 ℃培養16 h 到對數期,調整菌液濃度至1.0×106CFU/mL,再使用不同濃度的紫蘇精油(0、MIC、MFC)處理3 h,以4000 r/min離心5 min 收集菌沉淀,用等體積的PBS 溶液(pH7.4)洗滌3 次并重懸,加入熒光探針cFDA 使得濃度為2.5 μmol/L,并于20 ℃避光下孵育5 min,隨后加入PI 染料至終濃度為0.5 μmol/L,并避光培養10 min,最后取200 μL 菌懸液置于黑色的96 孔板中在熒光倒置顯微鏡下觀察并拍照記錄,每個濃度設置3 個復孔。
1.2.4.3 紫蘇精油對細胞內蛋白質濃度的影響 將菌株在PDB 中于30 ℃培養16 h 至對數生長期,將不同濃度的紫蘇精油(0、MIC、MFC)添加到菌懸液中,并在30 ℃分別孵育0、2.0 和8.0 h,再取10 mL細胞懸浮液以4000 r/min 離心5 min 收集棄去上清,在PBS(pH7.4)溶液中完全洗滌,并重懸于10 mL PBS(pH7.4)中后,在冰浴中以450 W 通過間歇性超聲波以10 s 的間隔破碎細胞25 min,未經紫蘇精油處理的細胞用作空白對照,最后通過BCA 蛋白質試劑盒測定細胞中的蛋白質含量。
1.2.4.4 紫蘇精油對線粒體膜電位的影響 采用JC-1熒光染色法測定線粒體膜電位,根據Comas 等[18]的方法做適當調整。將對數期的菌懸液調整至約1.0×106CFU/mL,再分別加入不同濃度的紫蘇精油(0、MIC、MFC)搖床中培養3 h,以4000 r/min 離心5 min 棄掉上清再用PBS(pH7.4)沖洗3 次,將JC-1 探針在避光下加入各組菌懸液至其終濃度為10 μg/mL,混合均勻后在恒溫搖床中繼續培養16 min,使樣品中細胞與JC-1 探針充分混合。最后使用等體積的PBS 溶液(pH7.4)洗滌3 次并重懸。將每組混勻的菌液各取100 μL 于96 孔板中,每個濃度設置3 個復孔。使用酶標儀測定紅色熒光值(激發波長550 nm,發射波長600 nm)和綠色熒光值(激發波長485 nm,發射波長535 nm),線粒體膜電位由紅色熒光與綠色熒光強度比值(FI)表示。
1.2.5 紫蘇精油對膜璞的抑制及泡菜風味的影響采用四川泡菜的傳統方法制備泡菜[19],常溫下進行自然發酵(每天進行開蓋5 min)。以添加紫蘇精油至終濃度為5.0 mg/L 為實驗組(PEO);以添加無菌水為空白組(CON)。取第1、2、3、5、7 d 發酵液于20 mL 的頂空萃取瓶中,加入0.5 g 氯化鈉,15 μL 二甲基三庚酮(200 μg/L)作為內標,混合均勻。采用頂空固相微萃取方法處理樣品,密封后置于40 ℃恒溫槽中水浴加熱保溫10 min,然后插入50/30 μm DVB/CAR/PDMS 萃取頭頂空萃取30 min 后,將萃取頭插入GC 進樣口,250 ℃解吸5 min。
色譜條件:氣相色譜柱:DB-5 石英毛細管柱(30 m×0.25 mm,0.25 μm)彈性石英纖維毛細管柱;升溫程序:50 ℃保持5 min,以5 ℃/min 升至160 ℃,保持5 min,再以13 ℃/min 升至250 ℃,保持5 min;載氣(He)流速為1.20 mL/min,壓力為 100 kPa;進樣方式:不分流。質譜條件:接口溫度250 ℃,離子源溫度230 ℃,以電子轟擊(EI)為離子源,電子能量為70 eV;使用全掃描模式,掃描范圍:30~400 m/z。
1.3 數據處理
采用SPSS 21.0(IBM 公司)和GraphPad Prism 8.0 軟件(GraphPad Software 公司)進行數據處理分析,所有的分析重復3 次,結果以平均值±標準差表示。用Tukey 多重比較方法進行顯著性分析。利用Origin 2020 軟件繪制揮發性風味物質含量變化熱圖;利用SIMCA 16 軟件分析揮發性風味物質差異性。
2 結果與分析
2.1 紫蘇精油的主要成分
運用GC-MS 分析紫蘇精油中主要的揮發性成分,其中將含量前22 種成分呈現在表1 中,總質量分數為95.38%。其中芳樟醇(55.87%)、檸檬烯(11.74%)、紫蘇酮(5.02%)、桉葉油醇(4.73%)、反,反-2,4-庚二烯醛(3.90%)。成分分析表明,紫蘇精油中主要成分為單萜類化合物及其氧化物,如檸檬烯、芳樟醇、月桂烯等。Ito 等[20]發現檸檬烯和芳樟醇是紫蘇精油的主要成分,這與本研究的結果一致。有研究表明:檸檬烯與芳樟醇對一些食源性病原菌有較強的抑菌作用[21],可作為天然的防腐保鮮劑,但也有學者表明紫蘇精油中紫蘇酮和紫蘇醛也是主要的抑菌成分[8,10],本研究GC-MS 的分析結果中并未檢測出紫蘇醛,這可能是由于紫蘇的品種,生長時期與生長環境不同,導致精油組成成分的種類與比例發生改變,造成抑菌成分的差異[22]。當然,精油中存在的微量成分對抑菌活性的影響可能比精油中的主要成分更為重要,其主要成分可能與其他活性成分產生協同作用從而發揮更大的抗菌活性[23]。
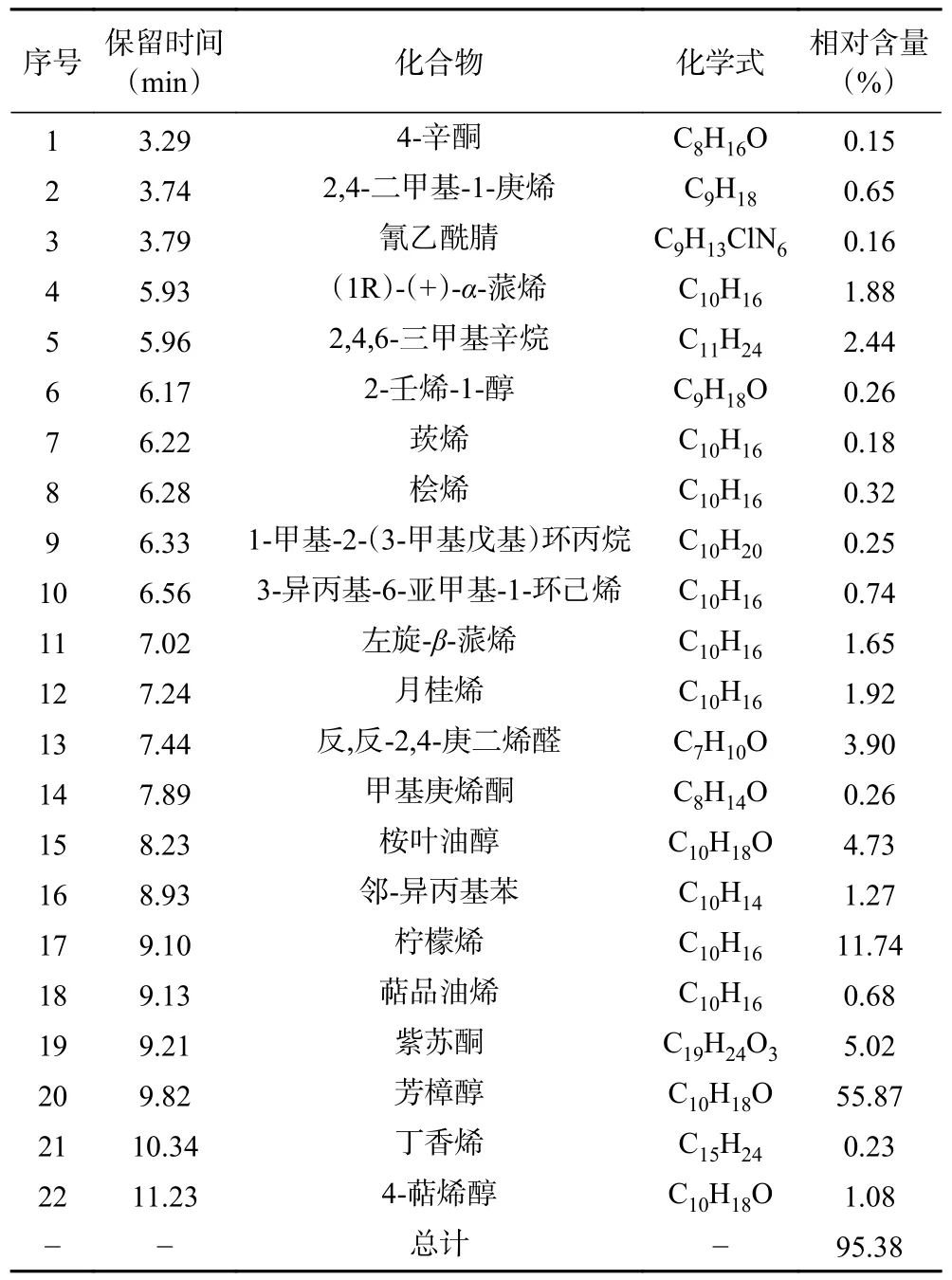
表1 紫蘇精油中主要揮發性成分Table 1 Major volatile component of PEO
2.2 紫蘇精油最小抑菌濃度(MIC)和最小殺菌濃度(MFC)的測定
MIC 和MFC 是衡量物質抑菌能力的重要指標之一[24]。通過二倍稀釋法得到紫蘇精油對C. tropicalisSH1 的MIC 值為0.4 μL/mL,MFC 值為1.6 μL/mL。對P. kluyveriSH2 的MIC 值為0.4 μL/mL,MFC 值為0.8 μL/mL(表2)。相較于菌株C. tropicalisSH1,紫蘇精油對P. kluyveriSH2 的MIC 值更小,推測P.kluyveriSH2 在紫蘇精油處理下更加敏感。這與Hu等[5]報道的紫蘇精油對黃曲霉的抑菌活性存在一定的差異,這種差異的存在可能是由于其供試菌株的特異性造成的。
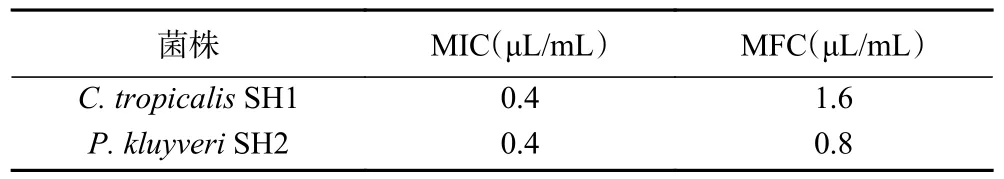
表2 紫蘇精油對C. tropicalis SH1 和 P. kluyveri SH2 的MIC 和MFC 測定Table 2 Determination of concentration MIC and MBC of C.tropicalis SH1 and P. kluyveri SH2 by PEO
2.3 紫蘇精油對細胞形態的影響
通過掃描電鏡觀察紫蘇精油對C. tropicalisSH1 和P. kluyveriSH2 細胞形態的影響,探討紫蘇精油的抑菌機理。如圖1 所示,未經處理的C. tropicalisSH1 與P. kluyveriSH2 具有正常的結構形態,細胞表面光滑完整,未出現細胞破損(圖1A、圖1D)。而經MIC 紫蘇精油處理的細胞均受到明顯的形態學損傷,表面出現皺褶和不規則的紋路,細胞之間發生堆積并粘附聚集(圖1B、圖1E),此外相互交聯的C. tropicalisSH1 被一層透明的膜包裹(圖1B)。經MFC 的紫蘇精油處理時,C. tropicalisSH1 表現出更明顯的皺縮(圖1C、圖1F)。結果表明紫蘇精油能夠改變C. tropicalisSH1 和P. kluyveriSH2 正常的細胞形態。
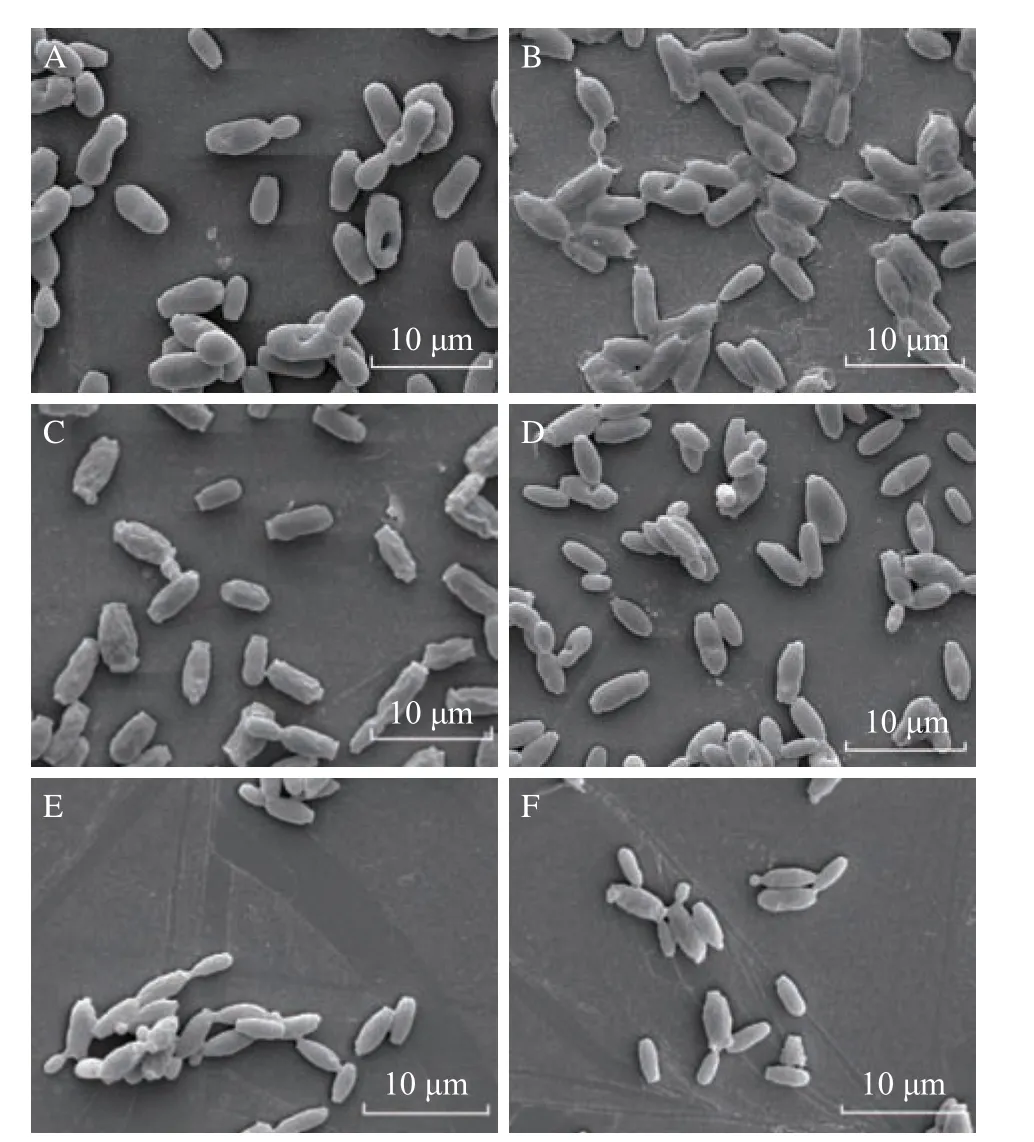
圖1 紫蘇精油對 C. tropicalis SH1 和 P. kluyveri SH2細胞形態的影響Fig.1 Effects of PEO treatment on morphology of C. tropicalis SH1 and P. kluyveri SH2
2.4 紫蘇精油對細胞膜完整性的影響
細胞膜的完整性可通過核酸熒光探針cFDA 和PI 判定[17],并在熒光倒置顯微鏡下進行觀察。結果如圖2 所示,未經處理的細胞發射出明亮的綠色熒光(圖2A、圖2D),表明細胞膜形態完整。而MIC紫蘇精油處理后,紅色熒光強度增強,綠色熒光開始減弱(圖2B、圖2E),說明紫蘇精油在一定程度上破壞了C. tropicalisSH1 和P. kluyveriSH2 的細胞膜完整性。隨著紫蘇精油濃度增加,紅色熒光顯著增加,視野中幾乎無綠色熒光(圖2C、圖2F),說明高濃度的紫蘇精油對細胞膜破壞程度更大。Liu 等[25]也證實了芳樟醇可以穿過細胞膜,改變膜組成,增加膜的流動性,最終破壞細胞膜的完整性,而在本實驗中發現紫蘇精油中的芳樟醇含量最高,因此,紫蘇精油破壞細胞膜作用其很可能由精油中的芳樟醇貢獻。

圖2 紫蘇精油對C. tropicalis SH1 和 P. kluyveri SH2 細胞膜完整性的影響Fig.2 Effects of PEO on cell membrane integrity of C.tropicalis SH1 and P. kluyveri SH2
2.5 紫蘇精油對細胞內蛋白質濃度的影響
紫蘇精油對細胞內蛋白質濃度的影響如圖3 所示。對照組蛋白質含量在8 h 內呈上升趨勢。與對照組相比,MIC 紫蘇精油處理2 h 后,C. tropicalisSH1和P. kluyveriSH2 細胞內蛋白質的濃度分別降低了60.93%、42.95%,MFC 紫蘇精油處理后蛋白濃度下降了72.92%和64.58%。表明紫蘇精油可影響細胞膜的完整性,導致蛋白質濃度顯著下降(P<0.001)。此外,其胞內蛋白質泄露量與精油的處理濃度、處理時間呈正相關。當處理時間為8 h 時,蛋白質下降程度更為明顯。研究結果表明:紫蘇精油能夠破壞菌體細胞膜,增加其通透性,造成胞內大分子物質流出,從而導致菌體死亡。Yu 等[26]證實了檸檬烯能破壞熱帶假絲酵母的細胞膜,從而使得胞內的大分子物質通過細胞膜滲漏至胞外,而在本研究中發現紫蘇精油中含有11.74%的檸檬烯,與結果較為符合。
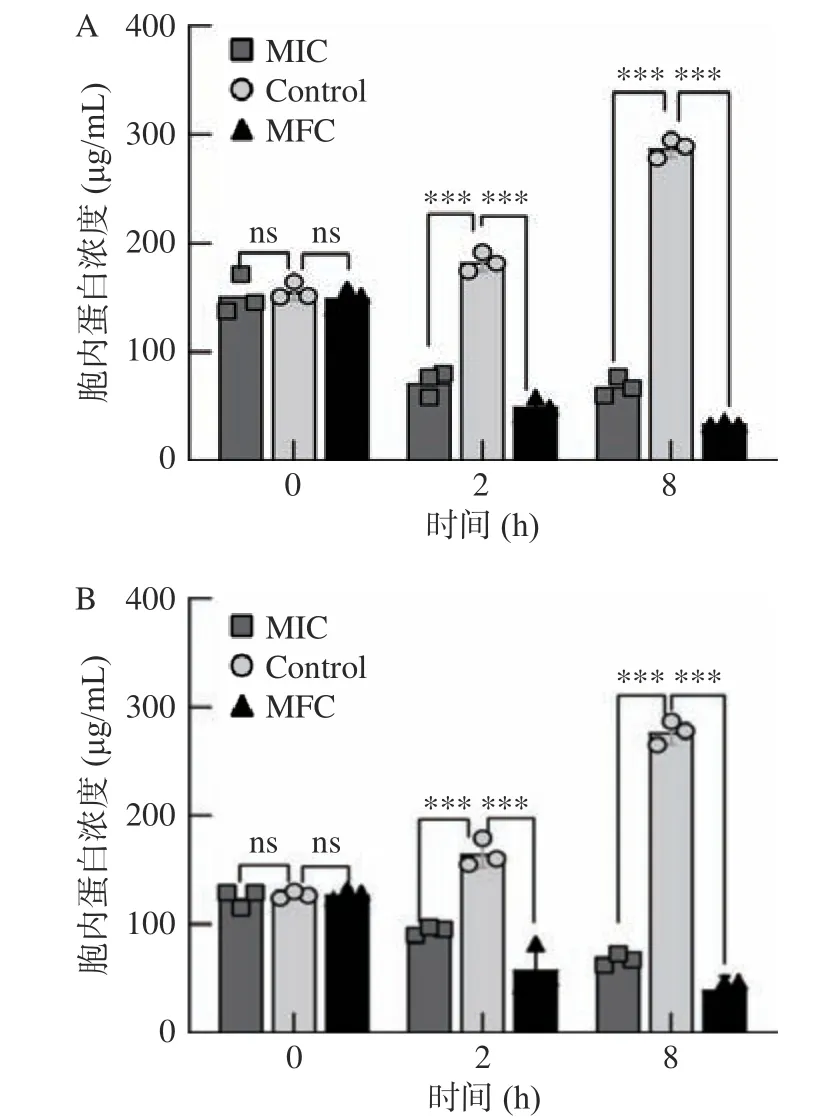
圖3 紫蘇精油對C. tropicalis SH1(A)和P. kluyveri SH2(B)胞內蛋白濃度的影響Fig.3 Effects of PEO on intracellular protein of C. tropicalis SH1 (A) and P. kluyveri SH2 (B)
2.6 紫蘇精油對線粒體膜電位的影響
線粒體膜電位(Mitochondrial membrane potential,MMP,△Ψm)是線粒體發揮功能的必要前提,當△Ψm 下降通常被認為是在細胞形態學改變前普遍出現的現象。JC-1 熒光探針在△Ψm 正常時聚集在線粒體基質中并激發出紅色熒光。相反,發生去極化時,△Ψm 降低,JC-1 熒光探針從線粒體內釋放,逆轉為激發出綠色熒光的單體。通過檢測細胞紅色熒光值可測定菌株的線粒體膜電位[24]。經MIC、MFC 的紫蘇精油處理后C. tropicalisSH1 和P. kluyveriSH2的△Ψm 均顯著下降(P<0.05)(圖4),且表現出濃度依賴性。Yang 等[27]研究者報道了植物精油能夠通過破壞線粒體的膜電位來誘導Penicillium italicum細胞的凋亡,造成不可逆的損傷。
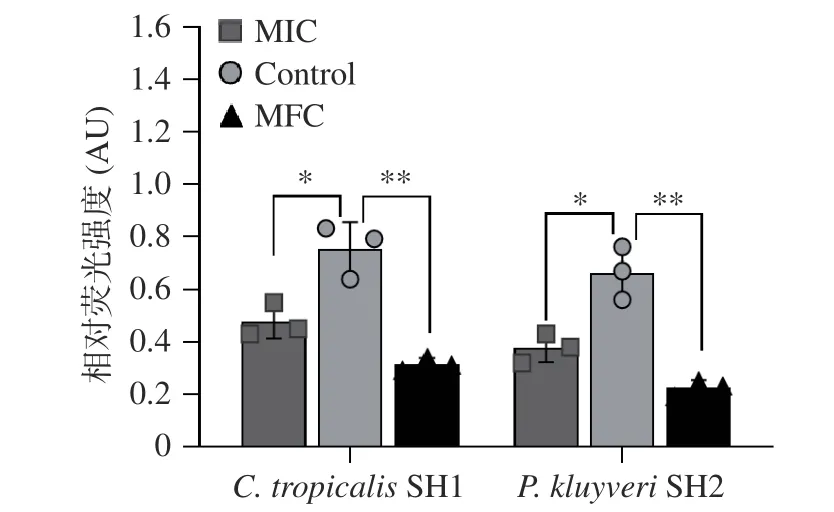
圖4 紫蘇精油對C. tropicalis SH1 和P. kluyveri SH2 線粒體膜電位的影響Fig.4 Effect of PEO on mitochondrial membrane potential of C. tropicalis SH1 and P. kluyveri SH2
2.7 發酵過程中紫蘇精油對膜璞的抑制及對揮發性物質的影響
2.7.1 紫蘇精油對膜璞的抑制作用 隨著泡菜發酵的進行,在第3 d 空白組液面開始出現零星膜狀物質,到第7 d 泡菜液表面出現一層厚實的褶皺膜璞,汁液變渾濁,蔬菜發生褐變等腐敗現象。而加入紫蘇精油的泡菜發酵5 d,汁液仍清亮透明,蔬菜顏色鮮亮,從腌制7 d 開始,液面才浮現一層薄薄的膜璞(圖5),因此紫蘇精油可有效改善泡菜的“生花”腐敗現象。

圖5 紫蘇精油對四川泡菜膜璞的抑制作用Fig.5 Inhibitory effect of PEO on the membrane of Sichuan pickles
2.7.2 揮發性風味物質的熱圖及聚類分析 利用SPME-GC/MS(solid-phase microextraction gas chromatography-mass spectrometry)在CON 和PEO 組發酵液中共檢測到99 種揮發風味物質(Volatile flavor compounds,VOCs),可歸類為酮類、烯烴類、醇類、芳香族化合物、酯類、酸類、含硫化合物、醛類、醚類、酚類、烷烴類(圖6)。在蔬菜的自然發酵過程中,紫蘇精油引起酮類、酯類和含硫化合物含量發生明顯變化,在整個發酵過程中,與CON 組相比,PEO 組的酮類物質含量更高且種類更加豐富,此外,PEO 組的含硫化合物較CON 組有所減少。與酮類物質相似,PEO 組中的酯類物質較CON 組高,CON 組在發酵第2 d 酯類物質總量最高,而PEO組則是有所延遲,在發酵第3 d 其含量達到最高112.35 μg/L。

圖6 發酵過程中揮發性風味物質含量變化Fig.6 Volatile flavor compounds content changes during fermentation
2.7.3 揮發性風味物質的OPLS-DA 分析 揮發性成分是傳統發酵食品最重要的特征之一,也是決定其食品質量的主要因素[28]。利用SIMCA 16.0 軟件對CON 和PEO 發酵過程中的揮發性風味物質進行正交偏最小二乘判別(OPLS-DA)分析處理,其結果如圖7。OPLS-DA 模型通過將X 軸矩陣信息分解成與Y 相關和不相關的兩類信息,能夠過濾掉與分組不相關的變量,結合差異性變量的重要性投影值(variable importance in the projection,VIP),從而使獲得的差異性代謝物更加可靠[29]。通過OPLS-DA模型快速準確地篩選出紫蘇精油對發酵蔬菜的差異揮發性風味物質,探究紫蘇精油對發酵蔬菜揮發性風味物質形成的影響。

圖7 OPLS-DA 分析結果Fig.7 OPLS-DA analysis result
圖7A 表示CON 和PEO 兩組中總揮發性物質的分布情況,圖7B 表示所有揮發性物質對兩組發酵樣品的差異貢獻情況。結果表明采用偏最小二乘法判別分析方法,對于CON 和PEO 兩組樣本具有良好的分離性(圖7A),區分顯著,并都處于95%置信區間內。圖7B 表示不同揮發性化合物與兩組發酵樣品的差異相關性,化合物離坐標中心點越遠,代表化合物對樣品之間的差異性越大,結合圖7C,共有22 種揮發性風味物質的貢獻值(VIP)值均大于1,說明這些揮發性風味物質的兩組間含量存在顯著性差異。其中,丁香三環烯、石竹烯、(-)-異丁香烯、檜烯、庚醛、紫蘇酮、順-A,A-5-三甲基-5-乙烯基四氫化呋喃-2-甲醇僅在PEO 組中檢出,香葉醇僅在CON 中檢測到,醇類與烯烴類物質是導致兩組樣品區分開的重要因素。在發酵第5~7 d 在CON 組檢測到硫化物,二甲基二硫和二甲基三硫是許多發酵產物中的微量成分,給樣品帶來典型的臭味,對發酵風味有顯著的負面影響。Ao 等[30]報道二甲基硫化物是變質四川泡菜的主要刺激性氣味,PEO 組的二甲基硫化物含量顯著低于CON 組,研究表明紫蘇精油的加入顯著降低了異味,提高了泡菜的整體可接受度。
3 結論
本研究通過GC-MS 分析鑒定了紫蘇精油中的主要成分,其中含量相對較高的化合物依次是芳樟醇(55.87%)、檸檬烯(11.74%)、紫蘇酮(5.02%)、桉葉油醇(4.73%)、反,反-2,4-庚二烯醛(3.90%)。紫蘇精油可以有效抑制四川泡菜中產膜璞微生物C.tropicalis和P. kluyveri的生長,對兩株菌的MIC 值均為0.4 μL/mL,對C. tropicalisMFC 值為1.6 μL/mL,P. kluyveriMFC 值為0.8 μL/mL。紫蘇精油對C.tropicalis和P. kluyveri的抑制作用主要通過破壞細胞膜,增大其通透性,破壞線粒體膜電位,導致胞內蛋白質泄露,引起細胞代謝紊亂發揮抑菌效果。同時,紫蘇精油作為抑菌劑添加到四川泡菜中,可以賦予其一定的風味。后續研究將采用組學方法,從分子層面上進一步探究紫蘇精油的抑菌機制,為構建及優化泡菜防腐的方法提供理論依據,對評估紫蘇精油及其生物活性化合物在食品加工與保存中的開發利用具有重要指導意義。

