酸棗仁不同極性部位成分含量與抗氧化活性及其相關性分析
周文文,劉 暉,徐志佳,肖鳳琴,李 波,楊亦柳,李光哲, ,嚴銘銘,2,
(1.長春中醫藥大學,吉林長春 130117;2.吉林省中藥保健食品科技創新中心,吉林長春 130117)
氧化應激(Oxidative stress,OS)是指各種因素造成的活性氧(Reactive oxygen species,ROS)生成過量或降解減少,導致體內氧化與抗氧化作用失衡,具體表現為當機體處于氧化應激態時,體內產生大量的自由基,如超氧化物自由基(O2-·)、羥自由基(·OH)、一氧化氮自由基(·NO)、單線態氧(1O2)和過氧化氫(H2O2)等,攻擊脂質、蛋白質和DNA 等生物大分子[1]。研究發現長時間處于氧化應激會造成機體氧化損傷[2],最終誘導炎癥的產生,導致各類慢性疾病及神經退行性疾病的發生和惡化[3]。
酸棗仁是鼠李科植物酸棗的干燥成熟種子,味酸、甘,平,微溫,具有養肝寧心,鎮定安神,斂汗生津等作用[4]。研究發現,酸棗仁在改善睡眠、抗抑郁、增強免疫力、改善記憶、抗氧化方面具有良好的藥理活性[5],臨床上常被用于治療失眠等中樞神經系統疾病。現代研究表明酸棗仁中富含有多種有效活性成分,包括黃酮類、皂苷類、脂肪酸、生物堿以及其他生物物質等120 多種成分[6],其中黃酮類[7]、皂苷類[8]、酚酸類[9]是酸棗仁發揮抗氧化活性的主要物質基礎,可通過清除自由基、提高抗氧化酶活性等途徑發揮一定的抗氧化作用,進而發揮疾病預防以及治療作用[10]。同時,酸棗中礦物質、多糖、膳食纖維的含量也非常豐富,有很高的食用價值。酸棗仁因其具有良好的食品功能特性被廣泛應用于功能性食品的研究與開發中[11],如酸棗仁果汁飲品等[12],屬于藥食同源資源。
目前,臨床對于酸棗仁抗氧化活性的研究多基于酸棗仁單體,有關酸棗仁不同極性部位抗氧化活性的研究內容較少,且對于酸棗仁不同極性部位成分含量對其抗氧化活性的影響尚未見研究報道。因此本研究通過運用偏最小二乘回歸分析法(PLS)對酸棗仁不同極性部位的成分含量及抗氧化活性進行研究,解釋其內在的相關性,旨在篩選出最佳活性部位,明確酸棗仁發揮抗氧化作用的物質基礎。為酸棗仁抗氧化產品的開發利用提供科學依據。
1 材料與方法
1.1 材料與儀器
酸棗仁藥材飲片(產地:山西、批號:50918006、執行標準:《中國藥典》2020 年版一部、生產企業:河北仁心藥業有限公司) 吉林省仙草醫藥藥材有限公司;石油醚、三氯甲烷、乙酸乙酯、正丁醇、H2O2、過硫酸鉀 分析純,北京化工廠;沒食子酸(批號:110831-200302)、蘆丁(批號:100080-200707)、酸棗仁皂苷A(批號:110734-201713)、斯皮諾素(批號:111869-201704)標準品 上海源葉生物科技有限公司;DPPH、ABTS 上海麥克林生化科技有限公司;DME/F-12 1:1(1X)培養基、FBS(胎牛血清)、P/S(青鏈霉素雙抗溶液)、0.25%胰蛋白酶溶液、二甲基亞砜、1×PBS(磷酸鹽緩沖液) 美國Gibco 公司;人神經母細胞瘤細胞(SH-SY5Y) 武漢普諾賽生命科技有限公司;其他試劑 均為國產分析純。
AB265-S 型電子分析天平 梅特勒-托利多儀器(上海)有限公司;DT2000 電子天平 美國奧豪斯儀器有限公司;KQ-250B 型超聲波清洗器 江蘇省昆山市超聲儀器有限公司;HH-6 型數顯恒溫水浴鍋金壇市佳美儀器有限公司;DZF-6053 真空干燥箱上海市一恒科學儀器有限公司;DZTW 型電子調溫電熱套 北京市光明醫療儀器有限公司;UV-1700型紫外分光光度計 日本島津有限公司;Infinite M200PRO 型全自動酶標儀 瑞士Tecan 有限公司;CO2培養箱 美國Thermo 有限公司;SHIMADZU 2010A 型高效液相色譜儀 日本島津有限公司;Alltech ELSD 6000 型蒸發光散射檢測器 美國奧泰有限公司。
1.2 實驗方法
1.2.1 酸棗仁不同溶劑部位獲取 采用傳統的水煎煮法,取酸棗仁飲片,置于圓底燒瓶中,加入10 倍量蒸餾水,加熱煮沸、回流提取2 次,每次2 h。過濾,合并濾液,將提取液濃縮至50 mL。依次使用石油醚、三氯甲烷、乙酸乙酯、正丁醇萃取,萃取體積比為1:1,振搖1 min,靜置20 min 后將有機層收集至蒸發皿,每種溶劑萃取三次,合并萃取液,揮干溶劑后分別得水提取物S1(出膏率23.4%)、石油醚萃取物S2(出膏率1.2%)、氯仿萃取物S3(出膏率0.9%)、乙酸乙酯萃取物S4(出膏率2.6%)、正丁醇萃取物S5(出膏率3.3%)。
1.2.2 酸棗仁不同極性部位主要成分含量測定方法1.2.2.1 總多糖測定 參照萬曉瑩等[13]的方法,以葡萄糖為標準品,取樣品0.2 mL 于10 mL 比色管中,加蒸餾水補至2 mL,加入5%苯酚溶液1 mL,混勻,加入濃硫酸5 mL,混勻;37 ℃加熱30 min,立即轉入冷水浴中冷卻至室溫,在488 nm 測定吸光度值A。制備得回歸方程為y=5.7093x-0.0426(R2=0.9994),以此計算樣品中總多糖含量。
1.2.2.2 總皂苷測定 參考崔小芳[14]的方法,以酸棗仁皂苷A 為標準品,取各樣品50 μL 于10 mL 比色管中,60 °C 水浴揮干,加入新配制的5%香草醛冰醋酸溶液0.2 mL,高氯酸0.8 mL,混勻,于60 °C 恒溫水浴加熱15 min,取出。迅速冷卻,加冰醋酸5 mL,搖勻。在472 nm 下測定吸光度值A。制備得回歸方程為y=3.8374x-0.0022(R2=0.9994),以此計算樣品中總皂苷含量。
1.2.2.3 總黃酮測定 參考Kurkina 等[15]的方法,以蘆丁為標準品,取各樣品1 mL 于10 mL 比色管中,加入5% NaNO2溶液0.3 mL,混勻,靜置6 min,再加入10% Al(NO3)3溶液0.3 mL,混勻,靜置6 min,再加入4% NaOH 溶液4.0 mL 混勻后靜置15 min,最后用80%乙醇定容至10 mL。在510 nm 下測定吸光度值A。制備得回歸方程為y=1.2446x-0.0079(R2=0.9992),以此計算樣品中總黃酮含量。
1.2.2.4 總酚酸測定 參考楊勇等[16]的方法,以沒食子酸為標準品,取各樣品0.5 mL 于10 mL 比色管中,加入福林酚試劑0.5 mL,混勻,6 min 后再加入20% Na2CO3溶液1.5 mL,混勻,用蒸餾水稀釋至10 mL,室溫下反應2 h(避光)。在743 nm 下測定吸光度值A。制備得回歸方程為y=10.412x+0.059(R2=0.9979),以此計算樣品中總酚酸含量。
1.2.2.5 酸棗仁皂苷A 含量測定 參考2020 版《中國藥典》一部酸棗仁項下的含量測定方法[17],以酸棗仁皂苷A 為標準品,HPLC 法測定樣品中酸棗仁皂苷A 含量,色譜柱為Apollo-C18(250 mm×4.6 mm,5 μm)。取酸棗仁皂苷A 對照品適量,精密稱定,加甲醇制成每1 mL 含0.1 mg 的溶液,即得酸棗仁皂苷A 標準品溶液;精密稱量5 種提取物各1 g,放入具塞錐形瓶中,精密量取50 mL 色譜甲醇加入錐形瓶中,超聲處理30 min 后,用甲醇補重。吸取1 mL,用0.22 μm 微孔膜過濾,即所得供試品溶液。分別精密吸取對照品溶液5、20 μL,供試品溶液10 μL,注入液相色譜儀,測定,用外標兩點法對數方程計算,測定各樣品中酸棗仁皂苷A 含量。
1.2.2.6 斯皮諾素含量測定 參考2020 版《中國藥典》一部酸棗仁項下斯皮諾素含量測定的方法[17],以斯皮諾素為標準品,HPLC 法測定樣品中斯皮諾素含量,色譜柱為Apollo-C18(250 mm×4.6 mm,5 μm)。取斯皮諾素對照品適量,精密稱定,加甲醇制成每1 mL 含0.1 mg 的溶液,即得斯皮諾素標準品溶液。精密稱量5 種提取物各1 g,放入具塞錐形瓶中,精密量取50 mL 色譜甲醇加入錐形瓶中,超聲處理30 min 后,用甲醇補重。吸取1 mL,用0.22 μm 微孔膜過濾,即得供試品溶液。分別精密吸取對照品、供試品溶液各10 μL,注入液相色譜儀,測定各樣品中斯皮諾素含量。
1.2.3 抗氧化能力測定 樣品預處理:分別取各樣品稱量0.2、0.4、0.6、0.8、1.0、1.2 mg,溶于1 mL 蒸餾水中,超聲30 min,12000 r/min 離心10 min,取上清液作為待測溶液。
1.2.3.1 超氧陰離子清除率測定 采用鄰苯三酚自氧化法[18]。Tris-HCl(50 mmol/L,pH8.2)和鄰苯三酚溶液(濃度為6 mmol/L)于25 ℃預熱20 min。在96 孔板中加入150 μL Tris-HCl、30 μL 樣品溶液、30 μL 預熱過的鄰苯三酚,25 ℃保溫4 min,加20 μL濃鹽酸,于420 nm 處測定吸光度值A1。以蒸餾水替代樣品溶液作為A0。以蒸餾水代替鄰苯三酚作為樣品對照A2。按下式計算超氧陰離子的清除率:
1.2.3.2 羥基自由基清除率測定 采用水楊酸法[19]測定對羥基自由基的作用,取96 孔板,每孔分別加入50 μL 樣品、50 μL 硫酸亞鐵溶液(6 mmol/L)、50 μL 過氧化氫(6 mmol/L),于37 ℃恒溫加熱10 min 后加入50 μL 水楊酸(6 mmol/L),于37 ℃恒溫加熱30 min 后在510 nm 處測定吸光度值A1。以蒸餾水代替樣品液,測定吸光度值A0;以1 mL 蒸餾水代替過氧化氫溶液,測定吸光度值A2。羥基自由基清除率計算公式同1.2.3.1。
1.2.3.3 DPPH 自由基清除率測定 參照陳冰丹等[20]的實驗方法,在96 孔板中,每孔加入100 μL 樣品水溶液,100 μL DPPH 溶液,于暗室反應30 min,在517 nm 處測定吸光度值A1;以甲醇代替DPPH 溶液作為樣品對照組,測定吸光度值A2;以蒸餾水代替樣品液作為空白對照組,測定吸光度值A0。DPPH 自由基清除率計算公式同1.2.3.1。
1.2.3.4 ABTS+自由基清除率測定 參照羌宇等[21]的實驗方法,將2 mL 7.4 mmol/L ABTS 儲備液與35.2 μL 2.6 mmol/L K2S2O8混勻,靜置12~16 h,配成ABTS 工作液。取1 mL ABTS 工作液,用pH 為7.4 的PBS 溶液稀釋,要求在常溫下734 nm 處吸光值為0.7±0.2。將0.2 mL ABTS 工作液與10 μL 不同濃度樣品混合,常溫避光反應6 min,在734 nm 波長測定吸光度,平行3 次。ABTS+自由基清除能力由下式計算:
式中,A1為樣品+ABTS 溶液吸光度值,A0為PBS 溶液+ABTS 溶液的吸光度。
1.2.3.5 對H2O2所致SH-SY5Y 細胞氧化損傷保護能力測定 參考張妹等[22]方法,采用DME/F-12 1:1 培養基(10% FBS,1% P/S)培養SH-SY5Y 細胞,取對數生長期的SH-SY5Y 細胞以5×103個/孔均勻接種于96 孔板中,待細胞貼壁后,棄去培養液,分別稱取S1、S2、S3、S4、S5,溶于培養基中,按生藥量記母液濃度為1.2 g/L,用培養基稀釋至5、10、20、40、60 mg/L,每孔給藥10 μL。用酸棗仁不同提取部位對細胞預保護6 h,再與250 μL H2O2共同作用于SH-SY5Y 細胞株24 h 后,采用CCK-8 法檢測細胞活力。
1.3 數據處理
使用SPSS 22.0 統計學軟件對數據進行統計學分析,應用方差分析進行顯著性分析,以P<0.05(雙側)為差異有統計學意義。采用皮爾遜法進行相關性分析;運用SPSS 26.0 進行偏最小二乘回歸分析[23]。
2 結果與分析
2.1 酸棗仁不同極性部位成分含量分析結果
酸棗仁皂苷A、斯皮諾素含量測定HPLC 色譜圖見圖1、圖2。由表1 可知,在五種不同極性萃取部位中,總黃酮、總皂苷、酸棗仁皂苷A、斯皮諾素在S5 萃取部位中成分含量最高,分別為(23.18±0.20)、(21.62±0.23)、(0.3119±0.017)、(0.70±0.024)mg/g,根據相似相溶原理,說明酸棗仁中所含有的總黃酮類、皂苷類、酸棗仁皂苷A、斯皮諾素被中強極性(正丁醇)溶劑富集,可能是因為這些物質屬于中強極性物質;總酚酸、總多糖在S1 萃取部位成分含量最高,分別為(7.52±0.09)、(17.40±0.47)mg/g,說明酸棗仁中所含有的酚酸、多糖類化學物質可被強極性(水)溶劑富集,推測這些物質屬于強極性物質。
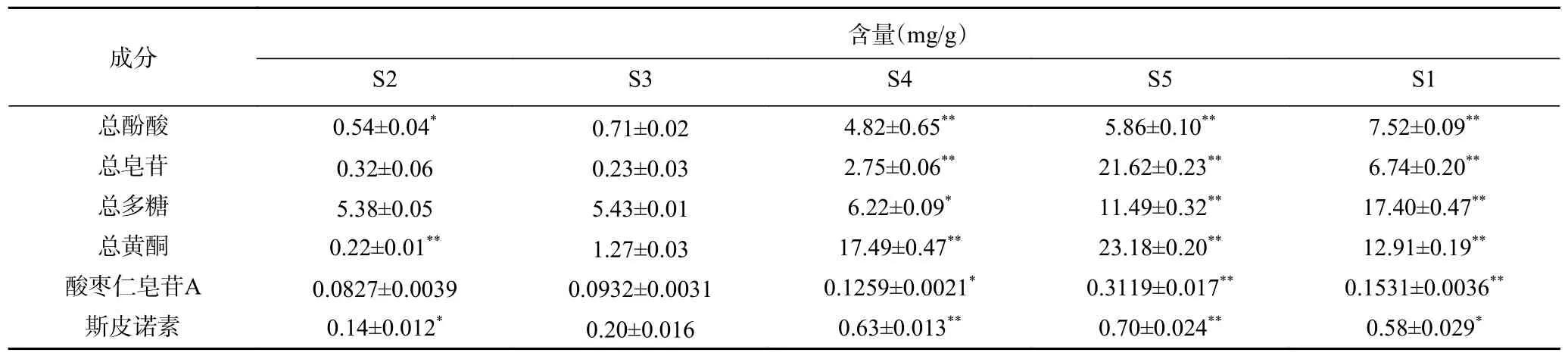
表1 酸棗仁不同極性部位成分含量Table 1 Contents of components in different polar parts of Semen Ziziphi Spinosae
圖1 酸棗仁皂苷A 高效液相色譜圖Fig.1 High performance liquid chromatogram of jujuboside A
圖2 斯皮諾素高效液相色譜圖Fig.2 High performance liquid chromatogram of spinozol
2.2 酸棗仁不同極性部位的抗氧化活性
2.2.1 酸棗仁不同極性部位對DPPH 自由基的清除作用 由表2 可知,酸棗仁不同極性部位提取物對DPPH 自由基均有一定的清除能力。隨著濃度的增加,不同提取物對DPPH 自由基清除率與其濃度呈良好的線性正相關關系。在相同濃度下不同極性部位對DPPH 自由基清除能力大小順序為:VC>S5>S1>S2>S3>S4,其中在濃度為1.2 mg/mL 時,S5 萃取部位對DPPH 自由基清除能力最強,為87.94%,接近于陽性對照組VC的清除能力。這可能是由于在酸棗仁S5 萃取部位中總黃酮類、總皂苷類化學物質成分含量較高,DPPH 自由基可與其很好地結合,因此對DPPH 自由基的清除能力較強。該結果與謝紅[24]酸棗仁皂苷體外抗氧化活性研究結果一致,具有一定科學性。表明酸棗仁S5 萃取部位對DPPH 自由基有較強的清除能力。
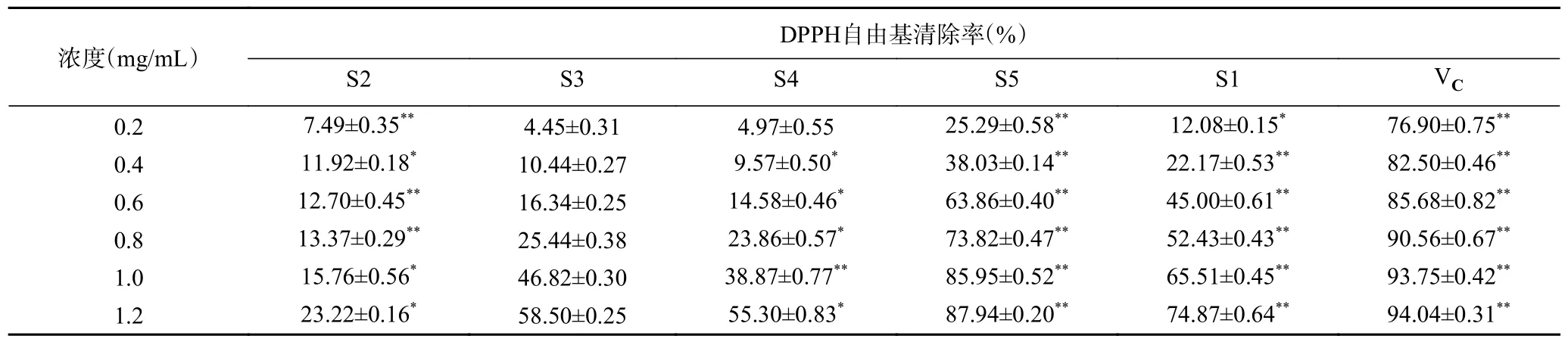
表2 酸棗仁不同極性部位對DPPH 自由基清除能力Table 2 Ability of different polar parts of Semen Ziziphi Spinosae to remove DPPH free radicals
2.2.2 酸棗仁不同極性部位對ABTS+自由基的清除作用 提取物溶液加入ABTS+自由基溶液后,ABTS+自由基溶液會與提取物抗氧化成分發生反應,生成穩定化合物,溶液褪色,因此說明清除能力越好抗氧化活性越高[25]。由表3 可知,酸棗仁不同極性部位提取物對ABTS+自由基均有較強的清除作用,且在0.2~1.2 mg/mL 范圍內時,酸棗仁不同極性部位提取物對ABTS+自由基清除活性隨質量濃度的增加而增強。在相同濃度下不同極性部位對ABTS+自由基清除能力大小順序為:VC>S5>S1>S4>S3>S2,其中濃度為1.2 mg/mL 時,S5 萃取部位對ABTS+自由基清除率最高,為93.25%±0.74%,接近于VC標準品。表明S5 萃取部位具有較強的ABTS+自由基清除能力,可以進一步地研究開發。
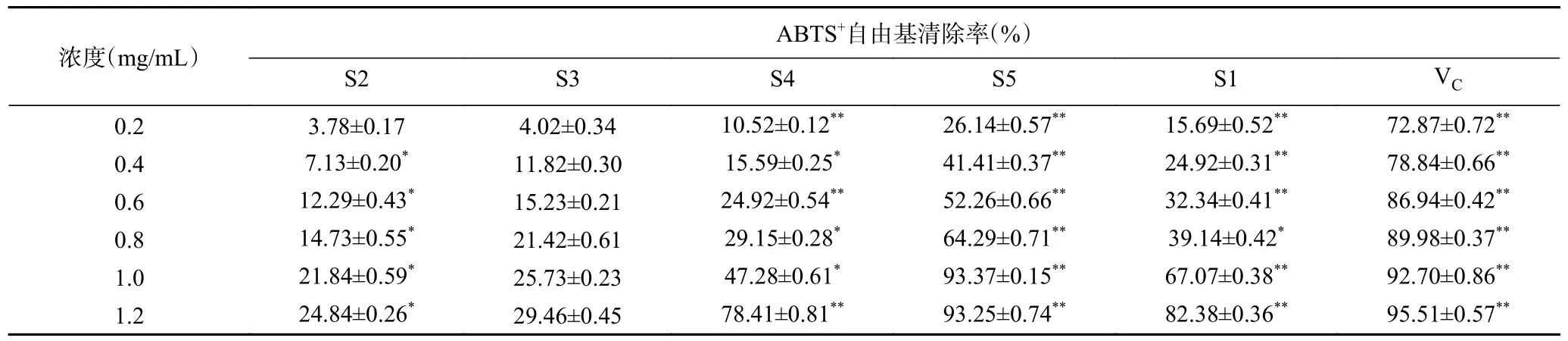
表3 酸棗仁不同極性部位對ABTS+自由基的清除能力Table 3 Ability of different polar parts of Semen Ziziphi Spinosae to remove ABTS+ free radicals
2.2.3 酸棗仁不同極性部位對超氧陰離子自由基的清除作用 由表4 可知,在0.2~1.2 mg/mL 范圍內,酸棗仁不同極性部位提取物對超氧陰離子自由基清除率與其濃度呈較好的正相關關系。其中,S5 萃取物清除能力最強,相同濃度下優于及其他萃取物,當濃度達到1.2 mg/mL 時具有最高清除活性,清除率為64.27%±0.31%;對超氧陰離子自由基清除能力較差的為S2 與S1,在濃度1.2 mg/mL 時清除率僅為36.43%±0.20%、55.33%±0.52%。該結果可能與正丁醇萃取物中的黃酮類成分具有活潑的酚羥基,在遇到活性氧自由基時,易失去酚羥基上的氫,具有直接清除或淬滅超氧陰離子、羥基自由基、H2O2等活性氧、自由基的作用有關[26]。
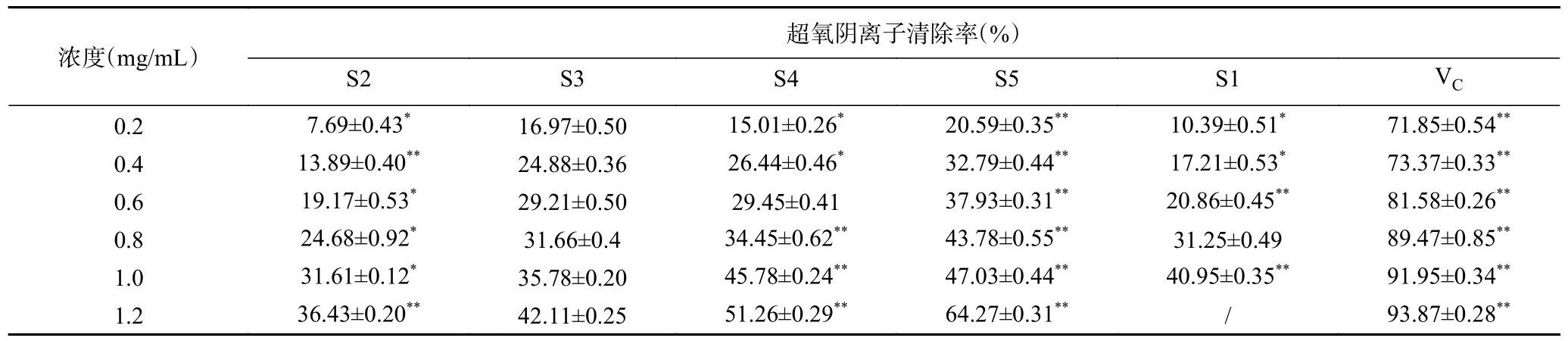
表4 酸棗仁不同極性部位對超氧陰離子自由基清除能力Table 4 Removal ability of superoxide anion free radicals in different polar parts of Semen Ziziphi Spinosae
2.2.4 酸棗仁不同極性部位羥基自由基分析結果由表5 可知,酸棗仁不同極性部位提取物對羥基自由基有良好清除能力,且在0.2~1.2 mg/mL 范圍內,隨著質量濃度的增加清除能力逐漸增強。在相同濃度下不同極性部位對羥基自由基清除能力大小順序為:VC>S5>S1>S4>S3>S2,其中,在1.2 mg/mL 時,S5 的清除能力最強,為78.86%±0.45%,接近于VC標準品。以上研究結果表明,酸棗仁不同極性部位均具有一定的羥基自由基清除能力,其中S5 萃取部位效果最好。
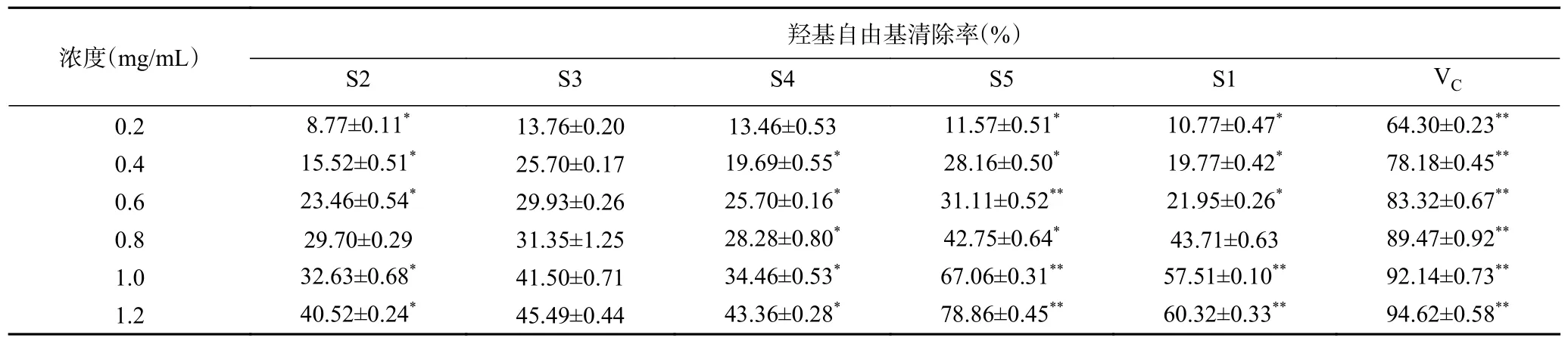
表5 酸棗仁不同極性部位的羥基自由基清除能力Table 5 Removal ability of hydroxyl radicals in different polar parts of Semen Ziziphi Spinosae
2.2.5 酸棗仁不同極性部位清除自由基IC50值分析結果 如表6 所示酸棗仁不同極性部位清除自由基的IC50值可知,S5(正丁醇部位)對DPPH 自由基、羥基自由基、ABTS+自由基和超氧陰離子自由基的清除率IC50值均低于其他部位的IC50值,該研究表明酸棗仁正丁醇部位具有更強的抗氧化活性。
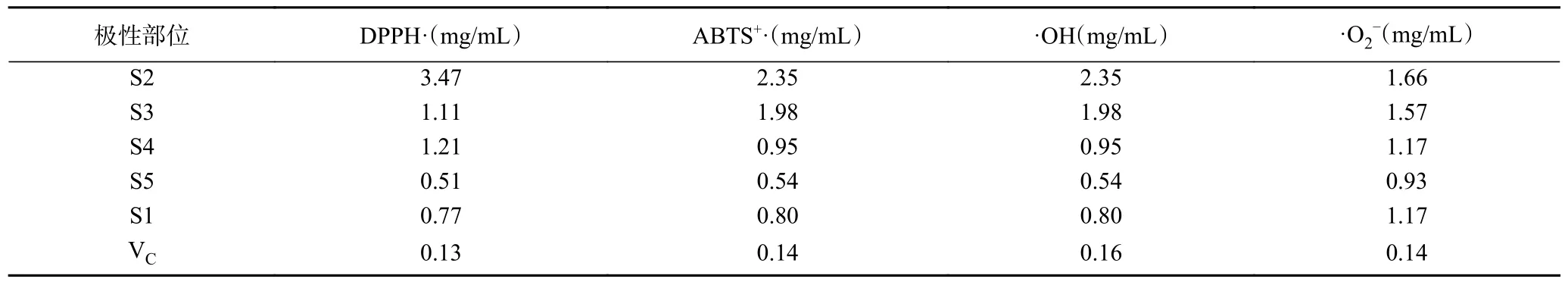
表6 酸棗仁不同極性部位抗氧化活性IC50 值Table 6 IC50 value of antioxidant activity of different polar parts of Semen Ziziphi Spinosae
2.2.6 酸棗仁不同極性部位細胞氧化損傷保護能力分析結果 除上述對酸棗仁不同極性部位抗氧化能力進行測定外,本研究通過測定不同給藥組的細胞相對活力,來比較酸棗仁不同極性部位對H2O2所致SH-SY5Y 細胞氧化損傷保護能力的大小,旨在選出酸棗仁對氧化損傷細胞保護的最佳活性部位。如圖3 所示,相比于模型組,SH-SY5Y 細胞在空白組正常貼壁狀態下呈上皮樣,有短觸角延伸,成簇生長。在應用H2O2誘導損傷后,細胞形態變大變圓,輪廓不清晰。給藥處理后,鏡下見細胞形態接近于正常狀態。如表7 所示,酸棗仁不同萃取部位對H2O2誘導的SH-SY5Y 細胞氧化損傷有保護能力。與模型組相比,各組樣品均提高了細胞存活率。表明,酸棗仁不同極性萃取部位可以改善H2O2誘導的細胞氧化損傷,其中S5 萃取部位對細胞氧化損傷保護能力相對最強,而S2 萃取部位最弱。
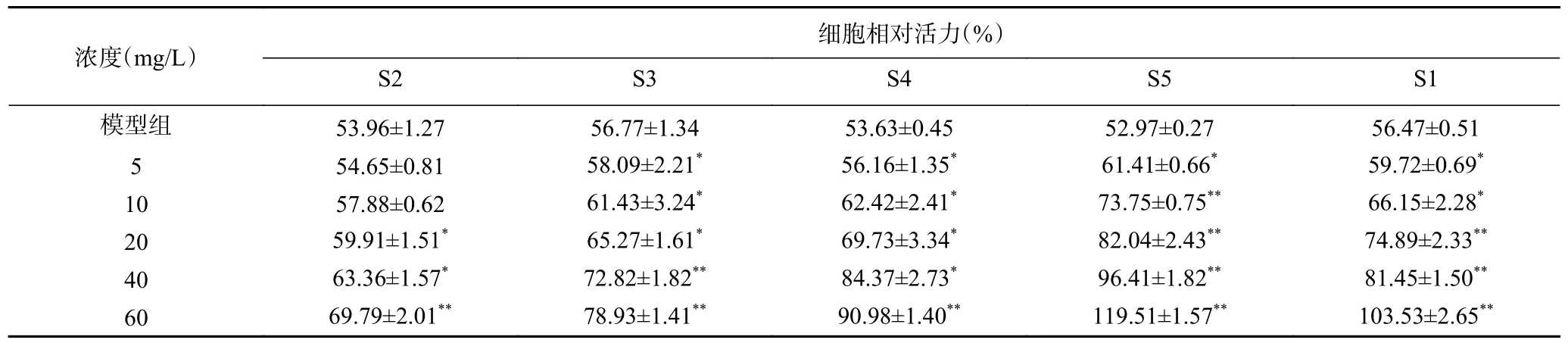
表7 酸棗仁不同極性部位的細胞相對活力Table 7 Relative cell viability of different polar parts of Semen Ziziphi Spinosae

圖3 酸棗仁不同極性部位對H2O2 所致SH-SY5Y 細胞氧化損傷保護能力對比圖Fig.3 Comparison of the protection ability of SH-SY5Y cells caused by H2O2 in different polar parts of Semen Ziziphi Spinosae
2.3 酸棗仁不同極性部位抗氧化活性及成分含量相關性分析結果
2.3.1 酸棗仁不同極性部位各項指標相關性分析結果 皮爾遜相關系數[27]是描述2 個定距變量間聯系緊密程度,衡量變量X 和Y 之間的線性相關關系的參數,其值介于-1 與1 之間,一般用r表示,該算法運算效率高且實用性強。由表8 可知,酸棗仁6 個化學組分含量和4 個抗氧化活性指標以及保護氧化損傷細胞能力之間存在良好的線性相關性,其中ABTS+自由基IC50值與總酚酸、總黃酮呈高度線性負相關且顯著(P<0.05),與斯皮諾素含量呈高度線性負相關且極顯著(P<0.01),相關系數分別為0.938、0.950、0.982;超氧陰離子自由基IC50值與總酚酸呈高度線性負相關且顯著(P<0.05),與總黃酮、斯皮諾素含量呈高度線性負相關且極顯著(P<0.01),相關系數分別為0.884、0.983、0.982;保護氧化損傷細胞能力與總黃酮、斯皮諾素含量呈高度線性正相關且極顯著(P<0.01),相關系數分別為0.995、0.961。上述研究結果表明,酸棗仁中6 個化學組分含量與4 個抗氧化指標均為線性相關關系,推測上述組分均具有良好的抗氧化活性,其中總黃酮、斯皮諾素與抗氧化活性指標和保護氧化損傷細胞能力之間線性關系顯著,這可能是因為酸棗仁中總黃酮、斯皮諾素為主要抗氧化活性部位。
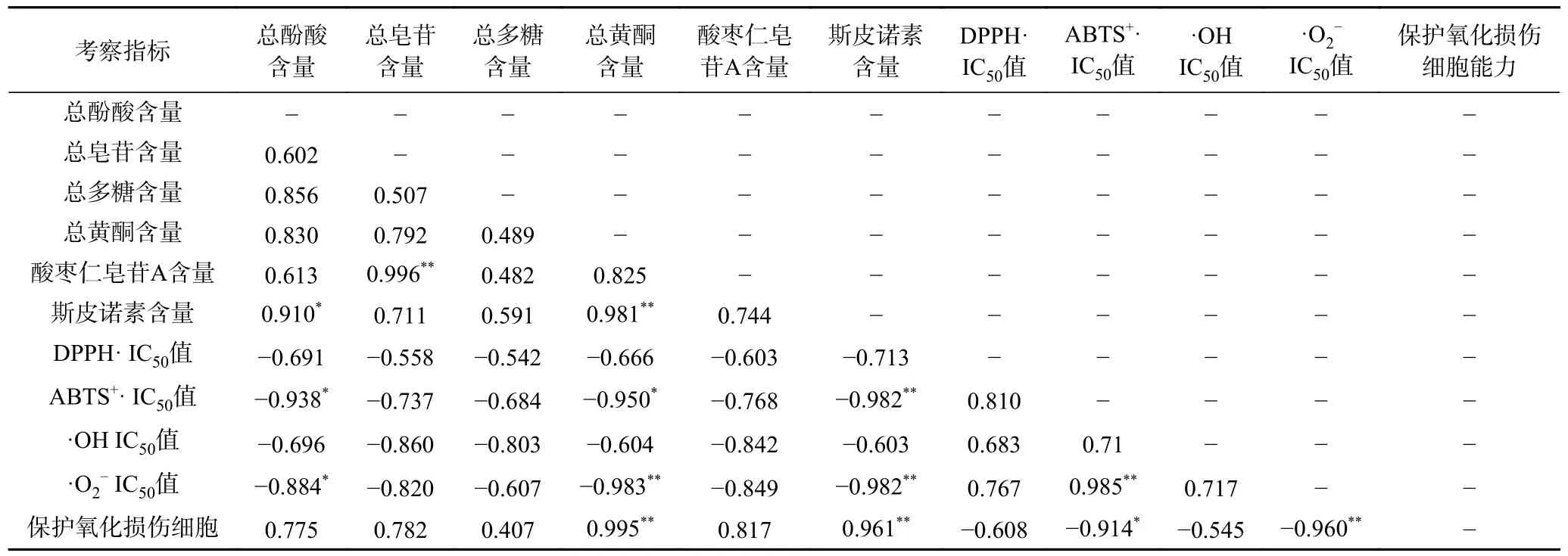
表8 酸棗仁不同極性部位各項指標的皮爾遜相關系數及其相關性檢驗結果Table 8 Pearson correlation coefficients and correlation test results of different polar parts of Semen Ziziphi Spinosae
2.3.2 酸棗仁不同極性部位抗氧化活性與功能成分偏最小二乘回歸分析結果 PLS 方法中,通常通過變量投影重要性指標(VIP)[28]來表征各成分含量對抗氧化活性指標的解釋能力大小,其值越大說明該自變量對因變量的解釋能力越強,基于VIP 對各成分含量進行篩選后再采用PLS 建模。由表9 可知總黃酮、總酚酸、斯皮諾素變量重要性值較大,在解釋變量Y 時具有顯著重要性;總皂苷、總多糖變量重要性值較小。
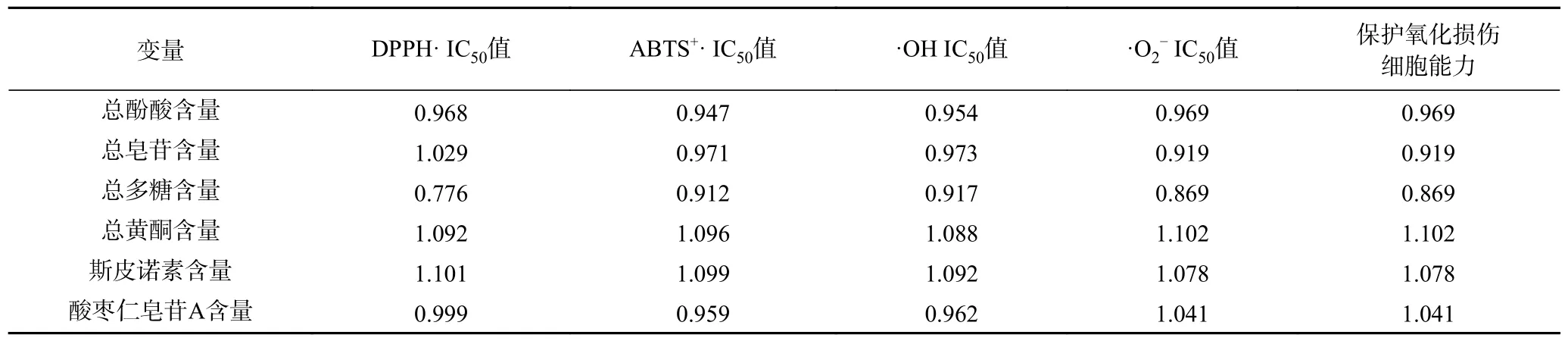
表9 自變量VIP(累積投影重要性)匯總Table 9 Summary of independent variable VIP (emportance of cumulative projection)
采用偏最小二乘回歸分析法,對酸棗仁不同極性部位抗氧化活性進行分析,選擇酸棗仁不同極性部位成分含量作為自變量X,其中X1為總酚酸含量、X2為總皂苷含量、X3為總多糖含量、X4為總黃酮含量、X5為斯皮諾素含量、X6為酸棗仁皂苷A,其抗氧化指標作為因變量,其中YⅠ為DPPH 自由基清除率、YⅡ為ABTS+自由基清除率、YⅢ為羥基自由基清除率、YⅣ為超氧陰離子清除率、YⅤ為保護氧化損傷細胞能力。得到回歸表10 所示方程,由表10可知,回歸系數的正、負代表各成分對抗氧化能力的正相關或負相關,回歸系數絕對值越大,表明該自變量對抗氧化能力影響越大。按照回歸系數絕對值大小排序,可知各成分含量對DPPH 自由基、ATBS+自由基、羥基自由基清除能力以及保護氧化損傷細胞能力的影響由大到小均為:X2>X3>X5>X4>X6>X1,該結果與表9 結果一致,因此推測出總酚酸、總黃酮、斯皮諾素含量對酸棗仁發揮抗氧化能力及氧化損傷細胞保護能力影響較大。

表10 酸棗仁不同極性部位抗氧化活性與成分含量最小二乘回歸分析結果Table 10 Results of the partial least squares regression analysis of antioxidant activity and ingredient content in different polar parts of Semen Ziziphi Spinosae
3 討論與結論
本文以體外抗氧化活性及對H2O2所致SHSY5Y 細胞損傷保護能力結合酸棗仁各部位成分含量變化來挖掘酸棗仁抗氧化能力與酸棗仁不同成分的關系,明確酸棗仁發揮抗氧化作用的物質基礎,結果表明酸棗仁不同極性部位均具有良好的抗氧化活性,但抗氧化能力強弱并不一致,其中S5 萃取部位抗氧化活性優于其他部位,因此推斷正丁醇萃取部位可能是酸棗仁抗氧化的主要活性部位。采用紫外分光光度法,HPLC 法測定了酸棗仁不同萃取部位成分含量,發現S5 部位總黃酮、總皂苷含量較高,說明黃酮類、皂苷類成分在正丁醇部位進行了富集。植物黃酮類成分由于其含多個酚羥基的結構特性,被稱為天然的抗氧化活性物質[29],酸棗仁皂苷因其具有多個氧化和還原官能團,且具有烯丙型穩定結構的多位點活性中心,具較強的抗氧化活性[30],因此,推斷酸棗仁提取物抗氧化活性跟黃酮類、皂苷類成分含量相關。其不同極性部位抗氧化活性的變化趨勢與其總黃酮、總皂苷含量具有一致性,因此推斷其黃酮類、皂苷成分可能為酸棗仁發揮抗氧化作用的潛在物質基礎。
采用PLS 相關分析探究各活性部位成分含量與抗氧化指標的對應關系,將各指標與各組分進行相關性分析,各活性部位成分含量對DPPH 自由基、ABTS+自由基、羥基自由基清除能力以及保護氧化損傷細胞能力的影響由大到小均為:X2>X3>X5>X4>X6>X1。由此可說明總皂苷、總黃酮、斯皮諾素含量對酸棗仁發揮抗氧化能力及氧化損傷細胞保護能力影響較大。相關性分析結果表明,不同成分含量之間存在著互相影響、互相牽制的關系,總皂苷、總黃酮等成分含量的變化可能會導致其他成分含量與抗氧化能力的改變;偏最小二乘回歸分析研究再次表明酸棗仁中總皂苷、總黃酮、斯皮諾素含量對其抗氧化能力影響最大。因此,本研究不僅測定了酸棗仁中主要成分的含量,而且明確了主要化學成分對抗氧化的影響,可為酸棗仁在保健食品等方面的開發利用提供參考。

