苗藥驗方“四大血”對類風濕性關節炎大鼠關節炎癥的作用及機制*
梁璽, 覃淇, 張藝馨, 袁嘯天, 吳寧, 吳遵秋*, 吳昌學
(1.貴州醫科大學 基礎醫學院 化學與生物化學實驗室, 貴州 貴陽 550025; 2.貴州醫科大學 醫學分子生物學重點實驗室, 貴州 貴陽 550004)
類風濕性關節炎(rheumatoid arthritis,RA),一種炎癥性、破壞性、慢性、可侵犯關節滑膜組織的疾病[1],主要特點為多關節滑膜炎性細胞浸潤、關節腔內血管翳生成、成纖維樣滑膜細胞增殖導致滑膜內襯層增生,最終引起骨組織破壞和軟骨退化;RA臨床表現為關節紅腫熱痛的炎癥反應、功能下降、畸形等[2],世界范圍內患病率0.4%~1.3%,患者2年致殘率50%,3年致殘率為70%,現已躍升為醫學界的難治疾病[3]。有研究表明,RA患者Nod樣受體蛋白3(nod-like receptor protein 3, NLRP3)炎癥體軸過度激活,將產生相關細胞因子引起一系列的炎性反應,加劇RA病情[4]。NLRP3炎性體(一種多蛋白復合體),由受體蛋白、含半胱氨酸的天冬氨酸蛋白水解酶-1前體(pro cysteinyl aspartate specific proteinase,pro-Caspase-1)、細胞凋亡相關斑點樣蛋白(apoptosis-associate speck-like protein, ASC)3部分組成,屬于炎性體軸的關鍵蛋白并參與人體固有免疫[5];當NLRP3炎性體激活,形成ASC斑點或焦亡小體,在自催化活化近距離誘導下,可致Caspase激活,從而促進白細胞介素1β(interleukin-1β,IL-1β),IL-18等致炎癥因子的成熟及分泌,最終導致周圍組織炎癥反應加重[6]。在RA的藥物治療方面,新的生物制劑如托珠單抗、IL-1拮抗劑、腫瘤壞死因子-α(tumor necrosis factor-alpha,TNF-α)拮抗劑等,不僅價格高昂,還易發生感染等不良反應;非甾體抗炎藥(non-steroidal anti-inflammatory drugs,NSAIDs)、改善風濕病情藥物(disease modifying antirheumatic drugs,DMARDs)及糖皮質激素(glucocorticoids,GCs)等常用臨床治療藥物,則因療效不佳、不良反應較明顯等問題難以達到患者的期望[7]。當前,從中醫藥出發,研究療效更顯著、毒副作用更小的新藥日漸成為研究熱點。苗藥驗方“四大血”(sidaxue,SX)組成為4味藤本藥材雞血藤(仰嗟嘎,nangx dlob ghat)、黑骨藤(萵蒙棱,vob mongb dlenb)、見血飛(嘎龔布梭學,ghab jongx bel sob xok)及五花血藤(梭向,hsob hx-angt),有通氣散血、行瘀止痛之功[8]。本課題組前期結果表明,SX給藥后的膠原誘導性關節炎模型大鼠(collagen induced arthritis in rats, CIA)表現出良好的治療療效、關節滑膜的炎性細胞浸潤可被明顯抑制、關節腫脹得到緩解、IL-1β表達下調[9]。本研究以NLRP3炎癥體軸為切入點,通過復刻CIA模型大鼠,對比不同劑量SX治療前后大鼠關節腫脹度及病理變化,并分析大鼠滑膜組織的NLRP3及Caspase-1的蛋白及mRNA水平和血清IL-18含量的變化,評估SX的抗炎效果。
1 材料與方法
1.1 實驗材料
1.1.1藥材來源 SX組成藥材雞血藤、黑骨藤、五花血藤及見血飛由貴州中醫藥大學苗醫藥教研室提供,經貴州中醫藥大學田振華副教授鑒定為正品。
1.1.2實驗動物 42只8~9 周齡、體質量(200±20)g的健康Sprague Dawley(SD)大鼠,雌雄各半,由學校實驗動物中心提供[SYXF(黔)2018-0001]。本研究已獲得學校實驗動物倫理委員會審查批準(2200095),且嚴格遵守倫理委員會規定。
1.1.3主要藥物與試劑 雷公藤多苷片(tripterygium glycosides,GTW;黃石飛云制藥公司),弗式不完全佐劑(美國Sigma公司),牛Ⅱ型膠原(美國Chondrex公司),二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量試劑盒、RIPA(radio immunoprecipitation assay,RIPA)裂解液、蘇木素、TRIzol及伊紅由上海碧云天生物技術有限公司提供,大鼠IL-18 酶聯免疫吸附實驗(enzyme-linked immunosorbent assay,ELISA)試劑盒(上海泛柯實業有限公司),大鼠NLRP3抗體(美國abcam公司),Caspase-1抗體(華安生物技術有限公司),辣根過氧化物酶(horse radish peroxidase,HRP)-羊抗兔免疫球蛋白G(immune globulin G,IgG;美國ABclonal公司),高靈敏性染料法定量聚合酶鏈式反應(polymerase chain reaction,PCR)檢測試劑盒和逆轉錄試劑盒由南京諾唯贊生物科技有限公司提供,其余試劑均為進口或國產分析純產品。
1.2 研究方法
1.2.1藥物的制備 取2 000 g苗藥五花血藤、雞血藤、見血飛及黑骨藤組成SX,按15∶22∶15∶8的比例取藥材600 g,加適量水用大火、中火及小火分別煮1 h、30 min及30 min,合并濃縮液500 mL作為受試藥,濃度為4 kg/L(按生藥量計),質量控制標準為每制150 mL;SX水煮液原藥材五花血藤不低于150 g、雞血藤不低于220 g,見血飛不低于150 g及黑骨藤不低于80 g;制備完成的中藥水煎液密封避光,4 ℃冰箱備用(保存1周)。
1.2.2造模及分組 42只SD大鼠于無特定病原體(specific pathogen free,SPF)級實驗室適應性喂養7 d,按體質量隨機均分為空白組、陽性對照組、模型組及10 g/kg(低劑量)SX組、20 g/kg(中劑量)SX組、40 g/kg(高劑量)SX組。取適量2 g/L牛Ⅱ型膠原與等量不完全弗氏佐劑于冰上混合,并完全乳化至其滴于水中不擴散;將模型組、陽性對照組及高、中、低劑量SX組大鼠于尾根部皮下注射乳化劑200 μL誘導免疫反應,1周后再次注射乳化劑100 μL加強免疫;空白組大鼠于尾根部皮下注射同量生理鹽水。造模期間每日觀察并拍照記錄大鼠關節紅腫及畸形等情況,每隔7 d觀察并進行關節炎指數評分(arthritis index score,AI),AI評分>2分即可視為造模成功[10]。
1.2.3給藥方案 造模成功2 d后,高、中、低劑量SX組分別按照體質量40 g/kg、20 g/kg、10 g/kg給予SX濃縮液4 000 g/L、2 000 g/L、1 000 g/L(按生藥量計),陽性對照組按體質量 40 g/kg給予GTW4 000 g/L,空白組及模型組給予等量生理鹽水(normal saline,NS),1次/d,持續給藥21 d。
1.2.4一般情況的觀察和AI評分 給藥期間觀察各組大鼠的飲食量、精神狀態、踝關節形態、被毛情況及活動情況等。分別于造模前1天、灌胃給藥前1天及灌胃給藥1周、2周、3周時,采用足趾容積測量儀測各組大鼠足趾大小,記錄AI評分;足趾腫脹指標判斷以大鼠造模前后的足趾容積變化為準,雙后足累積得分作為總分。
1.2.5標本采集 末次給藥次日,各組大鼠經100 g/L水合氯醛麻醉,麻醉處死大鼠,取仰位固定,沿膝關節正中將皮膚縱行切開、暴露3 cm×3 cm以膝關節為中心的區域,齒鑷提起髕骨,從上緣0.5 cm處沿兩側向下分離,膝關節腔內可見附著的薄層滑膜組織,呈淡黃色、平滑、光亮,小心剝離后用磷酸鹽緩沖液(phosphate buffer saline,PBS)清洗,液氮速凍,-80 ℃保存,并提取滑膜組織的總RNA及蛋白供后續研究。
1.2.6病理組織切片制備 取各組大鼠踝關節組織,中性甲醛固定24 h,常規梯度脫水后依次進行浸蠟、包埋、切片與貼片、脫蠟水化、蘇木精-伊紅(hematoxylin-eosin,HE)染色,脫蠟水化、脫苯、復水、常規梯度染色、梯度脫水、二甲苯透明、中性樹膠封片,在顯微鏡下觀察滑膜組織形態學變化。
1.2.7酶聯免疫吸附試驗(enzyme-linked immunosorbnent assay,ELISA)法檢測血清IL-18的表達 各組大鼠心臟取血后離心并取上層血清,采用ELISA法檢測大鼠血清 IL-18含量,按照試劑盒說明書進行操作,配置標準品液,每孔分別加標準品和待測樣品100 μL,洗板后加一抗于37 ℃放置20 min,再次洗板并加酶標抗體于37 ℃放置10 min),洗板并加底物工作液于7 ℃放置15 min,最后加終止液并混勻,測量酶標儀450 nm處吸光值。
1.2.8即時聚合酶鏈式反應(real-time polymerase chain reaction,Real-time PCR)法檢測滑膜組織NLRP3及Caspase-1 mRNA的含量 取大鼠關節滑膜組織勻漿,利用Trizol法提取總RNA并吸取澄清的trizol至新的微型離心管(eppendorf,EP)內,依次測定 RNA 樣品濃度、純度,逆轉錄合成互補脫氧核糖核酸(complementary deoxyribonucleic acid,cDNA)并進行 Real-time PCR 擴增(反應條件:預變性95 ℃ 30 s,變性95 ℃ 10 s、退火60 ℃ 30 s、循環 40 次)。用 2-ΔΔCt法計算 mRNA 的相對表達量,3次平行實驗后,對目的基因擴增產物與甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)光密度值進行統計學分析。通過NCBI Primer-blast 網站設計引物,由武漢天一輝遠生物科技有限公司合成引物,GAPDH為內參基因,引物序列見表 1。

表1 各基因的引物序列
1.2.9Western bolt檢測滑膜組織NLRP3、Caspase-1蛋白表達 取各組大鼠關節滑膜組織,置于已加放射免疫沉淀法(radio-immunoprecipitation assay,RIPA)裂解液2 mL的研磨管,充分研磨,4 ℃靜置裂解30 min,4 ℃下12 000 r/min 離心15 min取上清液,BCA法測定蛋白濃度;依次制備10%聚丙烯酰胺凝膠,上樣20 μg,80~120 V電泳2 h,300 mA恒流轉膜1 h,5%脫脂奶粉封閉2 h,一抗(1∶1 000)于4 ℃孵育過夜,HRP 辣根過氧化物酶偶聯二抗(1∶5 000)室溫孵育2 h,經增強型化學發光試劑(enhanced chemiluminescence,ECL)工作液顯色及曝光成像。采用條帶分析軟件處理條帶,并計算灰度值,蛋白的表達量為條帶與各組內參β-actin灰度值的比值。
1.3 統計學分析

2 結果
2.1 足趾外觀及雙后肢足腫脹度的AI評分
CIA大鼠足趾外觀結果顯示,給藥21 d后,各給藥組較模型組大鼠雙后肢紅腫情況存在不同程度的降低,其雙后肢膝關節、踝關節和趾間關節紅腫均有不同程度的減輕。給藥前,空白組的AI評分為0分,其余各組AI評分均為4分;根據評分標準(達2分及以上即可判斷造模成功)可判斷本次造模情況達標。連續灌胃給藥1周后,高、中劑量SX組大鼠雙后肢足腫脹度較模型組下降(P<0.05);灌胃給藥2周后,各劑量SX和陽性對照組大鼠后肢腫脹程度較模型組均有較多降低(P<0.05);到給藥3周時,各劑量SX和陽性對照組大鼠雙后肢足腫脹度和足趾外觀表現較模型組均有明顯減小(P<0.05)。且除模型組AI評分為3分,其余各組均為0分(P<0.05)。見圖1和表2。

空白組 陽性對照組 模型組 低劑量SX組 中劑量SX組 高劑量SX組
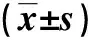
表2 各時間點各組大鼠雙后肢足腫脹度的AI評分
2.2 組織學特征
光鏡下觀察時可見,空白組大鼠未見明顯滑膜增生及炎癥細胞浸潤;相比空白組,模型組大鼠踝關節組織可見踝關節組織軟骨表面粗糙不平、破骨細胞增多,軟骨細胞壞死,襯里下層細胞壞死,襯里層的滑膜細胞存在壞死或增生,且存在浸潤性炎性細胞、增生性纖維組織、形成新生毛細血管等病理改變;與模型組相比,各給藥組大鼠踝關節組織病理改變均有所減輕,其中低劑量SX組、中劑量SX組仍可見較多浸潤性炎性細胞、組織水腫;陽性對照組大鼠浸潤性炎性細胞明顯減少,表示踝關節組織炎癥有一定程度減輕;高劑量SX組大鼠明顯緩解,偶見極少量散在分布的炎性細胞。見圖2。

注:綠色、藍色黃色及橙色箭頭分別表示淋巴細胞、中性粒細胞、漿細胞及纖維細胞。
2.3 血清IL-18水平
ELISA檢測結果表明(表3),與空白組比較,模型組大鼠血清IL-18水平升高(P<0.05);與模型組比較,陽性對照組和SX高劑量組大鼠的血清IL-18水平下降(P<0.01),SX中、低劑量組大鼠血清IL-18水平下降、但無統計學意義(P>0.05);與陽性對照組比較,SX高劑量組大鼠的血清IL-18水平比較、差異無統計學意義(P>0.05)。

表3 各組大鼠的血清IL-18 水平
2.4 NLRP3和Caspase-1 mRNA的表達
qRT-PCR檢測結果表明(圖3),給藥21 d后,與空白組比較,模型組大鼠膝關節滑膜組織中NLRP3、Caspase-1 mRNA明顯上調(P<0.01);與模型組比較,高劑量SX組大鼠膝關節滑膜組織中NLRP3、Caspase-1 mRNA下調,但差異無統計學意義(P>0.05),中劑量SX組大鼠膝關節滑膜組織中NLRP3、Caspase-1 mRNA明顯下調(P<0.01),SX低劑量組NLRP3 mRNA下調(P<0.05),提示中、低劑量SX組對CIA大鼠的NLRP3和Caspase-1 mRNA下調效果良好。

注:A、B分別為NLRP3和Caspase-1 mRNA的定量表達; (1)與空白組比較,P<0.05;(2)與模型組比較,P<0.05;(3)與陽性對照組比較,P<0.05。
2.5 NLRP3和Caspase-1蛋白的表達
Western blot結果顯示(圖4),與模型組比較,空白組大鼠膝關節滑膜組織中NLRP3、Caspase-1蛋白表達上調(P<0.05),中、低劑量SX組大鼠膝關節滑膜組織中NLRP3、Caspase-1蛋白表達下調(P<0.05),中劑量SX組大鼠膝關節滑膜組織中NLRP3、Caspase-1蛋白表達下調與陽性對照組作用相當(P>0.05),提示中劑量SX組對CIA大鼠膝關節滑膜組織中NLRP3和Caspase-1蛋白下調效果良好。

注:A為Caspase-1、NLRP3蛋白的Western blot檢測結果,B、C分別為Caspase-1、NLRP3蛋白的定量結果;(1)與空白組比較,P<0.05;(2)與模型組比較,P<0.05;(3)與陽性對照組比較,P<0.05。
3 討論
RA屬一種自身免疫性疾病,主要病變特征為侵蝕性關節炎,最終可導致肢體殘疾,影響生活質量[11]。我國RA患病率約為0.42%[12]。RA基本病理變化為關節滑膜炎形成、腔內具有浸潤性炎性細胞、骨侵蝕及軟骨破壞,其中炎癥反應是RA主要的發病機制之一,多種炎癥因子與之密切相關,促炎細胞因子(IL-1β、IL-18及TNF-α等)介導的炎癥反應是RA滑膜病變發生發展的重要原因[13]。核因子κB(nuclear factor kappa-B,NF-κB)信號通路調控NLRP3炎癥體軸的激活[14]。有研究表明,RA患者外周血細胞中NLRP3炎癥小體的增加表達[15];小鼠 Caspase-1下游因子焦孔素家族蛋白D(gasdermin-D,GSDMD)的缺失可以明顯緩解CIA小鼠的滑膜炎和臨床表現[16]。綜合以上表明,RA中存在NLRP3炎癥體軸的過度激活,但NLRP3炎癥體軸對RA炎癥反應影響的具體機制仍有待證實。參與細胞死亡及炎癥反應是Caspase家族主要作用,且炎癥小體在Caspase-1的活化過程中具有關鍵作用[17]。炎癥小體是由pro-Caspase-1蛋白、細胞凋亡相關斑點樣蛋白(apoptosis-associate speck-like protein, ASC)、受體蛋白3部分組裝而成的多蛋白復合體[18];其最具特征的亞型之一是由NLRP3作為受體蛋白的NLRP3炎癥小體,主要依靠結構域之間的結合激活Caspase-1[19];GSDMD作為Caspase-1下游的關鍵因子,可直接實施損傷細胞,其活性的N端結構可破壞細胞膜的完整性并形成孔道,最終導致細胞死亡[20];pro-IL-18、pro-IL-1β的成熟與活化依賴于Caspase-1的活化,待其分泌至細胞外,將進一步誘導其他炎癥細胞因子、粘附分子及趨化因子等的合成,從而擴大炎癥反應[21]。基于NLRP3炎癥體軸使用SX治療RA的研究,尚且未見相關報道,因此,本研究旨在探究苗醫驗方SX是否能通過干預NLRP3炎癥體軸發揮抗炎作用。苗藥驗方SX有4味藤本藥材:見血飛、雞血藤、黑骨藤及五花血藤,具通氣散血、行瘀止痛的功效,是RA治療的貴州苗族地區特色藥方[18]。從本研究結果來看,與空白組相比,模型組大鼠足趾腫脹明顯,組織切片提示滑膜細胞明顯增生、炎癥細胞浸潤明顯,血清IL-18水平存在明顯上調,滑膜組織中NLRP3、Caspase-1 mRNA水平和蛋白表達升高,提示模型制備成功;NLRP3過度表達可引起過度激活NLRP3炎癥體軸的表現。NLRP3炎癥體軸的正常激活可以保護正常組織器官避免內源性損害及感染,過度激活則可能引發病理性炎癥[22]。過度表達的NLRP3炎癥小體,可激活Caspase-1,促進IL-1β、IL-18的成熟與分泌,引起細胞內容物、炎癥因子IL-1β及IL-18的大量釋放,加重周圍組織炎癥反應;IL-1β的刺激,又可促進滑膜細胞的過度增殖、血管翳的形成[23]。經過SX或GTW治療后,大鼠足趾腫脹度相對改善,關節滑膜組織中的細胞增生程度較輕,炎癥細胞浸潤明顯減少,提示SX可抑制RA中的炎癥反應,其中四大血高劑量組較低、中劑量組炎癥反應緩解更加明顯;與模型組相比,四大血中劑量組大鼠滑膜組織的NLRP3、Caspase-1蛋白和mRNA表達明顯下調,其余治療組表達輕度下調;四大血陽性對照組及高劑量組血清中IL-18水平降低;可見SX具有抑制NLRP3炎癥小體的可能,從而抑制NLRP3炎癥體軸的激活[24]。
綜上所述,CIA大鼠滑膜組織的炎性增生可能與過度激活的NLRP3炎癥體軸有關;SX可下調NLRP3表達,減弱了NLRP3炎癥信號通路的活化,下游Caspase-1的表達則被抑制,從而緩解RA大鼠滑膜組織中被過度激活的NLRP3炎癥體軸、抑制滑膜炎癥,起到治療RA的作用。因此,本研究提示SX減輕炎性癥狀的作用與NLRP3炎癥體軸密切相關,具有重要的藥用價值。同時,為SX治療RA的作用靶點的研究搭建了一定的實驗基礎,但仍需進一步深入研究具體機制。

