sPDPN在老年膿毒癥性肺損傷病人早期診斷、病情及預后評估中的價值研究
衡軍鋒 鄭開明 吳丁燁
目前膿毒癥病人數量依然龐大,在我國死亡率接近50%[1]。膿毒癥極易導致肺損傷,炎癥因子釋放導致肺上皮細胞和血管內皮細胞損傷,血管通透性破壞,肺水腫產生,形成急性呼吸窘迫綜合征(ARDS)的典型病理生理改變[2]。這些在老年病人中尤為突出[3]。平足蛋白(podoplanin, PDPN)是一種Ⅰ型唾液黏蛋白樣的跨膜糖蛋白,其與C型凝集素樣受體2(CLEC-2)結合后,可以誘導血小板的聚集和活化[4],促進白細胞的聚集,加速炎癥反應。表達PDPN的細胞也可將其以可溶性的形式(sPDPN)釋放到病人血漿中。本文旨在探討sPDPN在膿毒癥性肺損傷病人中的臨床應用價值。
1 材料與方法
1.1 研究對象 選取2018年1月至2020年12月收住無錫市人民醫院ICU的老年膿毒癥病人共95例,其中男58例,女37例,年齡60~75歲,平均(65.37±4.78)歲。按照《2016年膿毒癥的最新定義與相關診斷標準》[5]中Sepsis 3.0的診斷標準及ARDS的柏林標準分組[6],若病人為膿毒癥或膿毒性休克但不伴有ARDS,則歸入膿毒癥組(40例),若伴有ARDS,則歸入膿毒癥肺損傷組(55例);又將膿毒癥肺損傷組細分為膿毒癥ARDS亞組(膿毒癥伴有ARDS)(29例)和膿毒性休克ARDS亞組(膿毒性休克并伴有ARDS)(26例);根據病人死亡情況將膿毒癥肺損傷組分為存活亞組(40例)和死亡亞組(15例);另設同期本院健康體檢老年人30例為對照組,其中男19例,女11例,年齡(63.65±4.93)歲。所有病人膿毒癥確診后均予以抗感染、液體復蘇、呼吸支持、營養支持、血糖控制等標準治療措施。本研究已獲得我院醫院倫理委員會的批準(批號:IAcuc-20201225-01)。
1.2 研究方法 采用ELISA法檢測血漿中CRP、PCT、IL-6、TNF-α和sPDPN等的濃度。采用蛋白質印跡法(Western-blot)檢測血漿中sPDPN的濃度。采用PICCO檢測血管外肺水(EVLW)。對病人進行APACHE Ⅱ評分、序貫性器官功能衰竭(SOFA)評分。比較各組間炎癥因子、量表評分及sPDPN的差異,分析sPDPN與炎癥因子、量表評分、EVLW的相關性。繪制ROC曲線,評估sPDPN對膿毒癥肺損傷的預后評估效能。
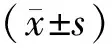
2 結果
2.1 一般資料分析 膿毒癥與膿毒癥肺損傷組、膿毒癥ARDS亞組與膿毒性休克ARDS亞組、存活亞組與死亡亞組間,病人的性別、年齡、體溫、心率、肌酐、尿素氮、總膽紅素以及白蛋白水平差異均無統計學意義(P>0.05);各組間乳酸水平比較,膿毒癥組低于肺損傷組,膿毒癥ARDS亞組低于膿毒性休克ARDS亞組,存活亞組低于死亡亞組,平均動脈壓在各組間比較,差異也均有統計學意義(P<0.05)。見表1。
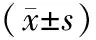
表1 各組間一般資料比較
2.2 各組間sPDPN、炎癥因子和量表評分比較 血漿內sPDPN濃度,炎癥因子CRP、PCT、IL-6、TNF-α濃度,SOFA評分,APACHE Ⅱ評分均為對照組最低,膿毒癥組明顯增加,膿毒癥肺損傷組升高更顯著(均P<0.05)。在膿毒癥肺損傷病人中,各亞組血漿sPDPN、CRP、PCT、IL-6、TNF-α濃度,SOFA評分,APACHE Ⅱ評分比較,膿毒性休克ARDS亞組高于膿毒癥ARDS亞組,死亡亞組高于存活亞組(均P<0.05)。見表2。
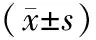
表2 各組病人sPDPN及相關炎癥因子及量表評分比較
2.3 各組sPDPN濃度與血清炎癥因子、量表評分的相關性分析 在各組別中,sPDPN濃度與炎癥因子CRP、PCT、IL-6、TNF-α及EVLW、SOFA評分、APACHE Ⅱ評分均呈正相關(均P<0.05)。見表3。
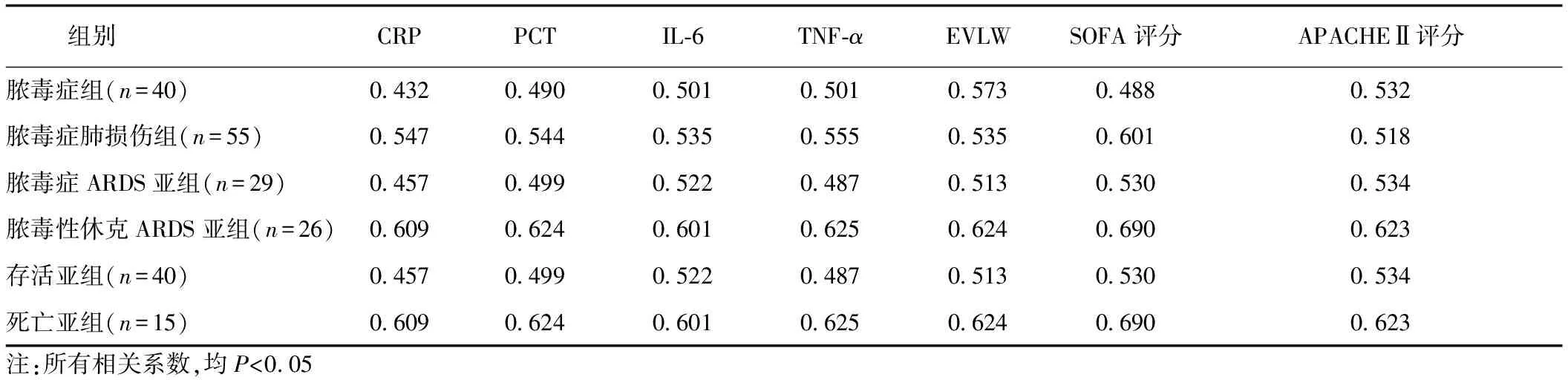
表3 各組sPDPN濃度與血清炎癥因子、量表評分的相關性分析(r)
2.4 sPDPN預測膿毒癥肺損傷病人28 d死亡率的價值 繪制sPDPN、PCT、CRP預測膿毒癥肺損傷病人預后的ROC曲線,其AUC分別為0.867、0.609、0.604(均P<0.05);sPDPN較PCT及CRP對膿毒癥肺損傷病人28 d死亡體現出更高的預測效能(P<0.05)。見表4。
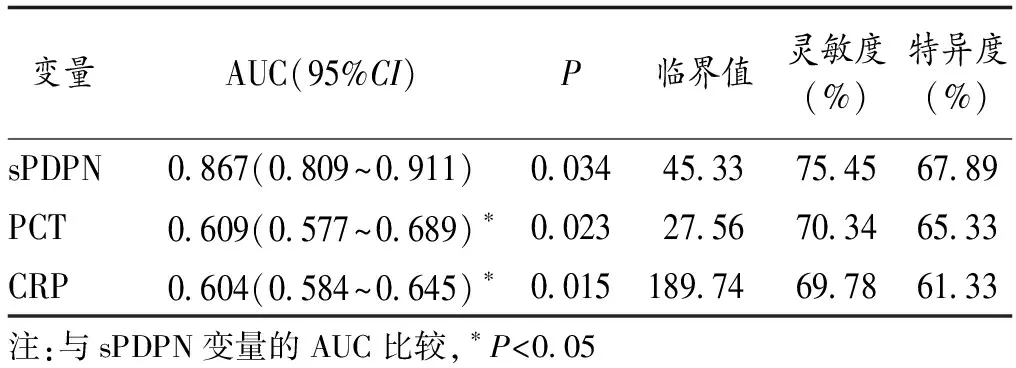
表4 ROC曲線分析sPDPN、PCT、CRP預測膿毒癥肺損傷病人預后的價值
3 討論
膿毒癥泛指機體遭受感染后出現的一系列嚴重的病理生理表現,可以累及多個器官組織,甚至可出現多器官功能障礙綜合征(MODS)[7]。年齡是膿毒癥不良預后的獨立危險因素。老年病人合并各種慢性疾病多,免疫功能低下,對各種病原菌較易感,因此,老年病人膿毒癥死亡率較高[8]。隨著各種有效的集束化治療策略得到推廣,我們已有可能來避免眾多的病人發展至器官功能障礙階段。
用于膿毒癥診斷的生物學指標非常多,如PCT、CRP、白細胞介素及TNF-α等,這些指標在諸多炎性疾病中具有較強的診斷和預后價值[9]。EVLW是目前唯一可以在床旁定量檢測肺部狀態和血管通透性的臨床參數,其對膿毒癥病人肺部功能的檢測具有現實的可行性意義[10]。ICU也常用APACHE Ⅱ評分以及SOFA評分來評估病情[11]。本研究中,各組血漿內炎癥因子CRP、PCT、IL-6及TNF-α的表達濃度,EVLW值及SOFA評分、APACHE Ⅱ評分均有顯著差異,對照組最低,膿毒癥病人顯著升高,膿毒癥肺損傷病人最高。而對于不同嚴重程度膿毒癥肺損傷病人,膿毒性休克病人及死亡病人上述指標水平更高。這些結果體現出CRP、PCT、IL-6及TNF-α等炎癥因子及EVLW值、SOFA評分、APACHE Ⅱ評分均與膿毒癥是否發生肺損傷、危重程度以及最終的預后有一定的相關性。
目前,PDPN相關的研究主要涉及腫瘤方面[12],其也在肺泡成熟的過程中發揮作用[13]。血小板表面的CLEC-2與PDPN結合后除導致血小板的聚集和活化[14],促進中性粒細胞的聚集以及活化,加速炎癥反應的進展外,也可直接影響免疫或炎癥細胞,導致促炎因子的產生。
在膿毒癥性肺損傷時,肺部血流動力學發生改變、局部微血栓形成、大量炎癥因子釋放、肺部上皮細胞及血管內皮細胞破壞,凝血、抗凝功能與炎癥反應相互影響,形成了惡性循環[15]。其中PDPN因其在血小板活化和炎癥反應中的作用以及親肺性被研究者所關注。
本研究采用ELISA法及Western-blot蛋白免疫印跡檢測了各組病人血漿內sPDPN的濃度,研究結果表明,sPDPN在膿毒癥肺損傷的狀態下呈現高表達水平,且與膿毒癥肺損傷的病情嚴重度呈正相關。
各組病人的血漿sPDPN濃度與炎癥因子、EVLW及評分之間的相關分析結果顯示,不同嚴重程度膿毒癥病人血漿內的sPDPN濃度與炎癥因子、EVLW及評分之間均呈正相關,從r值來看,這種相關性在死亡亞組表現最為明顯,充分表明了sPDPN濃度在膿毒癥肺損傷的診斷、病情嚴重度評估上的重要價值。進一步繪制了sPDPN、CRP及PCT對膿毒癥肺損傷病人預后評估的ROC曲線,sPDPN的AUC明顯高于CRP及PCT,提示在預后評估上,sPDPN似乎更有價值。
綜上所述,sPDPN在膿毒癥肺損傷的早期診斷、病情和預后評估上均存在顯著價值,而PDPN單抗的成功研制,又使得sPDPN在成為治療靶點上存在巨大潛力。

