裸體異鰾鰍鮀人工繁殖與胚胎發育研究
薛敬陽 王小明 張運海 張歡 關景春 王蕭 楊君程 吳杭翰 羅禮強

摘?要:為了解裸體異鰾鰍鮀(Xenophysogobio nudicorpa)人工繁殖和胚胎發育規律,以從金沙江采集到的10尾雌魚(平均體長17.5 cm,體質量22.3 g)、8尾雄魚(平均體長15.6 cm,體質量17.5 g)作為親本,分3批次開展了人工繁殖試驗,并觀察在水溫(20.0±0.5)℃下該魚的胚胎發育情況。試驗結果顯示:在水溫(15.0±0.5)、(18.0±0.5)、(20.0±0.5)℃的條件下催產,催產劑(雌魚第1針注射LHRH-A3 2 μg/kg,第2針注射LHRH-A3 10 μg/kg+HCG 1 200 IU/kg+PG 8 mg/kg,間距12 h;雄魚不注射)的效應時間分別為21、15、14 h,受精率分別為8.5%、76.8%、74.5%。將受精卵在水溫(15.0±0.5)℃條件下孵化288 h,大部分仔魚未能正常出膜;當水溫升至(18.0±0.5)℃,大部分仔魚在孵化168 h后破膜而出,但仍有小部分無法正常出膜;當水溫升至(20.0±0.5)℃時,仔魚正常出膜,且出膜時間縮短至120 h。裸體異鰾鰍鮀的胚胎發育過程可分為受精卵、胚盤隆起期、卵裂期、囊胚期、原腸胚期、神經胚期、器官發生期和出膜期等8個連續的階段,共22個時期。
關鍵詞:裸體異鰾鰍鮀;人工繁殖;胚胎發育;水溫
裸體異鰾鰍鮠它(Xenophysogobio nudicorpa)隸屬于鯉形目(Cypriniformes)、鯉科(Cyprinidae)、鰍鮠它亞科(Gobiobotinae)、異鰾鰍鮠它屬(Xenophysogobio),主要分布于岷江中游、雅礱江下游、長江干流以及金沙江下段,是長江上游特有魚類[1]。隨著金沙江下游水電梯級開發工程的逐步實施,一些魚類的棲息環境被破壞,其產卵條件也發生了劇烈變化,適宜的產卵場所驟減[2-4]。此外,由于過度捕撈和江河環境污染的日益加劇[5-6],包括裸體異鰾鰍鮠它在內的多種魚類的自然種群資源持續衰退。目前,有關裸體異鰾鰍鮠它的研究主要集中于生物學分類[7]、基因測序[8]、形態特征[9]等方面,而針對其繁殖生物學的研究尚未見報道。本試驗對裸體異鰾鰍鮠它的人工繁殖和胚胎發育進行研究,旨在了解該魚的胚胎發育規律,為其增殖保護和規模化人工繁育提供參考依據。
1?材料和方法
1.1?親魚來源
試驗所用裸體異鰾鰍鮠它親魚采集于金沙江攀枝花銀江鎮江段,共18尾,其中雌魚10尾,平均體長17.5 cm,平均體質量22.3 g;雄魚8尾,平均體長15.6 cm,平均體質量17.5 g。采集到的親魚用氧氣袋注入一定量的水并充氧后置于泡沫箱中進行長途運輸。
1.2?親魚的培育與選擇
運抵養殖基地的親魚用20 mg/L高錳酸鉀浸浴10~15 min,之后用維生素C還原解毒。將處理后的親魚放入直徑1 m、高60 cm的玻璃鋼材質的圓形養殖缸,進行微流水馴養。馴養水源為金沙江江水,經高位水池進入車間,通過冷熱機組調控水溫后注入養殖缸。
催產前親魚的培育:在催產前15~20 d,增大流水刺激,并將投餌量(紅蟲)增加到魚體質量的5%~10%。
挑選親本要求雌魚體質量在18 g以上,雄魚在10 g以上。根據方圓等[10]的方法,選擇腹部明顯膨大、卵巢輪廓明顯、生殖孔紅腫、個體較大的魚作為雌性親本;選擇身體勻稱、體形粗長、活力較好,輕壓腹部有少量乳白色精液流出的個體作為雄性親本。
親本挑選完畢后放入直徑1 m的圓形養殖缸中,水位保持在50 cm左右,每天沖水8~12 h,以刺激親魚性腺發育。養殖池水質指標:溶解氧高于8 mg/L,pH在7.6~8.0,氨氮質量濃度低于0.2 mg/L,亞硝酸鹽氮質量濃度低于0.01 mg/L。
1.3?人工催產
2021年4月上旬至5月下旬,對裸體異鰾鰍鮠它進行了3批次的人工催產,親魚雌雄比接近1∶1。催產試驗設3種水溫,使用冷暖機組將水溫分別維持在(15.0±0.5)、(18.0±0.5)、(20.0±0.5)℃。采用胸鰭注射法對雌魚進行注射:第1針注射促黃體素釋放激素類似物(LHRH-A3)2 μg/kg,第2針注射LHRH-A3 10 μg/kg+絨毛膜促性腺激素(HCG)1 200 IU/kg+魚類腦垂體(PG)8 mg/kg,兩針間距12 h;雄魚不注射。
1.4?人工授精
對裸體異鰾鰍鮠它采用半干法授精。具體操作方法是:將雌魚用MS-222麻醉后,用毛巾將其生殖孔周圍的水分擦干,輕輕擠壓腹部,將卵子擠入盆中;自肛門處吸取雄魚的精液,加入有適量0.85%生理鹽水的注射器中稀釋,然后將其倒入裝有魚卵的盆中,用羽毛攪拌均勻,最后再加入清水攪拌2~3 min,使魚卵受精。
1.5?水溫對受精卵孵化的影響試驗
采用自制的錐形孵化袋進行受精卵孵化。孵化袋圓錐直徑約30 cm,高度約50 cm。在孵化袋下方安裝1個小型水泵,從錐形袋的底部由下而上沖水,保證魚卵在水中翻滾。孵化袋置于流水養殖缸中,缸內水體交換量在4~6次/d。為了探究水溫對裸體異鰾鰍鮠它受精卵孵化的影響,將水溫分別控制在(15.0±0.5)、(18.0±0.5)、(20.0±0.5)℃,每個試驗組設3個平行,每個平行100粒受精卵。
1.6?胚胎發育觀察
受精后,觀察水溫(20.0±0.5)℃下胚胎的發育情況。每次隨機抽取10粒受精卵平鋪在培養皿中,用解剖鏡觀察其發育進程并拍照記錄,同時記錄時間、發育特征等,其中胚胎發育時序按50%數量的受精卵發育至同一時期開始計時。
囊胚期之前每30 min觀察1次,進入囊胚期后每1 h觀察1次。
1.7?數據處理及分析
用游標卡尺測量卵徑大小、仔魚全長,使用EXCEL 2013、OriginPro 8軟件進行數據處理和繪圖。
2?結果
2.1?人工繁殖
3個批次裸體異鰾鰍鮠它的人工催產結果見表1。當水溫在(15.0±0.5)、(18.0±0.5)、(20.0±0.5)℃時,催產劑的效應時間分別為21、15、14 h。這一結果表明提高水溫可以縮短效應時間,從而提高產卵效率。注射催產針后,大部分雌魚產卵,表明試驗選擇的催產針劑可以有效促進裸體異鰾鰍鮠它雌魚產卵。本試驗3個批次的催產共得到約2 200粒卵,受精率在8.5%~76.8%。
2.2?水溫對受精卵孵化的影響
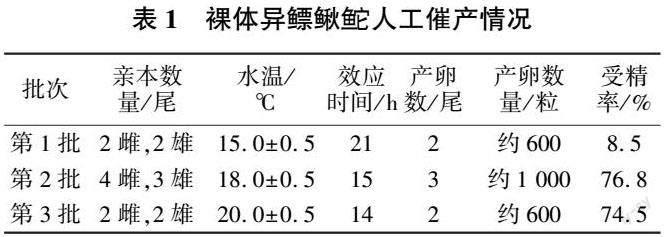
在裸體異鰾鰍鮠它人工繁殖的過程中發現,在水溫(15.0±0.5)℃條件下,孵化288 h,大部分仔魚未正常出膜;當水溫升高到(18.0±0.5)℃時,大部分仔魚在孵化168 h后破膜而出,但仍有少部分仔魚無法正常出膜;當水溫達到(20.0±0.5)℃時,仔魚的出膜時間縮短到120 h(見圖1)。
2.3?胚胎發育過程
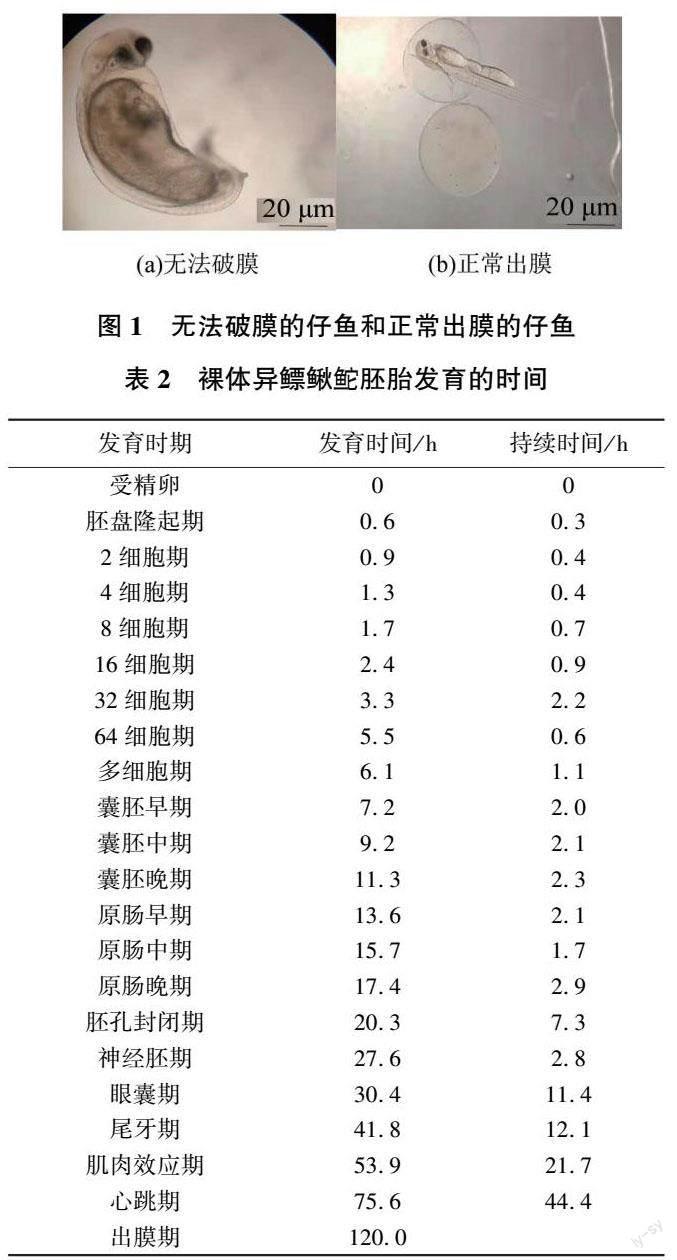
通過觀察胚胎發育過程發現,在(20.0±0.5)℃的水溫條件下,裸體異鰾鰍鮠它從受精卵到孵化出仔魚歷時約120 h,經過受精卵、胚盤隆起期、卵裂期、囊胚期、原腸胚期、神經胚期、器官發生期和出膜期等8個連續的階段,共22個時期(見表2)。
2.4?胚胎發育分期及特征
2.4.1?受精卵
裸體異鰾鰍鮠它為典型的產漂流性卵魚類。剛產出的魚卵顏色為墨綠色或黃綠色。受精后的魚卵迅速吸水膨脹,卵周隙逐漸擴大。受精后0.1 h左右,卵膜徑達到最大,為(3.02±0.24)mm(見圖2-a)。
2.4.2?胚盤隆起期
受精后約0.6 h,原生質逐漸向動物極移動,并逐漸隆起形成胚盤,進入胚盤隆起期。隨后胚盤逐漸變大、變高,高度占卵黃的1/6~1/5(見圖2-b)。
2.4.3?卵裂期
受精后約0.9 h,受精卵開始第1次分裂,胚盤中間凹陷形成1條溝,并逐漸加深形成分裂溝,分裂溝與胚盤垂直,將胚盤一分為二,分成大小2個相等的分裂球,此時進入2細胞期(見圖2-c)。再經過0.4 h,受精卵發生第2次分裂,垂直于第1條分裂溝,沿著2細胞中部形成1條縱向溝,將2個細胞分割成4個細胞,即進入4細胞期(見圖2-d)。受精后1.7 h,受精卵發生第3次分裂,平行于第1條分裂溝,將4個細胞分裂成8個細胞,即進入8細胞期(見圖2-e)。再經過0.7 h,受精卵發生第4次分裂,垂直于第1條分裂溝再將8個細胞分裂成16個,進入16細胞期(見圖2-f),此時細胞形狀不規則。受精后3.3 h,受精卵發生第5次分裂,將16個細胞分裂成32個,進入32細胞期(見圖2-g)。受精后5.5 h,受精卵發生第6次分裂,進入64細胞期(見圖2-h),此時細胞大小不規則,相互重疊,分裂溝不明顯。再經過1.1 h,經過多次分裂,細胞數量進一步變多,體積變小,細胞間的距離更加緊湊,細胞堆積并開始逐漸隆起,進入多細胞期(見圖2-i)。
2.4.4?囊胚期
受精后6.5 h,細胞逐漸變小以至于難以分辨界限,胚胎逐漸隆起,形成最初的胚層。7.2 h后胚層逐漸抬高,形似一頂圓帽,覆蓋于卵黃囊上方,高度約為卵黃的3/4,此時進入囊胚早期(見圖2-j)。受精后9.2 h,胚層變寬,高度逐漸降低并下移,囊胚腔逐漸出現,進入囊胚中期(見圖2-k)。受精后11.3 h,囊胚層進一步變薄,并逐漸向植物極方向下包,受精卵進入囊胚晚期(見圖2-l)。
2.4.5?原腸胚期
受精后13.6 h,胚層逐漸下包至卵黃囊的1/2處,進入原腸早期(見圖2-m)。受精后15.7 h,胚層繼續下包至卵黃囊的2/3處,發育至原腸中期(圖2-n)。再經過1.7 h,胚層下包至距離卵黃囊底部約1/5處,到達原腸晚期(見圖2-o)。
2.4.6?神經胚期
受精后20.3 h,胚層將卵黃囊全部包住,胚孔封閉(見圖2-p),此時胚層不對稱,表明胚體已經開始分化。再經過7.3 h,胚體形成,呈月牙形,神經板開始發育。受精后30.4 h,神經體一端突起形成頭部,另外一端顯露出尾部(見圖2-q),柱狀脊索已經非常明顯,胚體近腦端形成橢圓形眼囊(見圖2-r),可見13~14對肌節。
2.4.7?器官發生期
受精后41.8 h,胚體進一步增長,卵黃囊末端變窄,胚體末端突出形成尾芽(見圖2-s)。受精后53.9 h,胚體進一步變長,尾芽拉長,尾部出現鰭褶,胚體頭部突起形成腦泡,腦泡兩側隆起形成眼原基,同時胚胎開始間歇性扭動,進入肌肉效應期(見圖2-t)。再經過21.7 h,卵黃囊進一步變窄,胚胎扭動進一步加劇,卵膜變得薄而透明,可見心臟跳動(見圖2-u)。
2.4.8?出膜期
受精后120 h,胚胎通過劇烈扭動將卵膜頂破,破膜時尾部先出(見圖2-v)。再經過40~60 h,完全出膜,出膜仔魚全長為(6.40±0.32)mm,魚體透明(見圖2-w),隨著水流漂動,無法自主游泳,偶見有掙扎游動。
3?討論
3.1?裸體異鰾鰍鮀的人工繁殖
目前魚類常用的催產劑有促黃體素釋放激素類似物(LHRH)、絨毛膜促性腺激素(HCG)、腦垂體(PG)、地歐酮(DOM)等[10-11]。不同種類的魚對催產劑的敏感度不一樣。方園等[10]發現,HCG、LHRH-A2、DOM這3種催產劑的混合物對大刺鰍(Mastacembelue armatus)有較高的催產效率。夏子惠等[12]發現,PG+HCG+LHRH-A2對寬口裂腹魚(Schizothorax eurystomus)催產效果較好。同樣,筆者在裸體異鰾鰍鮠它的人工繁殖過程中發現,將LHRH-A3、HCG、PG這3種激素混合使用,親魚比較敏感,3批次試驗共對8尾雌魚進行了催產,其中有7尾雌魚產卵;當水溫在15~20 ℃時,催產后14~21 h雌魚可以擠出成熟的卵子,產卵量約300粒/尾。結果表明,通過2次催產針注射能提升裸體異鰾鰍鮠它的產卵效率。
魚類是一種變溫動物,水溫的劇烈變化對親魚性腺成熟和繁殖活動有顯著影響[13]。有研究發現,在沒有產卵基質的情況下,當水溫從12 ℃升高到20 ℃時,可誘導金魚的卵母細胞成熟并排卵[14];而對于低溫繁殖的魚類卻恰恰相反,例如當水溫較高時會引起海鱸(Dicentrarchus labrax L.)產卵推遲[15]。本試驗中,當水溫在(15.0±0.5)、(18.0±0.5)、(20.0±0.5)℃時,催產劑的效應時間分別為21、15、14 h,表明提高水溫可以縮短效應時間,提高產卵效率。但是,在(15.0±0.5)℃水溫條件下,魚卵的受精率較低,只有8.5%,而當水溫升至(18.0±0.5)、(20±0.5)℃時,受精率可達70%以上。裸體異鰾鰍鮠它的繁殖季節在4月下旬到5月上旬,此時金沙江水的水溫在17 ℃左右,裸體異鰾鰍鮠它能在17~20 ℃的水溫下完成自然產卵和受精過程,但水溫過低可能使魚卵的受精率受到影響。
3.2?裸體異鰾鰍鮀的胚胎發育
本試驗發現,裸體異鰾鰍鮠它的胚胎發育過程經過受精卵、胚胎隆起期、卵裂期、囊胚期、原腸胚期、神經胚期、器官發生期、出膜期等8個階段,共22個時期,這與其他大多數鯉科魚類相似。
不同魚類的胚胎發育具有各自物種的特異性,其發育所需的時間也不同。如伊犁裂腹魚(Schizothorax pseudaksaiensis Herzenstein)仔魚經過122 h 30 min出膜[16],黑龍江茴魚(Thymallus arcticus grubei Dybowski)胚胎經過408 h開始破膜而出[17]。這可能與不同魚類的遺傳因素相關。此外,魚類的胚胎發育過程也受水溫、溶解氧、光照等多個外因的影響[18-20],其中水溫是最主要的影響因素之一。目前已有研究發現,水溫對魚類的胚胎發育時間、出膜率有明顯影響[20-22]。郭永軍等[20]發現,水溫升高有利于縮短鯉魚(Cyprinus carpio L.)胚胎發育的時間。韋正道等[21]發現,松江鱸(Trachidermus fasciatus)的最適胚胎發育水溫為10~11 ℃,水溫太低會影響仔魚出膜,從而引起胚胎死亡。尹家勝等[22]發現,當水溫低于14 ℃時,黑龍江野鯉(Cyprinus carpio haematopterus)的胚胎發育時間較長且只有少量仔魚破膜而出;而當水溫在15 ℃以上時,大部分胚胎在同一天內出膜。這些研究與本試驗結果一致。當水溫較低[(15.0±0.5)℃]時,裸體異鰾鰍鮠它的胚胎發育時間較長,而且大量仔魚無法出膜;水溫升高則大大縮短了其胚胎發育時間。
為了解裸體異鰾鰍鮠它人工繁殖和胚胎發育特性,本研究使用金沙江采集到的裸體異鰾鰍鮠它作為親本,探究了水溫對裸體異鰾鰍鮠它人工催產效果、胚胎發育的影響,并記錄了水溫在(20.0±0.5)℃時該魚胚胎發育各階段的主要特征,研究結果可為今后深入開展裸體異鰾鰍鮠它的繁殖生物學研究提供參考資料。另外,本試驗研究的裸體異鰾鰍鮠它人工繁殖技術,可在生產上指導該魚的規模化高效繁殖,為其增殖放流和物種保護提供參考依據。
參考文獻
[1]丁瑞華.四川魚類志[M].成都:四川科學技術出版社,1994.
[2]張剛.池河流域水電站梯級開發對魚類資源的影響研究[J].陜西水利,2016(4):48-49.
[3]張家福,黃漢禹,鄭國權.滃江梯級水電站開發對魚類的影響及對策[J].廣東水利水電,2010(2):12-14.
[4]權全,王炎,田開迪,等.黃河上游羊曲水電站對土著魚類的影響與保護[J].環境影響評價,2018,40(6):63-66.
[5]劉海平,朱洪云.西藏魚類資源保護的地方立法現狀與思考[J].家畜生態學報,2013,34(1):86-89.
[6]劉飛,林鵬程,黎明政,等.長江流域魚類資源現狀與保護對策[J].水生生物學報,2019,43(增刊1):144-156.
[7]陳宜喻.中國動物志硬骨魚綱鯉形目(中卷)[M].北京:科學出版社,1998.
[8]曾曉蕓,楊宗英,田輝伍,等.基于Mi-Seq高通量測序分析裸體異鰾鰍鮀微衛星組成[J].淡水漁業,2015,45(1):3-7.
[9]董微微.異鰾鰍鮀與裸體異鰾鰍[HT6,7"]魚[KG-*3]它形態特征及群體遺傳學研究[D].重慶:西南大學,2019.
[10]方園,吳真,曾慶祥,等.大刺鰍人工繁殖與胚胎發育研究[J].江西農業學報,2021,33(12):99-103.
[11]梁祥,鐘文武,冷云,等.秀麗高原鰍胚胎發育觀察[J].水產科學,2018,37(1):79-84.
[12]夏子惠,趙賀,邱夢,等.寬口裂腹魚的人工催產、胚胎發育及早期仔魚發育觀察[J].大連海洋大學學報,2022,37(3):471-481.
[13]牛景彥,劉占才.影響魚類性腺發育的生態因素研究[J].農業與技術,2016,36(16):109.
[14]LAM T J.Environmental influences on gonadal activity in fish[J].Fish Physiology,1983,9:65-116.
[15]ZANUY S,CARRILLO M,RUIZ F.Delayed gametogenesis and spawning of sea bass (Dicentrarchus labrax L.) kept under different photoperiod and temperature regimes[J].Fish Physiology and Biochemistry,1986,2(1):53-63.
[16]蔡林鋼,牛建功,張北平,等.伊犁裂腹魚胚胎及早期仔魚發育的觀察[J].淡水漁業,2011,41(5):74-79.
[17]韓英,張瀾瀾,趙吉偉,等.黑龍江茴魚胚胎的發育及仔、稚、幼魚的生長[J].淡水漁業,2009,39(4):17-21.
[18]殷名稱.魚類生態學[M].北京:中國農業出版社,1995:105-145.
[19]許源劍,孫敏,柴學軍,等.日本黃姑魚胚胎發育及溫度對其過程的影響[J].浙江海洋學院學報(自然科學版),2010,29(6):544-550.
[20]郭永軍,陳成勛,李占軍,等.水溫和鹽度對鯉魚(Cyprinus carpio L.)胚胎和前期仔魚發育的影響[J].天津農學院學報,2004(3):5-9.
[21]韋正道,王昌燮,杜懋琴,等.孵化期溫度對松江鱸魚胚胎發育的影響[J].復旦學報(自然科學版),1997,36(5):577-580.
[22]尹家勝,邱嶺泉,徐偉,等.水溫變化對黑龍江野鯉繁殖的影響[J].上海水產大學學報,2002(3):253-258.
Abstract: In order to understand the artificial reproduction and embryonic development of Xenophysogobio nudicorpa,10 female fish(average body length and body weight were 17.5 cm and 22.3 g,respectively) and 8 male fish(average body length and body weight were 15.6 cm and 17.5 g,respectively) collected from Jinsha River were used as parents to carry out artificial breeding experiments in three batches.The embryonic development was observed and recorded at (20.0±0.5)℃.The results showed that the effect time of oxytocic agent(2 μg/kg LHRH-A3 at the first injection,and 10 μg/kg LHRH-A3+1 200 IU/kg HCG+8 mg/kg PG at the second injection for female fish,the interval was 12 h,male fish was not injected) were 21,15,14 h,and the fertilization rates of fish eggs were 8.5%,76.8%,74.5%,respectively under the conditions of water temperature (15.0±0.5),(18.0±0.5),(20.0±0.5)℃.The fertilized eggs incubated at (15.0±0.5)°C for 288 hours,most of larvae failed to emerge normally.When the water temperature rose to (18.0±0.5)°C,most of larvae broke the membrane after 168 h hatching,although a small number of fish failed.However,the larvae emerged normally,and the membrane emergence time was also shortened to 120 h at (20.0±0.5)°C.Under the water temperature (20.0±0.5)℃,the embryonic development process of X. nudicorpa could be divided into 8 consecutive stages including fertilized eggs,blastodisc bulge stage,cleavage stage,blastocyst stage,gastrula stage,neurula stage,organogenetic period and hatching stage with 22 periods in total.
Key words: Xenophysogobio nudicorpa; artificial propagation; embryonic development; water temperature
作者簡介:薛敬陽(1989—),女,高級工程師,主要從事生態環境保護研究。E-mail:xue_jingyang@ctg.com.cn
項目資助:中國三峽建設管理有限公司科研項目(JG/2039B)。

