不同外源激素處理對榕屬植物種子萌發和幼苗生長的影響
張 穎, 官云芳, 向建英, 張 媛
(1.西南林業大學生物多樣性保護學院, 昆明 650224;2.西南林業大學云南生物多樣性研究院, 昆明 650224)
桑科(Moraceae)榕屬(Ficus)植物是國際上公認的熱帶雨林中的一類關鍵植物類群[1],在熱帶雨林中,一年四季均可掛果的榕屬植物為熱帶地區的鳥類、獸類、昆蟲等動物提供了重要的食物來源,同時也為多種寄生和附生植物提供了棲息與生存空間,榕屬植物在維持熱帶雨林生態系統穩定性中發揮著不可替代的作用[2]。同時,榕屬植物在云南、福建、廣東、海南、四川等省也被作為行道樹種廣泛種植,是重要的園林觀賞植物,也是重要的食用、藥用植物[3]。近年來,隨著榕屬植物的生態價值和應用價值逐漸被發掘,榕屬植物也受到研究人員越來越多的關注。
目前,榕樹栽培主要依賴播種實現幼苗扦插或嫁接繁殖,但較低的發芽率和成苗率成為影響榕樹栽培成功率的重要因素[4],當前針對外源激素對榕樹種子萌發和幼苗生長的研究較少。隨著農業技術的不斷發展,施加多種手段以提高作物產量和種子萌發率在農林生產中被廣泛利用,如控溫控濕[5]、使用化學物質[6]、外施植物激素[7-9]等,其中,使用激素浸種是高效的促生產手段之一。種子萌發需要諸多不同的因素相互協調和相互作用[10],在一些植物上,施用少量激素就可能影響植物的生長繁殖[11]。種子培育的常用外源激素主要有生長素(IAA)、赤霉素(GA)、細胞分裂素(6-BA)、乙烯(ETH)和油菜素甾醇(BR)等[12]。其中,生長素可通過影響細胞周期來調控植物種子的萌發[13],赤霉素能增強種胚活力,從而打破休眠[14]。細胞分裂素能促進植物多種組織的分化和生長,并可與植物生長素協同作用[12]。已有學者就不同植物激素對種子萌發和幼苗生長開展了一系列研究,例如:研究發現赤霉素能夠顯著提高柴胡種子的發芽勢、發芽率[15],外施細胞分裂素可提高小麥種子萌發率[16],高濃度的生長素會抑制擬南芥的種子萌發,而低濃度則促進種子萌發和幼苗生長[17-18]。本研究以兩種榕屬植物為對象,探明3種外源激素對兩種不同繁殖模式的榕屬植物種子萌發和幼苗生長的影響,對比研究兩種植物對不同激素的響應差異,為榕屬植物的保護、育種,以及園林綠化樹種的選擇提供科學依據。
1 材料與方法
1.1 試驗材料
供試種子為垂葉榕(FicusbenjaminaL.) 及對葉榕(FicushispidaL.) 的雌果,均采自云南省西雙版納州勐臘縣勐侖鎮中國科學院西雙版納熱帶植物園及其周邊地區。選取垂葉榕和對葉榕雌樹各3株,進行跟蹤觀察,待榕果發育至成熟期后進行采摘,每種采集10個果,剝取果內成熟、飽滿、無病蟲害的種子,混合后進行清洗晾干。兩種榕屬植物的屬性見表1[19]。
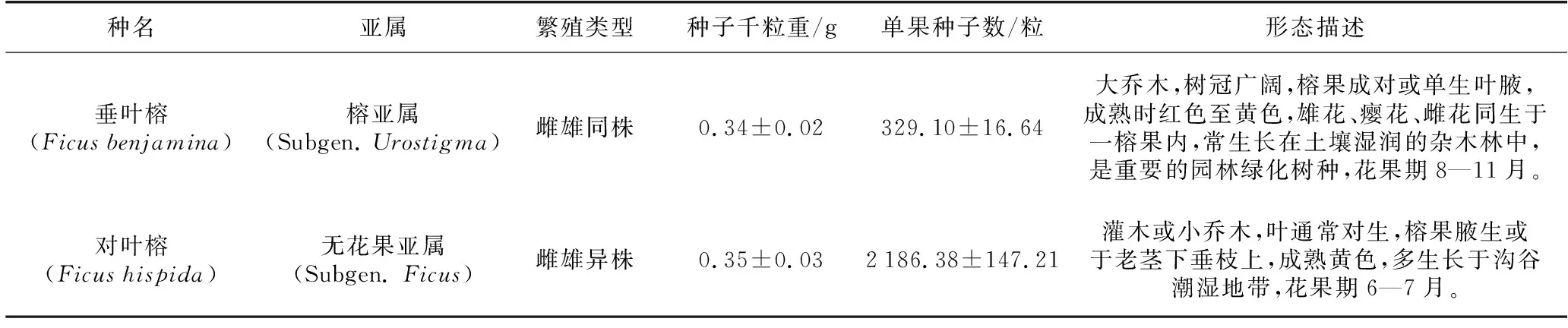
表1 兩種榕屬植物的特征Table1 Characteristics of two Ficus plants
1.2 試驗方法
將備用的種子用0.1% HgCl2溶液浸泡滅菌10 min,隨后用純水沖洗5~6次。IAA、GA及6-BA均設置5個濃度梯度,分別為0(ck),10,20,40,80 mg/L。每種處理浸種時間均為24 h,浸種溶液含量25 mL。浸種結束后用純水沖洗種子3~5次。之后將每個處理的種子10粒一組均勻放置于滅菌處理培養皿中(直徑120 mm),每種激素每個濃度梯度下設置3個重復,故每種種子在每個處理下共30粒種子,每種植物種子共450粒。皿內墊有用超純水浸濕的1 cm脫脂棉花和滅菌濾紙,濾紙需充分濕潤但水不可浸出。將設置好的處理放至賽福PRX-350C人工氣候箱中培養,每日光照時間為12 h,溫度為30 ℃,濕度80%。持續培養直至種子不再生長,在此期間需每日查看濾紙的濕潤情況,如需補充水分則在濾紙上噴灑一定量的蒸餾水以保證濾紙濕潤。
1.3 測定指標與計算公式
每天觀察并記錄種子萌發情況,萌發標準為胚根長度達2 mm。每周測量一次發芽種子的根長、莖長(寶工PD-151電子游標卡尺),以及幼苗的根系數量。種子萌發及幼苗生長指標計算公式如下:
發芽率/%=(正常發芽的種子數/供試種子數)×100%;
發芽勢/%=(發芽高峰期發芽的種子數/供試種子數)×100%;
發芽指數(GI)=∑(Gt/Dt);
活力指數(VI)=GI×Gx;
平均萌發時間=(A1T1+A2T2+…+AnTn)/(A1+A2+…+An),
式中,Gt為某日的發芽數,Dt為與Gt對應的發芽天數,Gx為苗的平均長度,An為培養第n天發芽數;Tn為相應發芽天數。
1.4 數據處理
使用Excel2019軟件完成數據記錄和整理,采用SPSS26.0軟件進行統計分析。采用卡方檢驗分析激素對種子發芽的影響,采用單因素方差分析(ANOVA)中的新復極差法(Duncan’s法)分析激素對幼苗生長的影響,使用Origin2019軟件繪圖。
2 結果與分析
2.1 3種外源激素對榕樹種子發芽率、發芽勢和發芽指數的影響
IAA對垂葉榕種子發芽率具有顯著的促進作用,在40 mg/L濃度下,垂葉榕種子萌發顯著增加,發芽率可達95%,其發芽勢隨著IAA濃度的升高呈下降趨勢,發芽指數則隨IAA濃度的升高出現先增后降的變化,發芽指數在濃度為20 mg/L下最大;而對葉榕種子的發芽率在IAA的5個濃度梯度下無顯著差異,發芽勢和發芽指數對IAA的濃度響應不顯著(圖1a,圖1d)。
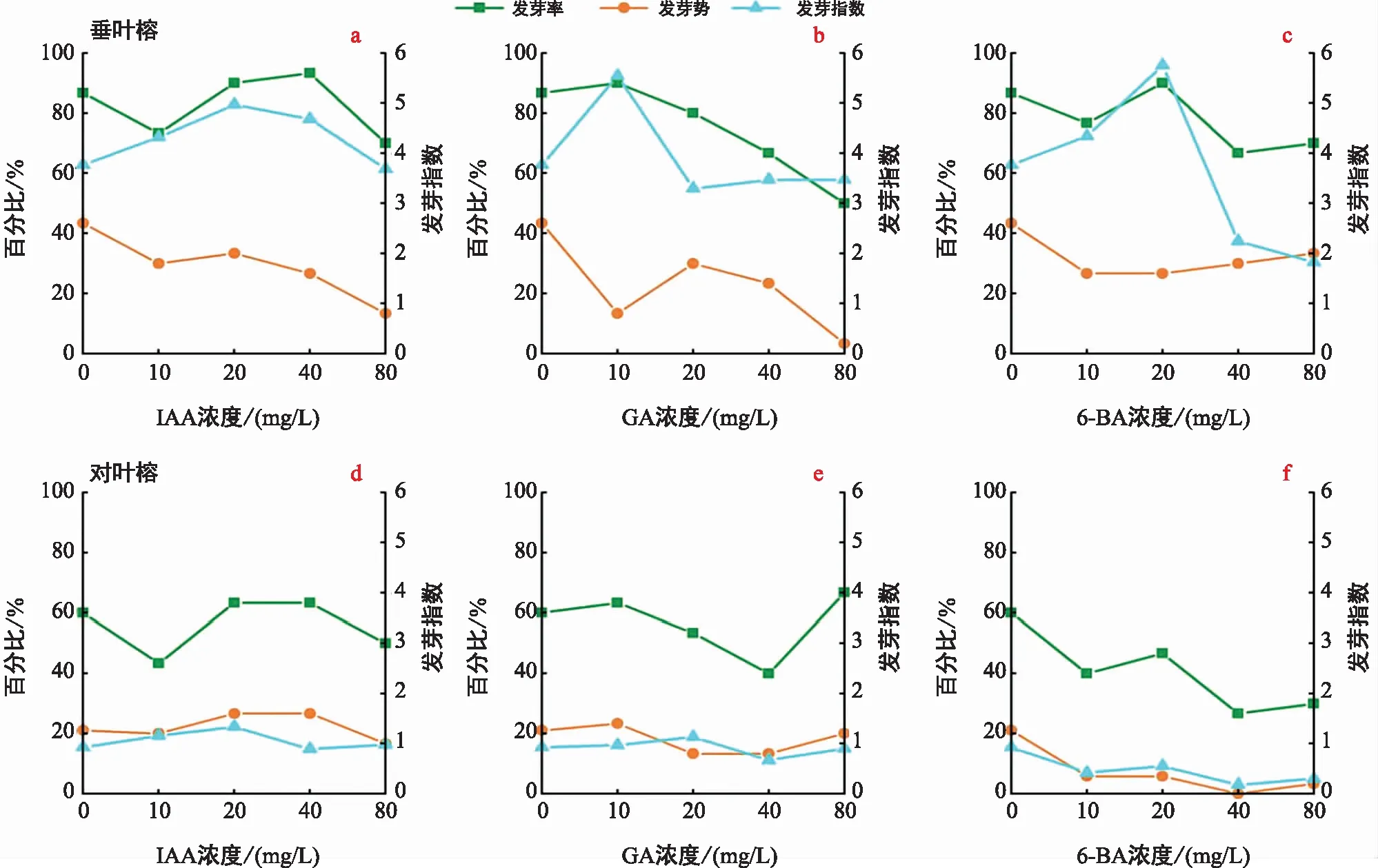
圖1 3種外源激素對兩種榕樹種子發芽率、發芽勢和發芽指數的影響Fig.1 Effects of three exogenous hormones on germination rate, germination potential and germination index of two varieties of Ficus seeds
GA對兩種榕樹種子的萌發率未表現出顯著的促進作用,隨著GA濃度的增加,垂葉榕的萌發率和發芽勢呈下降趨勢,但在10 mg/L濃度下,GA顯著增加垂葉榕的發芽指數。不同濃度的GA對對葉榕的發芽勢和發芽指數均無顯著影響,高濃度的GA對對葉榕種子萌發具有一定的抑制效應(圖1b,圖1e)。
6-BA對垂葉榕的發芽率和發芽勢的影響不顯著,但在20 mg/L濃度下,6-BA顯著增加垂葉榕的發芽指數。在6-BA處理下,對葉榕種子的發芽率、發芽勢和發芽指數隨著6-BA濃度的升高呈下降趨勢,對照組的發芽率、發芽勢和發芽指數均最高(圖1c,圖1f)。
試驗結果表明,3種激素對兩種榕屬植物種子的萌發指標存在影響,但影響程度不同,3種激素對對葉榕萌發影響較小,而對垂葉榕的影響相對較大。對葉榕的萌發率在40%~60%之間,在經GA處理后最高可達70%左右,而垂葉榕的整體萌發率較高,一般可達80%以上,在經IAA處理后可達90%以上。
2.2 3種外源激素對榕樹種子平均萌發時間、活力指數的影響
3種激素均可在一定程度上縮短垂葉榕種子的萌發時間,特定濃度下能夠提高種子活力,縮短萌發時間。IAA在20 mg/L濃度下,垂葉榕種子的平均萌發時間由13 d縮短為9 d,但繼續提高IAA濃度,萌發時間又開始延長,在80 mg/L處理下甚至高于ck處理的萌發時間,說明高濃度的IAA對垂葉榕種子萌發有抑制作用。而GA和6-BA均是在低濃度(10 mg/L)時可以縮短種子的萌發時間,而當濃度繼續增加時,垂葉榕的萌發時間延長或基本不變。3種激素除了改變垂葉榕的平均萌發時間外,一定濃度的激素還可以提高種子的活力指數,IAA、GA和6-BA分別在20 mg/L、10 mg/L和10 mg/L濃度下活力指數有顯著提升。結果表明,當垂葉榕活力指數提高時,其種子萌發時間相應縮短(圖2a~圖2c)。
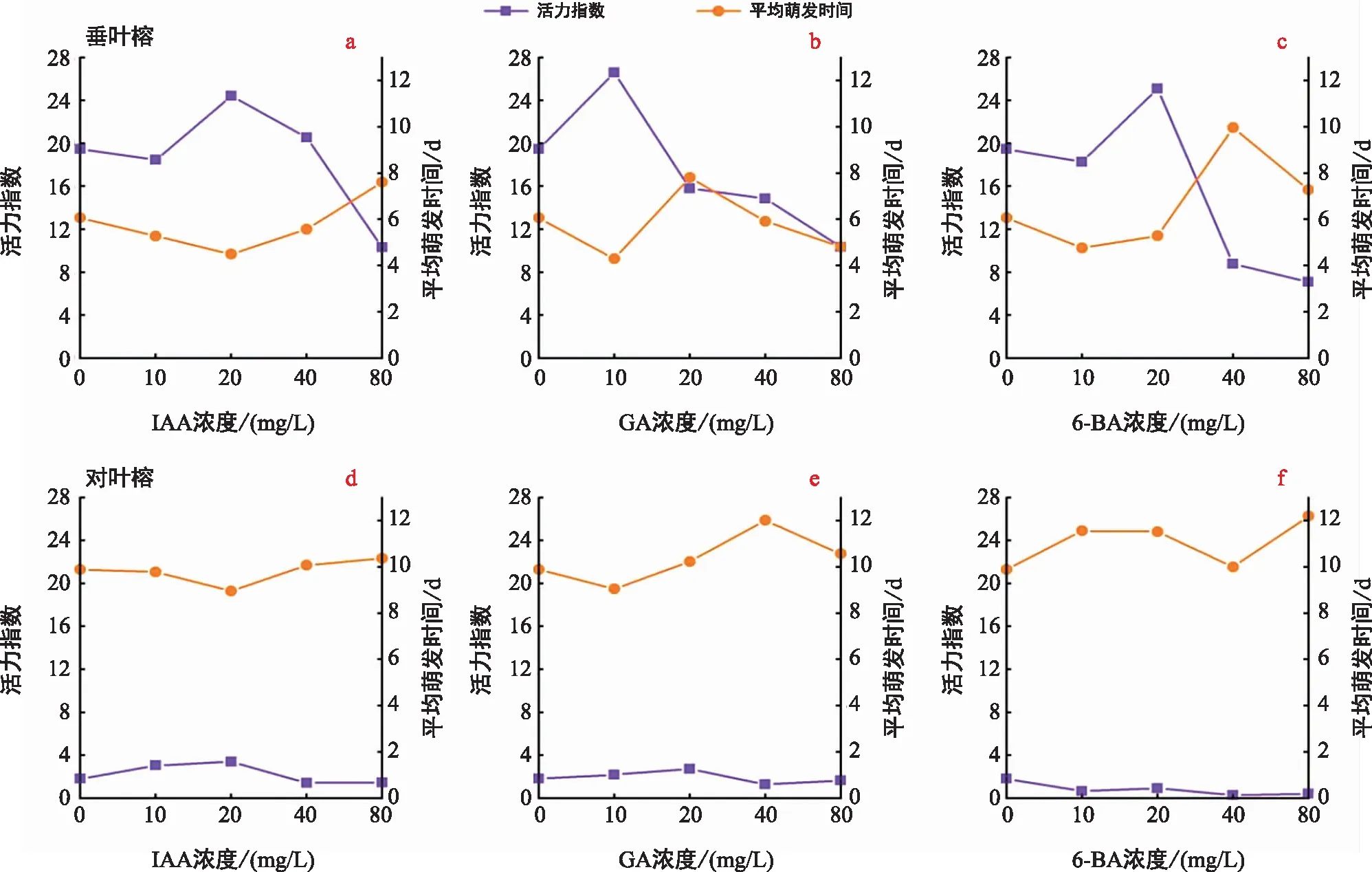
圖2 3種外源激素對兩種榕樹種子平均萌發時間、活力指數的影響Fig.2 Effects of three exogenous hormones on average germination time and vigor index of two varieties of Ficus seeds
在對葉榕上,3種激素對萌發時間和活力指數的影響相較于垂葉榕更小。IAA對對葉榕的平均萌發時間無顯著影響,GA濃度為10 mg/L時,對葉榕萌發時間由21 d縮短為19 d,但差異不顯著,6-BA在4個濃度梯度下均未能顯著縮短對葉榕的萌發時間。3種激素處理下,對葉榕種子的活力指數與對照組相比,無顯著變化(圖2d~圖2f)。
2.3 3種外源激素對榕樹種子根長、莖長及根系數量的影響
3種激素對垂葉榕的根長和莖長的促進效應并不顯著,在高濃度下(80 mg/L),3種激素對垂葉榕的根長存在抑制效應,根長顯著縮短,垂葉榕的莖長在3種激素的4個濃度梯度下差異均不顯著。但3種激素在10 mg/L、20 mg/L和40 mg/L這3組濃度梯度下,均能夠顯著增加垂葉榕的根系數量,但當激素濃度過高時,根系數量又下降至與對照組相似或小于對照組的水平(圖3a~圖3c)。
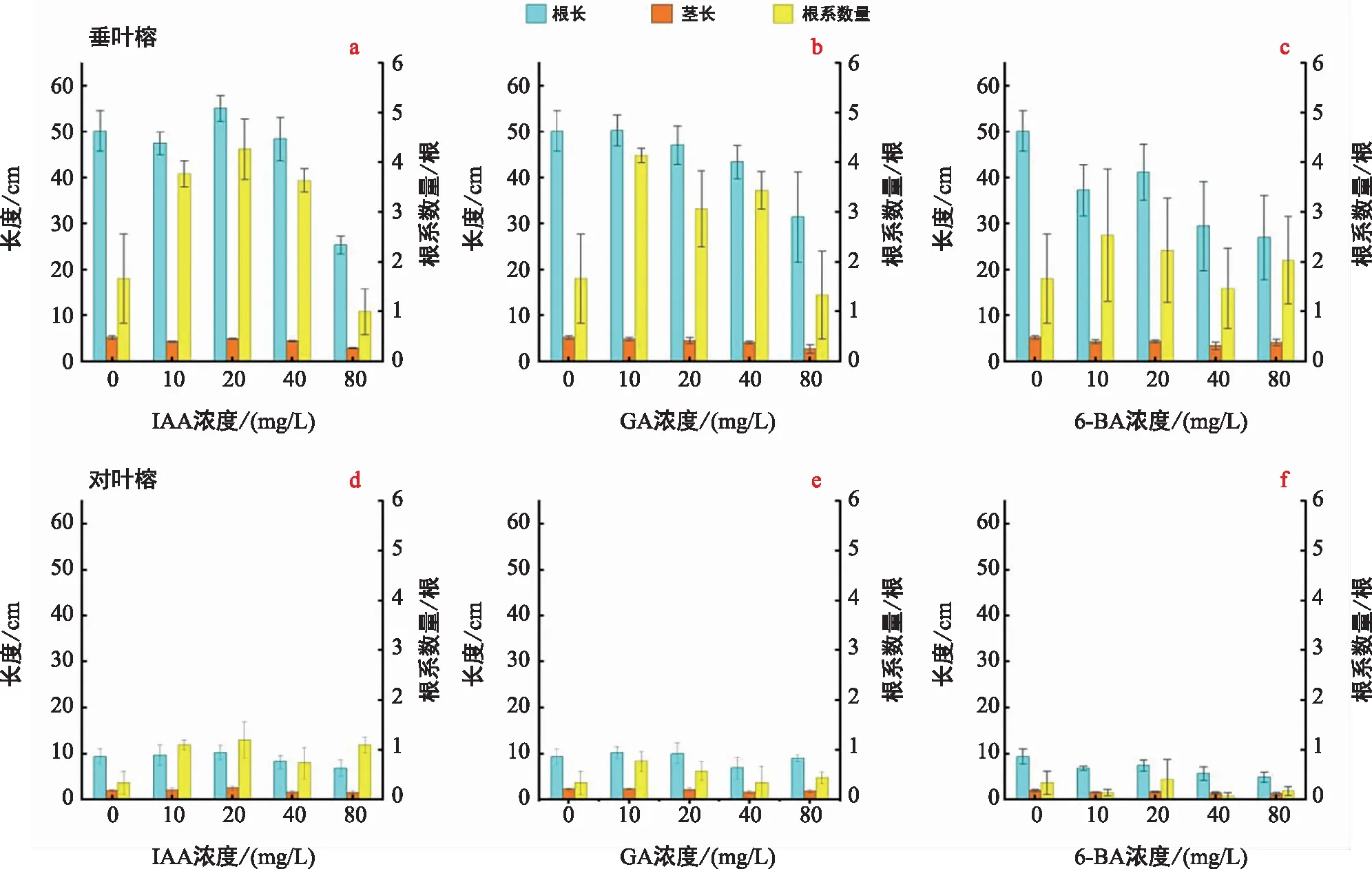
圖3 3種外源激素對兩種榕樹種子根長、莖長及根系數量的影響Fig.3 Effects of three exogenous hormones on root length, stem length and root number of two varieties of Ficus seeds
對照組和3種激素處理下的對葉榕的莖長和根長顯著小于垂葉榕,但幼苗對激素的響應呈現出與垂葉榕類似的結果:3種激素的不同濃度對對葉榕的莖長和根長的影響均不顯著,但IAA與GA能夠顯著增加對葉榕的根系數量,6-BA對對葉榕根系數量的改變不顯著(圖3d~圖3f)。
3 討 論
植物外源激素浸種是調節植物生長發育及代謝的一個重要手段[20],其質量濃度及施用方法的不同均會影響植物的生長發育進程[21]。IAA、GA、6-BA對榕樹種子萌發和幼苗生長都具有一定的促進效應,但不同激素對榕樹種子萌發和幼苗生長的促進效應不同,同一激素的不同濃度也對不同榕樹種子萌發和幼苗生長的影響存在差異。IAA能夠提高榕樹種子的發芽率、發芽勢、發芽指數以及活力指數,同時還能縮短發芽時間,且較低濃度就能實現促進效應,這與IAA對其他植物種子萌發的促進效應結果基本一致[22],但IAA對兩種榕樹幼苗生長的影響存在差異。從兩種榕樹的發芽勢結果推測,IAA對垂葉榕種子的活力及萌發的整齊度具有抑制效應。低濃度的GA對垂葉榕種子萌發具有促進作用,這一結果與Garcia等[23]的結果一致。而對葉榕種子萌發的促進效應則需要高濃度GA來實現,且促進效應不明顯。低濃度的6-BA會促進垂葉榕種子萌發,對葉榕種子萌發則隨著6-BA濃度的升高而呈現明顯的抑制效應,僅在10~20 mg/L的6-BA影響下,對葉榕種子的萌發數值有小幅度的上升,這可能與種子內部ABA的含量及相關細胞感應6-BA的敏感性高低有關[24]。IAA、GA、6-BA對榕樹幼苗生長的促進效應并不明顯。僅10 mg/L GA和20 mg/L IAA處理的根長比對照組長。且在低濃度的6-BA作用下,榕樹幼苗根長數值有小幅度上升,隨著濃度逐漸升高,其根長逐漸縮短。這可能與6-BA和ABA的拮抗作用有關[25]。而不同榕樹幼苗莖長對不同激素浸種的響應存在種間差異,可能與不同榕樹幼苗莖細胞對IAA、6-BA和GA的敏感程度有關。與此同時,這3種激素可明顯促進榕樹幼苗根系數量。一般來說,植物根系數量越多、根越長,則分布得越深越廣,植物根系固土能力就越強,根系數量特征和結構特征對植物根系固土有著重要影響[26]。這3種外源激素的施用可以通過促進榕樹幼苗根系數量,提高榕樹幼苗生長,從而提高其成活率。本研究發現,激素對兩種榕屬植物根系數量存在顯著影響,進一步運用植物生理學手段研究不同榕屬植物根系生長對不同激素的響應機制,將是一個有意義的研究方向。
本研究表明,垂葉榕種子和幼苗的生長發育情況與對葉榕存在較大差異,可能是對葉榕的生境一般為陰濕的溝谷地區,而垂葉榕喜生長于相對高溫、郁閉度低的林區[19]。溫度、光照可能是影響兩種榕樹種子萌發和幼苗生長情況差異顯著的原因[27-28],對垂葉榕種子進行周期性光照處理后萌發得到促進,同時光照與激素存在交疊作用,兩種榕樹在同一光照強度和相同激素處理下,生長情況存在差異,也可能與自身光敏性差異有關[29],但不同榕屬植物對光照時間和光照強度的響應差異需要進一步驗證。在外界實驗處理一致時,兩種榕樹種子萌發情況仍存在差異,可能兩種榕樹種子的胚乳發育進程不一致,或是對葉榕種子較垂葉榕種子休眠期長,從而導致兩種榕樹種子萌發和幼苗生長的差異[5,30]。實驗過程中,發現雌雄同株的垂葉榕種子上無凝膠狀物質覆蓋,雌雄異株的對葉榕種子表面覆蓋了黏滑的膠狀物,利用淘洗、水沖等手段該物質仍不易去除,推測該膠狀物在未經鳥類等食果動物消化道處理時[31],可能會阻礙對葉榕種子突破種皮的束縛[32],使得對葉榕種子的發芽率顯著低于垂葉榕種子。總體來看,垂葉榕較對葉榕具有更高的發芽率,在本次實驗設置條件下,種子萌發和幼苗生長對激素的響應也更為顯著,作為園林綠化樹種進行種植時,可能具有更高的栽培成功率。
本實驗對比研究了3種外源激素的不同濃度處理對兩種榕樹種子萌發和幼苗生長的影響,為今后在更大范圍內開展激素對榕屬植物影響研究提供了參考,同時也可為榕屬植物的繁殖和利用提供科學依據。

