不同溫度和外源物質處理對耳葉牛皮消種子萌發的影響
劉方方, 黃進嬋, 段 彤, 沈 敏, 洪 鍵,孫 淼, 張言周, 吳承東, 康貽軍
(1.鹽城師范學院海洋與生物工程學院,鹽城市濱海白首烏生物工程技術研究中心, 江蘇 鹽城 224007;2.江蘇省鹽土生物資源研究重點實驗室, 江蘇 鹽城 224007;3.鹽城市新洋農業試驗站, 江蘇 鹽城 224049)
耳葉牛皮消(Cynanchumauriculatum)是蘿藦科鵝絨藤屬植物,其塊根與同屬的隔山牛皮消(Cynanchumwilfordii)和戟葉牛皮消(Cynanchumbungei)的塊根被并稱為白首烏,是一種傳統滋補中藥材。耳葉牛皮消的塊根富含C21甾苷類、多糖類、苯酮類等天然活性成分,具有抗腫瘤、抗氧化、保肝護肝、調節免疫及降脂減肥等多重藥理功效[1-4]。此外,耳葉牛皮消塊根中粗蛋白、粗脂肪、淀粉和氨基酸的含量較豐富,還含有多種維生素及鋅、錳、鐵、鈣等人體必需微量元素[5-6],具有較高的食用價值。耳葉牛皮消作為一種藥食同源的植物,開發利用價值較高,市場前景廣闊。目前,市場上白首烏產品的來源主要為濱海白首烏(耳葉牛皮消)和泰山白首烏(戟葉牛皮消)[4],全國95%的耳葉牛皮消產自江蘇省鹽城市濱海縣[7-8]。作為地產道地藥材,濱海白首烏被認定為中國國家地理標志產品,并建立了首個國家級白首烏標準化種植示范區[9]。
耳葉牛皮消的繁殖可采用多種方式,包括塊根繁殖、種子繁殖、藤蔓扦插和組織培養等,規模化人工栽培主要采用塊根繁殖[10]。塊根無性繁殖的幼苗較健壯、成活率高,但成本較高,出苗周期長,且后期易發生侵染性病害,導致種性退化,影響白首烏的產量和品質[11-12]。耳葉牛皮消種子繁殖的出苗整齊度不高,出苗速度和苗期生長較緩慢,但后期生長迅速,塊根粗大,產量有保障[13]。目前,規模化栽培中采用耳葉牛皮消種子繁殖的比例不高,通過種子萌發進行耳葉牛皮消有性繁殖的研究也鮮有報道。本實驗通過研究溫度、激素和化學試劑對耳葉牛皮消種子萌發的影響,優化種子萌發條件,以期為耳葉牛皮消良種繁育、種質資源保護與利用以及產業可持續發展提供參考。
1 材料與方法
1.1 實驗材料
耳葉牛皮消種子于2021年11月初采自江蘇省鹽城市濱海縣濱海港鎮,果實未開裂時摘取,風干后果實裂開,取出種子,去雜,去種毛,干燥貯藏。
1.2 種子形態特征觀察與測量
采用目測法觀測種子基本形態。隨機選取10粒種子,用游標卡尺測量種子長度、寬度和厚度。千粒重參照國標規程(GB/T3543—1995),采用百粒法,隨機選取100粒種子,用萬分之一電子天平稱量,計算千粒重,重復4次。
1.3 種子預處理
選用大小均勻、飽滿、無破損、無病斑的種子。先用75%乙醇消毒5 min,無菌蒸餾水沖洗2次,再用3%次氯酸鈉消毒1 min,無菌蒸餾水沖洗4次后備用。
1.4 實驗設計
1.4.1發芽實驗
將處理后的種子轉入含有無菌紙質發芽床的培養皿中,每皿25粒種子,每個重復50粒,每個處理重復3次。在恒溫光照培養箱內,于光照時間12 h/d、光照度20%、相對濕度(RH)80%的條件下進行發芽實驗。實驗過程中,根據培養皿內失水情況補充無菌水,以保持發芽床濕潤。
1.4.2種子萌發條件的優化
發芽溫度:將預處理后的種子分別在15,25,35 ℃的光照培養箱中進行發芽實驗,以確定最佳發芽溫度。
浸種溫度:將預處理后的種子浸泡在無菌水中,分別于5,25,35 ℃水浴浸種24 h,然后在最佳發芽溫度的光照培養箱中進行發芽實驗,以確定最佳浸種溫度。
激素處理:采用3種激素,設置濃度分別為:赤霉素(GA3)100,200,400 mg/L;吲哚乙酸(IAA)5,10,20 mg/L;6-芐氨基嘌呤(6-BA)50,100,200 mg /L。以無菌水為對照,于最佳浸種溫度下,將預處理后的種子在上述溶液中浸泡處理24 h,然后進行發芽實驗。
化學試劑處理:采用3種化學試劑(無機鹽),設置濃度分別為:氯化鈣(CaCl2)0.5,1.0,2.0 g/L;硝酸鉀(KNO3)2.0,4.0,6.0 g/L;氯化鈉(NaCl)1.0,5.0,10.0 g/L。以無菌水為對照,于最佳浸種溫度下,將預處理后的種子在上述溶液中浸泡處理24 h,然后進行發芽實驗。
組合處理:從激素和化學試劑處理中篩選出效果好的激素和試劑,進行組合,采用混合溶液浸泡種子,以無菌水為對照進行發芽實驗。
1.5 數據統計與分析
1.5.1種子發芽指標
將種子放入光照培養箱后,每天同一時間觀察種子發芽情況,記錄發芽種子數(露白,即胚根突破種皮1 mm為種子發芽標準),直至發芽結束,計算種子發芽率、發芽勢和發芽指數等指標,具體計算方法如下:
發芽率/%=(發芽種子數/供試種子數)×100%;
發芽勢/%=(前8 d內發芽種子數/供試種子數)×100%;
發芽指數=∑(Gt/Dt),式中:Gt為第t天的發芽種子數,Dt為對應的發芽天數。
1.5.2數據分析
采用Microsoft Excel軟件對實驗數據進行預處理和計算,采用SPSS軟件進行方差分析和多重比較(α=0.05)。數據均為平均值±標準差,采用Excel和GraphPad Prism軟件作圖。
2 結果與分析
2.1 耳葉牛皮消種子形態特征
耳葉牛皮消結實率較高,種子扁卵狀,種皮褐色,種子頂端有一簇白色絨毛(圖1)。種子千粒重為(6.018±0.086)g,種子長度為(0.734±0.032)cm,種子寬度為(0.353±0.017)cm,種子厚度為(0.112±0.012)cm。

圖1 耳葉牛皮消種子形態特征Fig.1 Seed morphological characteristics of Cynanchum auriculatum
2.2 溫度對耳葉牛皮消種子萌發的影響
2.2.1培養溫度對種子萌發的影響
不同培養溫度下耳葉牛皮消種子的萌發進程(圖2a)。結果顯示,在15 ℃,25 ℃和35 ℃的條件下,種子起始萌發時間分別為第7天、第4天和第5天。15 ℃和25 ℃下,種子萌發進程中有較明顯的高峰期,而35 ℃下,種子萌發進程相對平緩。不同培養溫度下種子萌發相關指標見表1,25 ℃下種子的發芽率、發芽勢和發芽指數均顯著高于15 ℃和35 ℃。以上結果表明,耳葉牛皮消種子萌發對溫度敏感,25 ℃為較佳的培養溫度。
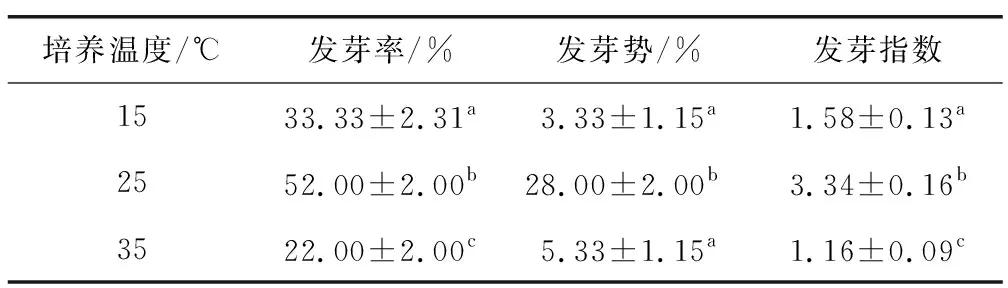
表1 培養溫度對耳葉牛皮消種子萌發指標的影響Table 1 Effects of culture temperature on seed germination indexes of Cynanchum auriculatum
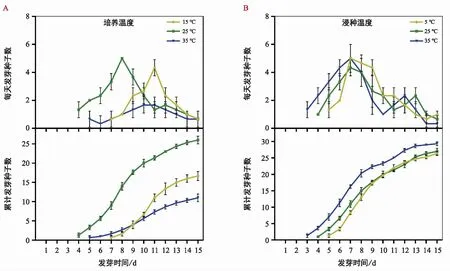
圖2 溫度對耳葉牛皮消種子萌發的影響Fig.2 Effects of temperature on seed germination of Cynanchum auriculatum
2.2.2浸種溫度對種子萌發的影響
在不同溫度下浸種處理后,耳葉牛皮消種子的萌發進程(圖2b)。結果顯示,在5 ℃,25 ℃和35 ℃的浸種條件下,種子起始萌發時間分別為第5天、第4天和第3天;3個浸種溫度下,種子萌發進程中均有較明顯的高峰期。種子萌發相關指標(表2),隨著浸種溫度的升高,種子發芽率、發芽勢和發芽指數均逐漸提高,且35 ℃條件下的種子萌發指標均顯著高于其他兩個溫度處理。以上結果表明,浸種溫度能不同程度地改變耳葉牛皮消種子的萌發進程,其中,35 ℃浸種能顯著促進種子萌發。
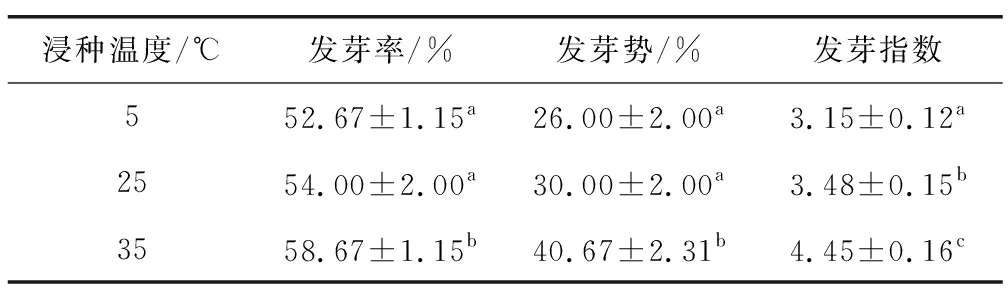
表2 浸種溫度對耳葉牛皮消種子萌發指標的影響Table 2 Effects of soaking temperature on seed germination indexes of Cynanchum auriculatum
2.3 外源激素對耳葉牛皮消種子萌發的影響
不同種類及濃度的外源激素處理下,耳葉牛皮消種子的萌發進程見圖3。與對照相比,3種濃度的GA3處理后,種子萌發的高峰期均更為明顯,且有不同程度的提前;100 mg/L的GA3處理后,種子萌發起始時間比對照提前了1 d,200 mg/L和400 mg/L的GA3處理后,種子萌發起始時間與對照相同,但發芽終止時間明顯提前,由原來的大于等于第15天提前至第12天左右(圖3 a)。50 mg/L的6-BA處理后,種子萌發起始時間不變,萌發高峰期略有提前;100 mg/L的6-BA處理后,種子萌發起始時間提前了1 d,但萌發高峰期顯著推遲;200 mg/L的6-BA處理后,種子萌發起始時間推遲了3 d,萌發高峰期不明顯(圖3 b)。5 mg/L的IAA處理后,種子萌發起始時間不變,但隨著IAA濃度的提高,萌發起始時間逐漸推遲;3種濃度的IAA處理后,種子萌發高峰期均不明顯(圖3 c)。
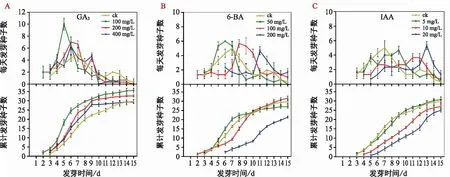
圖3 外源激素對耳葉牛皮消種子萌發的影響Fig.3 Effects of exogenous hormones on seed germination of Cynanchum auriculatum
如表3所示,GA3和IAA處理組,種子的發芽率、發芽勢和發芽指數均隨著激素濃度的增加呈下降趨勢。在GA3處理組中,除400 mg/L濃度下的發芽率與對照無顯著差異外,其他濃度下種子的發芽指標均顯著高于對照,當GA3濃度為100 mg/L時,種子的發芽率、發芽勢和發芽指數分別較對照提高了20.2%、48.3%和57.3%。在IAA處理組中,5 mg/L濃度下種子的發芽率和發芽指數與對照無顯著差異,發芽勢顯著低于對照,10 mg/L和20 mg/L濃度下種子的發芽指標均顯著低于對照。在6-BA處理組中,種子的發芽率和發芽指數均隨著6-BA濃度增加呈先上升后下降的趨勢,種子的發芽勢隨著激素濃度增加呈下降趨勢;當6-BA濃度為100 mg/L時,種子的發芽率顯著高于對照,但發芽指數與對照無顯著差異,發芽勢顯著低于對照。以上結果表明,外源GA3能顯著促進耳葉牛皮消種子萌發,且當GA3濃度為100 mg/L時,種子萌發效果最佳。
2.4 外源化學試劑對耳葉牛皮消種子萌發的影響
不同種類及濃度的化學試劑處理下,耳葉牛皮消種子的萌發進程見圖4,與對照相比,CaCl2處理對種子萌發進程無顯著影響,種子萌發起始時間與對照相同,均為第3天;種子萌發高峰期較明顯,0.5 g/L和2 g/L濃度下萌發高峰期較對照提前了1 d,1 g/L濃度下萌發高峰期與對照相同(圖4 a)。當KNO3濃度為6 g/L時,種子萌發起始時間較對照提前了1 d,萌發高峰期與對照相似;當KNO3濃度為2 g/L和4 g/L時,種子萌發起始時間與對照相同,2 g/L濃度下萌發高峰期較對照提前了1 d,4 g/L濃度下萌發高峰期不明顯(圖4 b)。NaCl處理對種子萌發進程有顯著影響,3種濃度下種子萌發起始時間均較對照提前了1 d,種子萌發高峰期均較為明顯,當NaCl濃度為1 g/L時,萌發高峰期較對照提前了3 d(圖4 c)。
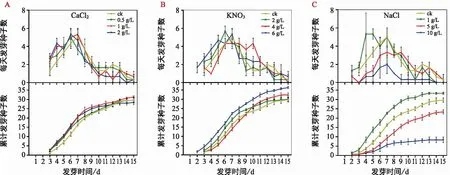
圖4 化學試劑對耳葉牛皮消種子萌發的影響Fig.4 Effects of chemical reagents on seed germination of Cynanchum auriculatum
如表4所示,在CaCl2處理組中,種子的發芽率、發芽勢和發芽指數均隨CaCl2濃度增加呈先上升后下降的趨勢,1 g/L濃度下種子發芽率與對照無顯著差異,發芽勢和發芽指數顯著高于對照。在KNO3處理組中,種子發芽率隨KNO3濃度增加呈上升趨勢,發芽勢和發芽指數隨試劑濃度增加呈先下降后上升的趨勢,當KNO3濃度為6 g/L時,種子的發芽率、發芽勢和發芽指數均顯著高于對照,分別較對照提高了22.5%,25%和44.1%。在NaCl處理組中,種子發芽率、發芽勢和發芽指數均隨NaCl濃度增加呈下降趨勢,其中,1 g/L濃度下種子發芽率、發芽勢和發芽指數均顯著高于對照,分別較對照提高了12.4%,30%和37.4%;但隨著NaCl濃度的增加,種子發芽相關指標下降明顯,5 g/L和10 g/L濃度下,種子發芽率、發芽勢和發芽指數均顯著低于對照。以上結果表明,特定種類及濃度的外源化學試劑浸種能促進耳葉牛皮消種子萌發,其中,6 g/L 的KNO3和1 g/L 的NaCl對耳葉牛皮消種子萌發的促進效果較好。
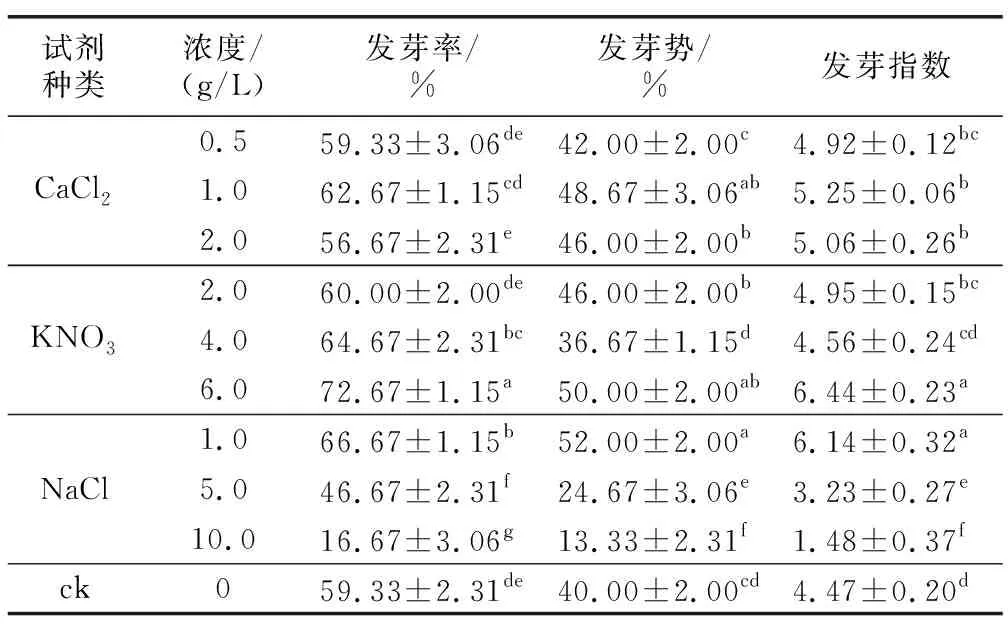
表4 化學試劑對耳葉牛皮消種子萌發指標的影響Table 4 Effects of chemical reagents on seed germination indexes of Cynanchum auriculatum
2.5 激素和化學試劑組合處理對耳葉牛皮消種子萌發的影響
從上述實驗中選取對種子萌發效果較好的特定濃度激素和試劑,包括100 mg/L 的GA3、6 g/L 的KNO3和1 g/L 的NaCl,對耳葉牛皮消種子進行組合處理,統計分析種子萌發相關指標。結果顯示,各個組合處理下種子萌發起始時間和萌發高峰期均明顯早于對照組(圖5),種子發芽率、發芽勢和發芽指數均顯著高于對照組(表5);各個組合處理之間也存在一定差異,綜合比較顯示,GA3+KNO3+NaCl組合處理下,種子萌發效果最佳。該組合處理與對照相比,種子萌發起始時間和萌發高峰期均提前了2 d;種子發芽勢由39.33%升高至62%,提高了57.6%;發芽率由58.67%升高至79.33%,提高了35.2%;發芽指數由4.43升高至8.62,提高了94.6%;發芽周期由原來的15 d以上縮短至12 d左右。
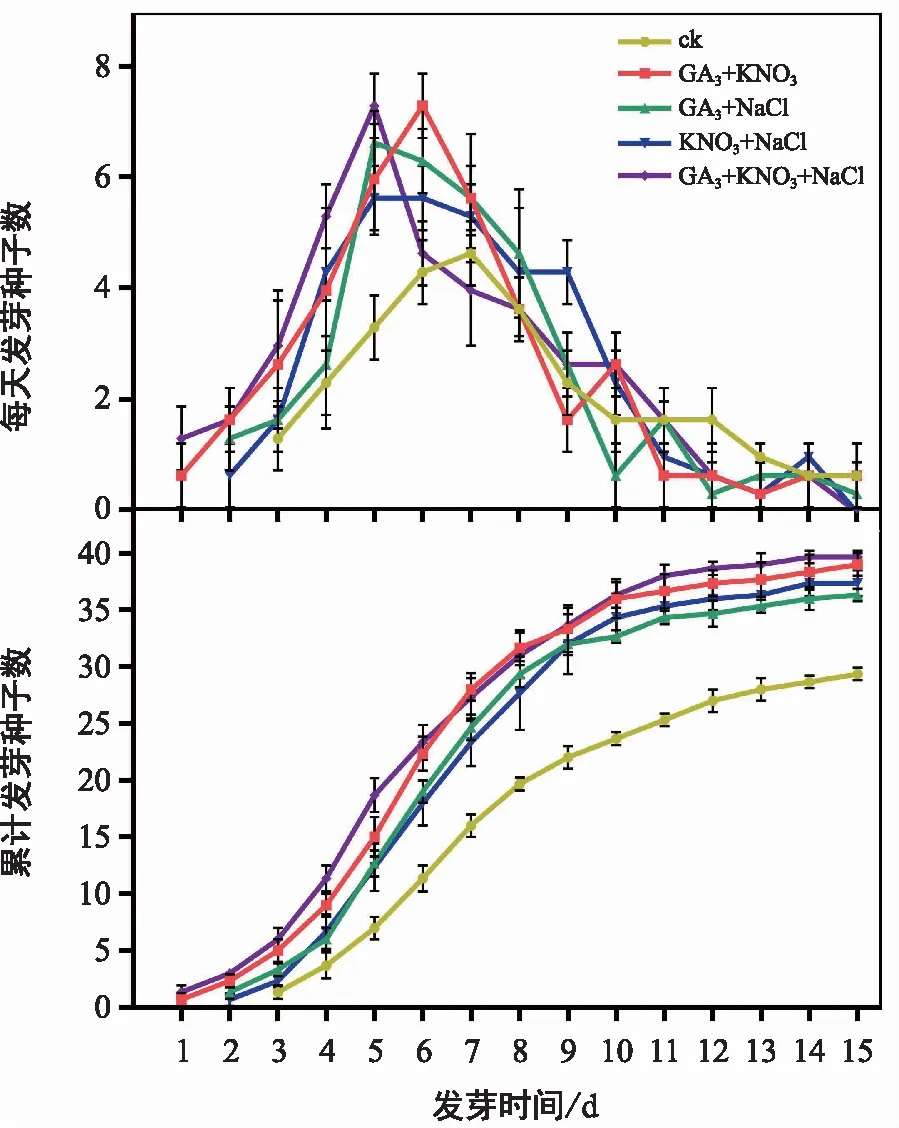
圖5 激素和化學試劑組合處理對耳葉牛皮消種子萌發的影響Fig.5 Effects of combined treatment with hormone and chemical reagents on seed germination of Cynanchum auriculatum
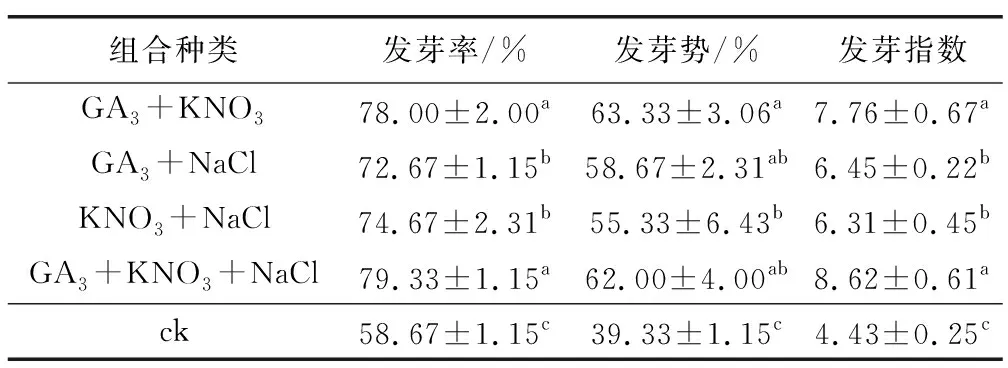
表5 激素和化學試劑組合處理對耳葉牛皮消種子萌發指標的影響Table 5 Effects of combined treatment with hormone and chemical reagents on seed germination indexes of Cynanchum auriculatum
3 討 論
在實際栽培種植中,由于耳葉牛皮消種子萌發比較緩慢,出苗整齊度欠佳且幼苗較瘦弱,因此較少采用播種的方式進行種植。但種子繁殖是優良種性保持和種質資源保護的必要手段,優化種子萌發條件進而提高種子萌發活力對耳葉牛皮消的良種繁育和產業發展具有重要意義。
溫度是影響植物種子萌發的關鍵環境因子之一,本研究發現,不同培養溫度對耳葉牛皮消種子萌發的影響存在顯著差異,25 ℃下種子的發芽率、發芽勢和發芽指數均顯著高于15 ℃和35 ℃,表明耳葉牛皮消種子在萌發階段對溫度較敏感,過低或過高的溫度均不利于其萌發。這與耳葉牛皮消實際栽培中的播種條件較一致,江蘇濱海地區一般于每年4上中旬播種[10,14],此時環境溫度為20~25 ℃,是耳葉牛皮消種子的最佳萌發溫度。
浸種是生產中常用的種子催芽處理方法,溫度是影響浸種效果的關鍵因素之一,不同植物種子的最適浸種溫度不同。本研究結果表明,35 ℃浸種處理下耳葉牛皮消種子的萌發起始時間提早了1 d,種子發芽率、發芽勢和發芽指數均顯著高于5 ℃和25 ℃浸種,這與李玉石等[15]對泰山白首烏(戟葉牛皮消)繁育技術的報道一致。推測溫水浸種能軟化耳葉牛皮消種皮,增加其通透性,進而激活胚細胞活性,達到促進發芽的效果。
植物激素在種子萌發階段發揮了重要的調控作用,外源施加植物生長調節劑能有效干預種子的萌發。本研究發現,不同種類的外源激素對耳葉牛皮消種子萌發的影響差異較大。GA3能顯著促進耳葉牛皮消種子萌發,且100 mg/L的GA3對種子萌發的促進效果最佳,隨著GA3濃度的升高,種子的發芽率、發芽勢和發芽指數均呈下降趨勢。植物內源赤霉素在種子萌發階段能打破休眠,促進種子萌發[16]。本研究中外源施加的GA3能透過種皮進入種子內部,與內源激素協同促進耳葉牛皮消種子萌發,但外源GA3濃度不宜過高,否則可能擾亂種子內源激素動態平衡,抑制種子萌發。外源低濃度6-BA和IAA也能促進耳葉牛皮消種子萌發,但整體上不顯著,隨著處理濃度的升高,種子發芽指標顯著降低,種子萌發受到抑制。這與何首烏[17]、多葉棘豆[18]、冰菜[19]和九龍山杜鵑[20]等植物種子萌發的研究結果相似,推測高濃度6-BA和IAA可能誘導細胞產生了抑制種子萌發的代謝產物(如乙烯),或是抑制了一些能促進種子萌發的酶的合成。
一定種類及濃度的化學試劑對耳葉牛皮消種子的萌發具有顯著改善作用。本研究中使用的耳葉牛皮消種子采自江蘇省濱海縣近海灘涂地區,具有一定的耐鹽性,吳承東等[21]研究發現,當NaCl濃度低于0.4%時,耳葉牛皮消種子的發芽指數和活力指數等指標與對照相比無顯著差異,表明耳葉牛皮消種子萌發過程對鹽脅迫有一定的耐受性。本研究發現,NaCl濃度為1 g/L時,耳葉牛皮消種子的發芽率、發芽勢和發芽指數均顯著高于對照,而當NaCl濃度高于5 g/L時,種子萌發受到了顯著抑制,表明低濃度NaCl處理能促進耳葉牛皮消種子萌發,高濃度NaCl處理會對種子萌發形成脅迫。KNO3對耳葉牛皮消種子萌發的改善效果優于NaCl處理,本研究中2~6 g/L的KNO3處理均不同程度地促進了耳葉牛皮消種子萌發,其中,6 g/L的KNO3處理時,種子萌發效果最好。KNO3是使用較多的一種改善植物種子萌發的化學試劑,K+是植物細胞內多種酶的激活劑,同時還能誘導多種植物內源激素的合成并調控其活性[22],對植物種子萌發具有促進作用,這在曼陀羅[23]、甜椒[24]和燕麥[25]等多種植物種子萌發的研究中得到了證實。
本研究還發現,與單一因素處理相比,不同外源物質組合處理能進一步提升耳葉牛皮消種子萌發效果。100 mg/L GA3+6 g/L KNO3+1 g/L NaCl組合處理下,耳葉牛皮消種子萌發效果最佳,種子發芽率、發芽勢和發芽指數分別較對照提高了35.2%,57.6%和94.6%,同時還縮短了發芽周期,提高了種子發芽整齊度。

