電針對阿爾茨海默病不同病理階段自噬狀態(tài)影響差異性研究
楊曉坤,高譽珊,栗晨璐,陳浩天,郭孟瑋,譚韻湘,張洋,薛衛(wèi)國
(北京中醫(yī)藥大學,北京 100029)
阿爾茨海默病(Alzheimer's disease, AD)是一種以漸進性認知功能衰退為主要臨床表現(xiàn)的神經(jīng)系統(tǒng)退行性疾病。其特征性病理改變主要是β-淀粉樣蛋白(β-amyloid, Aβ)聚集形成的老年斑和Tau 蛋白過度磷酸化形成的細胞內神經(jīng)原纖維纏結[1]。
Aβ級聯(lián)假說認為腦內Aβ聚集是AD 形成和發(fā)展的關鍵因素,AD 的主要病理過程是由于Aβ的生成和清除失衡[2-3]。AD 發(fā)病機制具有多樣性,單一Aβ級聯(lián)假說并不能完美解釋AD 發(fā)病機制。近年自噬功能紊亂學說已成為AD 發(fā)病機制及治療靶點研究的熱點[4-6]。細胞內包括Aβ在內的錯誤聚集的蛋白質通過自噬-溶酶體系統(tǒng)降解。自噬的動態(tài)過程分為自噬啟動、自噬體形成、自噬體溶酶體融合和蛋白降解[7]。自噬在Aβ代謝中具有二重性[8],自噬-溶酶體途徑可以降解Aβ;當自噬功能低下時,會使細胞內Aβ不能被有效降解;尤其當自噬體與溶酶體融合及降解受阻時,Aβ不但不能被有效降解,反而會因自噬泡的堆積而劇增。
PP/PS1 雙轉基因小鼠具有腦內Aβ水平升高、聚集、沉積和自噬功能紊亂兩種病理特征。老年斑是AD的主要病理特征,研究[9-10]表明AD 早期4~5 月齡該小鼠腦內可溶性Aβ水平開始升高,但未出現(xiàn)老年斑,行為學未出現(xiàn)異常;病理期6~8 月齡腦內可溶性Aβ大量聚集、沉積形成老年斑,行為學開始出現(xiàn)異常。故以腦內老年斑出現(xiàn)與否和行為學是否異常將AD 區(qū)分為不同病理階段。
AD 不同病理階段存在不同的自噬功能紊亂機制[11]。自噬啟動時,LC3Ⅰ轉化為LC3Ⅱ并定位于自噬體膜上,隨自噬體降解而減少,LC3Ⅱ/Ⅰ比值提示自噬體的數(shù)量及堆積程度[12];自噬流是否通暢是自噬底物是否最終被降解的評價指標。當通暢時,自噬特異性底物p62 會隨自噬的進行被不斷降解,p62 表達提示自噬流是否順暢[13-14]。從自噬流角度,以LC3Ⅱ/Ⅰ比值和p62 共同評價自噬狀態(tài)的高低。研究[15-17]顯示,針刺對自噬啟動、自噬體與自噬溶酶體融合和自噬溶酶體降解都可能存在影響。有研究[18]表明,針刺可降低10 月齡SAMP8 小鼠LC3Ⅱ/Ⅰ比值;也有研究[19]發(fā)現(xiàn),針刺可提高6 月齡雙轉基因鼠海馬LC3Ⅱ/Ⅰ比值。針刺調節(jié)AD 小鼠自噬相關蛋白LC3Ⅱ/Ⅰ比值的不同是否與其自噬狀態(tài)不同有關。因此,本研究提出針刺是否對AD不同病理階段自噬狀態(tài)的調控具有差異性的假說。
本實驗以4 月齡和8 月齡APP/PS1 雙轉基因小鼠為動物模型,電針百會和涌泉穴,觀察電針對AD 不同病理階段自噬相關蛋白LC3和p62的影響,探討電針對AD 不同病理階段自噬狀態(tài)的調控及其調控機制是否具有差異性。
1 材料與方法
1.1 實驗動物與分組
4 月齡和8 月齡APP/PS1 雙轉基因雄性小鼠各20 只,購于北京華阜康生物科技股份有限公司(No.110324211101570363,No.110324211105773138),動物生產(chǎn)許可證為SCXK(京)2019-0008,體質量分別為(20±6)g 和(26±6)g;同月齡同性別C57BL/6 野生型小鼠各10 只,購于北京斯貝福生物科技有限公司,動物生產(chǎn)許可證為SCXK(京)2019-0010,體質量分別為(24±4)g 和(28±4)g。以隨機數(shù)字表法將其分為模型組和電針組,即4 月齡模型組和電針組,8 月齡模型組和電針組,每組10 只;以同月齡同性別C57BL/6野生型小鼠為正常組,即4 月齡正常組和8 月齡正常組。上述小鼠飼養(yǎng)于北京中醫(yī)藥大學動物中心,室溫20~22 ℃,濕度40%~60%,自然光照,自由進食和進水。本實驗經(jīng)北京中醫(yī)藥大學實驗動物倫理委員會批準(動物倫理批準號BUCM-4-2021052406-2041)。
1.2 主要儀器與試劑
一次性針灸針(北京中研太和醫(yī)藥公司,規(guī)格0.25 mm×13 mm),LH202H 型韓氏電針儀(北京華衛(wèi)產(chǎn)業(yè)開發(fā)公司),冰凍切片機(德國,Leica),酶標儀、電泳儀、 垂直電泳槽、 轉膜儀、 曝光機( 美國,Bio-Rad),ImageJ 圖像分析處理系統(tǒng)(美國NIH)。
兔源LC3 抗體(proteintech 14600-1-AP),兔源p62 抗體(proteintech, 18420-1-AP),鼠源GAPDH 抗體(proteintech, 60004-1),山羊抗鼠(proteintech,60004-1),山羊抗兔(proteintech, SA00001-2);鼠源Aβ一抗(Covance-SIG-39320),即用型免疫組化超敏S-P 試劑盒(鼠)(邁新,KIT-9701),DAB 顯色試劑盒(邁新,DAB-0031),兔源LC3熒光一抗(abcam, ab192890),鼠源Aβ熒光一抗(Covance-SIG-39320),鼠源辣根過氧化物標記生物素(北京中杉金橋,ZB-2305),羊源辣根過氧化物標記生物素(proteintech, SA00001-2),羊抗鼠熒光二抗(美國,Abcam, ab150115),羊抗兔熒光二抗(美國,Abcam, ab150077),熒光封片劑(含DAPI)(中杉金橋,ZLI-9557);Aβ42 酶聯(lián)免疫吸附法試劑盒(美國,invitrogen, KHB3544),BCA 蛋白定量試劑盒(北京普利萊有限公司)。
1.3 干預方法
將電針組小鼠以自制鼠袋固定于操作臺上,按照小鼠針灸穴位圖譜及比較解剖學方法,在頂骨正中取百會穴,在兩足底前、中1/3 交界處取雙側涌泉穴。穴位常規(guī)消毒,百會用毫針向前平刺2~3 mm 后單向滯針并留針;雙側涌泉直刺后接電針儀,疏密波,頻率1/50 Hz,電流強度1.0 mA,以針柄震顫且動物保持安靜不掙扎嘶叫為度,干預持續(xù)20 min。正常組和模型組小鼠以相同方法和時間束縛20 min。隔日1 次,連續(xù)6 周。
1.4 Morris 水迷宮實驗
干預結束后進行5 d Morris 水迷宮實驗,檢測各組小鼠空間學習記憶能力。水迷宮水池等距離劃分4 個象限,定位航行平臺置于第4 象限內。水池倒入溫水并用脫脂奶粉混勻,水溫22~23 ℃,隱藏平臺,由圖像采集系統(tǒng)記錄小鼠游泳情況及運動軌跡。實驗前1 d 進行適應性訓練。實驗前4 d 進行定位航行實驗,將小鼠依次從第2、3、1 象限面朝池壁放入水池并開始計時,記錄小鼠找到平臺的時間,即逃避潛伏期。若小鼠60 s 內未找到平臺,引導小鼠至平臺上并停留15 s,記錄小鼠找到平臺時間為60 s。以第2 象限放入水池的逃避潛伏期作為檢測指標。實驗第5 天進行空間探索實驗,撤掉平臺,從第2 象限將小鼠面朝池壁放入,記錄小鼠60 s 內平臺象限停留時間。
1.5 取材方法
4 月齡和8 月齡APP/PS1 雙轉鼠隨機每組選取4 只,以2%戊巴比妥鈉[按50 mg/(kg·bw)劑量]腹腔注射深度麻醉,4%多聚甲醛心臟灌注固定后取出全腦,4%多聚甲醛溶液固定72 h,梯度蔗糖脫水、修塊、包埋,﹣80 ℃保存,用于免疫組化和免疫熒光實驗。4 月齡和8 月齡每組剩余6 只小鼠深度麻醉,冰盒上斷頭取腦,剝離海馬及腦皮質放入EP 管中,﹣80 ℃保存,用于Western blot 及酶聯(lián)免疫吸附法檢測。
1.6 觀察指標
1.6.1 免疫組化技術觀察海馬淀粉樣斑塊沉積情況
視交叉后冠狀位連續(xù)冰凍切片,片厚10 μm。第1 天,冰凍切片復溫30 min; PBS 洗,枸櫞酸鹽緩沖液熱修復15 min; PBS 洗,山羊血清封閉10 min;甩掉封閉液,加入Aβ一抗,4 ℃孵育過夜。次日, PBS 洗,二抗(試劑2)孵育10 min; PBS 洗,試劑3 孵育10 min;PBS 洗, DAB 顯色10 min 鏡下觀察情況;自來水沖洗;脫水,透明,封片。顯微鏡下觀察表達情況并拍照。
1.6.2 免疫熒光技術觀察海馬及皮質內LC3 及Aβ的表達部位
第1 天,除一抗(Aβ和LC3 等體積混勻)外,其余步驟同上。次日,PBS 洗,熒光二抗(鼠源二抗和兔源二抗等體積混勻)避光孵育1 h; PBS 洗;DAPI 封片,熒光顯微鏡下觀察陽性表達情況并拍照。
1.6.3 Western blot 檢測小鼠海馬LC3 與p62 蛋白的相對表達量
稱取小鼠左側海馬組織于試管中,加RIPA 裂解液和 PMSF(RIPA:PMSF =100:1),超聲儀研磨勻漿,4 ℃,12 000 r/min,離心20 min,取上清液,BCA 法測定蛋白濃度。每孔上樣量20 μg,分離電泳、轉膜、快速封閉20 min,TBST洗,裁膜,一抗(LC3為1:6 000,p62為1:4 000,GAPDH 為1:100 000)4 ℃孵育過夜;TBST洗,二抗(羊抗兔為1:5 000,羊抗鼠為1:5 000)孵育1 h, TBST 洗;滴加ECL 發(fā)光液顯色,曝光顯影。ImageJ 軟件分析各條帶灰度值,以GAPDH 的灰度值為基線計算各目標條帶相對表達量。
1.6.4 酶聯(lián)免疫吸附法檢測小鼠海馬Aβ濃度
取6 月齡和10 月齡每組右側海馬于EP 管中,按說明書加入PBS 裂解液,冰上勻漿;以16 000 r/min 速度和4 ℃環(huán)境,離心20 min 后取上清液。據(jù)預實驗結果,以正常組不稀釋、模型組稀釋20 倍、電針組稀釋10 倍為最佳稀釋倍數(shù),按所需加入上清液標準稀釋液。按照說明書流程連續(xù)稀釋標準品;檢測板加入50 μL 標準品,顯色空白孔留空;除空白孔外,每孔加50 μL 檢測抗體溶液并覆蓋平板,4 ℃過夜;洗板4 次,加100 μL 二抗(顯色空白孔除外),膜封板,室溫孵育30 min;洗板4 次,加100 μL 穩(wěn)定色原,混勻后溶液變藍,覆蓋平板,避光孵育30 min;加100 μL 終止液。操作過程嚴格按照說明書中步驟。用酶標儀在450 nm波長下測定吸光度值,繪制蛋白標準品的曲線,根據(jù)方程式計算Aβ42 的濃度。
1.7 統(tǒng)計學分析
采用SPSS20.0 統(tǒng)計軟件統(tǒng)計分析。當計量資料符合正態(tài)分布時,采用均數(shù)±標準差表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD 檢驗;重復測量數(shù)據(jù)采用重復測量方差分析,組間比較采用單因素方差分析;若出現(xiàn)計量資料為非正態(tài)分布,數(shù)據(jù)比較則采用非參數(shù)檢驗。以P<0.05 表示差異具有統(tǒng)計學意義。
2 結果
2.1 各組不同月齡小鼠Morris 水迷宮結果比較
與同月齡正常組比較,6 月齡和10 月齡模型組小鼠Morris 水迷宮定位航行實驗逃避潛伏期均增加(P<0.01);與同月齡模型組比較,6 月齡和10 月齡電針組小鼠逃避潛伏期均減少(P<0.01)。詳見圖1。

圖1 各組不同月齡小鼠Morris 水迷宮定位航行實驗逃避潛伏期比較(±s, n=10)
與6 月齡模型組小鼠比較,10 月齡模型組小鼠平均逃避潛伏期延長,差異具有統(tǒng)計學意義(P<0.05)。詳見圖2。
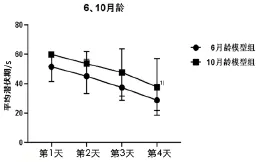
圖2 6 月齡和10 月齡模型組小鼠Morris 水迷宮定位航行實驗逃避潛伏期比較( ±s, n=10)
正常組比較,同月齡模型組Morris 水迷宮空間探索實驗平臺象限停留時間均減少(P<0.01);與模型組比較,同月齡電針組平臺象限停留時間均延長(P<0.01)。詳見圖3。
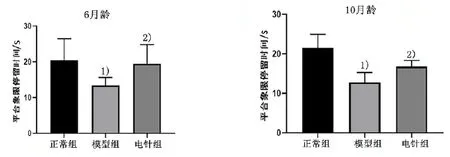
圖3 6 月齡和10 月齡模型組小鼠Morris 水迷宮空間探索實驗平臺象限停留時間比較(±s, n=10)
2.2 各月齡小鼠淀粉樣斑塊沉積情況比較
6 月齡和10 月齡模型組海馬均可見褐色團塊狀淀粉樣斑塊沉積(如圖4 箭頭所指),10 月齡模型組褐色團塊狀淀粉樣斑塊沉積(老年斑)明顯更多且密集;經(jīng)電針治療后,6 月齡和10 月齡電針組小鼠海馬區(qū)褐色團狀塊淀粉樣斑塊沉積均有所減少。詳見圖4。
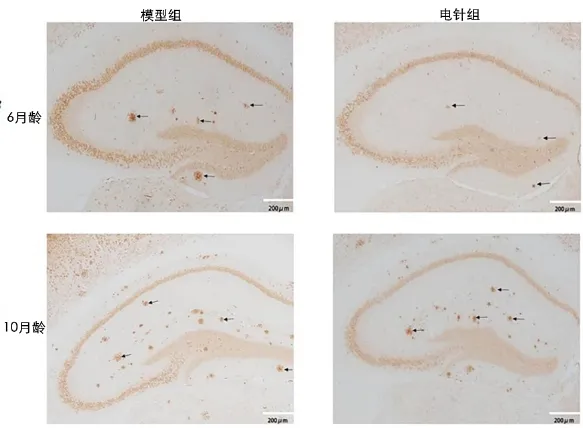
圖4 6 月齡和10 月齡小鼠淀粉樣斑塊沉積情況比較(×40)
2.3 各組小鼠LC3 和Aβ免疫熒光表達情況比較
DAPI 細胞核標記為藍色,LC3 標記為綠色熒光,主要表達在海馬CA1 區(qū)核周(細胞質)與軸突中;Aβ標記為紅色熒光,主要聚集在海馬CA1 區(qū)的核周(細胞質),如圖5 虛箭頭所指;橘黃色區(qū)域為共表達區(qū)域,如圖5實箭頭所示,二者存在共表達情況。詳見圖5。
2.4 各組小鼠海馬酶聯(lián)免疫吸附法檢測Aβ濃度比較
與正常組比較,同月齡模型組腦內Aβ濃度均升高(P<0.01);與模型組比較,同月齡電針組腦內Aβ濃度均降低(P<0.01);6 月齡模型組小鼠腦內Aβ濃度明顯低于10 月齡模型組(P<0.01)。詳見表1。
表1 各組小鼠海馬ELISA 檢測Aβ濃度比較(±s)單位:pg·g﹣1
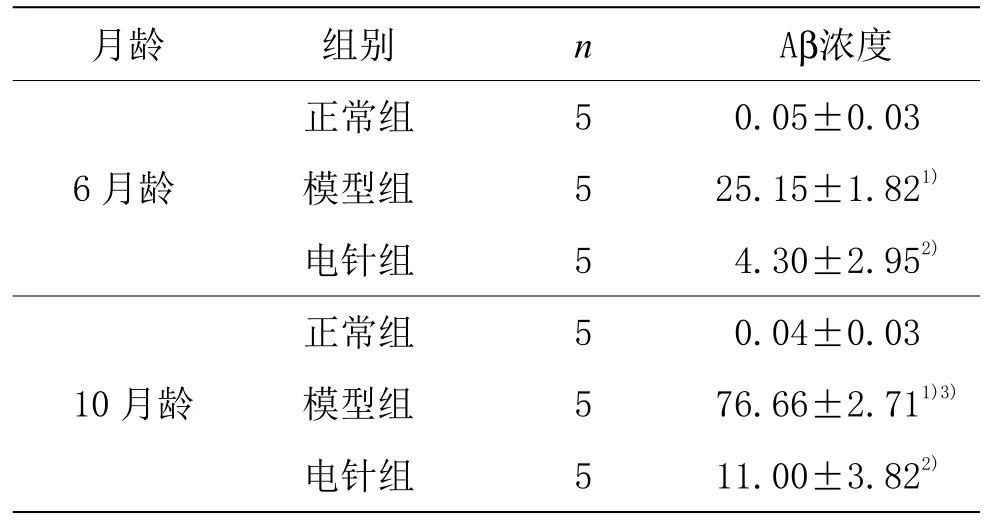
表1 各組小鼠海馬ELISA 檢測Aβ濃度比較(±s)單位:pg·g﹣1
注:與同月齡正常組比較1)P<0.01;與同月齡模型組比較2)P<0.01;與6 月齡模型組比較3)P<0.01。
月齡 組別 n Aβ濃度6 月齡正常組 5 0.05±0.03模型組 5 25.15±1.821)電針組 5 4.30±2.952)10 月齡正常組 5 0.04±0.03模型組 5 76.66±2.711)3)電針組 5 11.00±3.822)
2.5 各組小鼠海馬自噬相關蛋白Western blot 檢測結果比較
與同月齡正常組比較,6 月齡模型組LC3Ⅱ/Ⅰ比值和p62 表達降低(P<0.01),10 月齡模型組LC3Ⅱ/Ⅰ比值和p62 表達升高(P<0.01,P<0.05)。與同月齡模型組比較,6 月齡電針組 LC3 Ⅱ/Ⅰ比值增加(P<0.01),p62 表達降低但差異無統(tǒng)計學意義(P>0.05),10月齡電針組LC3Ⅱ/Ⅰ比值和p62表達均降低(P<0.01,P<0.05)。與6 月齡模型組比較,10 月齡模型組LC3Ⅱ/Ⅰ表達量增高(P<0.01),p62 表達量明顯增加(P<0.01)。詳見圖6、圖7 和表2。
表2 各組小鼠海馬LC3Ⅱ/Ⅰ和p62/GA 比值表達情況(±s)
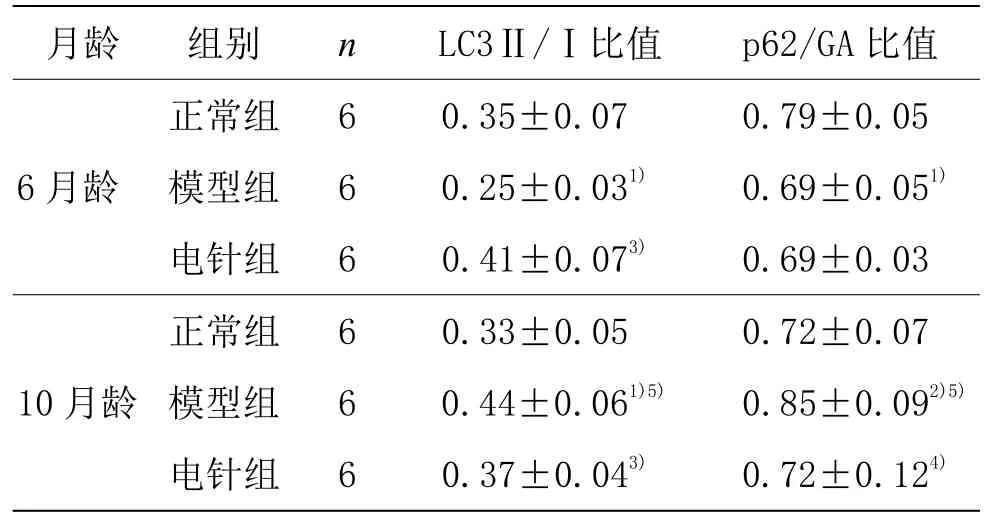
表2 各組小鼠海馬LC3Ⅱ/Ⅰ和p62/GA 比值表達情況(±s)
注:與同月齡正常組比較1)P<0.01,2)P<0.05;與同月齡模型組比較3)P<0.01,4)P<0.05;與6 月齡模型組比較5)P<0.01。
月齡 組別 n LC3Ⅱ/Ⅰ比值 p62/GA 比值6 月齡正常組 6 0.35±0.07 0.79±0.05模型組 6 0.25±0.031) 0.69±0.051)電針組 6 0.41±0.073) 0.69±0.03 10 月齡正常組 6 0.33±0.05 0.72±0.07模型組 6 0.44±0.061)5) 0.85±0.092)5)電針組 6 0.37±0.043) 0.72±0.124)

圖6 6 月齡各組小鼠海馬LC3Ⅱ/Ⅰ比值和p62 表達情況比較

圖7 10 月齡各組小鼠海馬LC3Ⅱ/Ⅰ比值和p62 表達情況比較
3 討論
β-淀粉樣蛋白(Aβ)大量聚集、沉積形成的老年斑是阿爾茲海默病(AD)主要病理特征。Aβ級聯(lián)假說是目前最為公認的AD 發(fā)病機制,細胞內可溶性Aβ寡聚體具有神經(jīng)毒性,會造成突觸功能障礙、神經(jīng)元丟失等一系列級聯(lián)反應,導致嚴重的記憶損壞[20]。自噬功能紊亂被認為是細胞內Aβ產(chǎn)生、聚集的主要原因;當自噬功能出現(xiàn)障礙時,會對Aβ的聚集創(chuàng)造條件[21]。通常認為,AD不同病理階段的自噬狀態(tài)不同。研究[22-23]發(fā)現(xiàn)AD 早期患者腦內自噬啟動相關蛋白表達量下降,提示自噬水平處于低下狀態(tài);隨病情發(fā)展,AD 患者及APP/PS1 轉基因小鼠腦內存在自噬體轉運及降解功能障礙,神經(jīng)元及突起中大量自噬泡堆積,自噬-溶酶體途徑功能紊亂是AD 疾病進程晚期的重要病理機制。
APP/PS1 雙轉基因小鼠是國際公認的影響Aβ水平及其機制研究的動物模型;隨月齡增加,腦內大量Aβ不斷地聚集、沉積形成老年斑,并伴隨突觸丟失和神經(jīng)元變性等是研究AD 較好模型[24]。同時該模型小鼠腦內存在細胞內自噬功能紊亂,營養(yǎng)不良性神經(jīng)突起內有大量自噬泡堆積,神經(jīng)元核周存在大量自噬溶酶體,也是研究AD 自噬功能紊亂的理想模型。本研究發(fā)現(xiàn)此模型小鼠6月齡和10月齡的病理特征及自噬狀態(tài)存在明顯區(qū)別。本實驗使用的6E10 Aβ抗體只能識別人來源的APP片段,故在免疫組化實驗中APP/PS1雙轉基因小鼠腦內可見其陽性表達;而正常組C57BL/6 小鼠中無人來源的APP 片段,故正常組小鼠腦中無陽性表達。與正常組比較,6 月齡APP/PS1 雙轉基因模型小鼠空間學習記憶能力下降,腦內可溶性Aβ濃度升高,海馬可見少量老年斑,自噬相關蛋白LC3Ⅱ/Ⅰ比值和p62 水平均偏低,說明其自噬功能低下,與此研究大致相同[12]。10 月齡模型小鼠空間學習記憶能力下降更為明顯,腦內 Aβ 水平越來越高且已形成大量老年斑,LC3Ⅱ/Ⅰ比值和p62 水平均偏高,說明模型小鼠自噬功能紊亂,自噬泡出現(xiàn)堆積,自噬流處于不通暢狀態(tài)。
眾多研究[25-27]表明,針刺能夠改善APP/PS1雙轉基因小鼠空間學習記憶能力,降低腦內Aβ水平。本課題組前期研究也顯示[28-29],針刺百會和涌泉穴可以有效降低腦內Aβ水平,同時發(fā)現(xiàn)了針刺對自噬狀態(tài)的影響。針刺治療AD 可能具有雙向調節(jié)作用,對AD 老年斑形成前后不同病理階段的不同自噬狀態(tài)都會產(chǎn)生一定的良性調節(jié)作用。以往的相關研究大多數(shù)是以單個月齡AD 模型小鼠為實驗對象,觀察針刺對該月齡模型鼠自噬水平的影響。由于AD 是一種起病隱匿的進行性發(fā)展的神經(jīng)系統(tǒng)退行性疾病,故本研究基于Aβ級聯(lián)假說和自噬功能紊亂假說,以AD 病理早期4 月齡和病理期8月齡APP/PS1雙轉基因鼠為動物模型,觀察電針百會和涌泉穴干預4 月齡和8 月齡雙轉基因小鼠6 周對Morris 空間學習記憶能力、腦內可溶性Aβ水平及自噬狀態(tài)的影響,探討AD 不同病理階段的自噬狀態(tài)以及電針對其自噬狀態(tài)的調控及其調控機制是否具有差異性,以闡釋電針改善AD 不同病理階段學習記憶能力機制的不同。
本次實驗水迷宮結果顯示,6 月齡和10 月齡電針組逃避潛伏期和平臺象限停留時間均優(yōu)于模型組,提示電針可以改善老年斑形成前后不同病理階段AD 模型鼠的學習記憶能力。但由于其AD 病理狀態(tài)不同,電針改善學習記憶能力的機制可能不同。酶聯(lián)免疫吸附法檢測結果顯示,6 月齡和10 月齡電針組腦內可溶性Aβ濃度均低于模型組,提示兩組電針干預都可以降低其腦內Aβ水平。Western blot 檢測結果顯示,與同月齡模型組 LC3 Ⅱ/Ⅰ比值降低不同,6 月齡電針組LC3Ⅱ/Ⅰ比值升高,p62 表達無明顯變化,說明電針能夠促進6 月齡雙轉鼠自噬體的形成,增強自噬狀態(tài),此結果與以往針刺增強AD 自噬狀態(tài)的研究結果相仿[19,30-31];而與同月齡模型組LC3Ⅱ/Ⅰ比值升高及p62表達升高不同,10 月齡電針組LC3Ⅱ/Ⅰ比值和p62 表達均降低,說明電針能夠減少10 月齡雙轉鼠自噬體的異常堆積,調節(jié)自噬功能紊亂,使自噬流通暢,此結果與以往針刺抑制AD 自噬狀態(tài)的研究結果相仿[15,28]。本實驗結果使以往AD 針刺研究中所出現(xiàn)的對自噬狀態(tài)調節(jié)的不同結果得到較好的解釋。由于AD 不同病理階段腦內Aβ水平及自噬狀態(tài)不同,針刺對AD 自噬狀態(tài)有良性調節(jié)作用。6 月齡雙轉基因鼠腦內Aβ水平剛開始升高,自噬狀態(tài)不足,電針可增強6 月齡雙轉基因鼠海馬自噬功能,提升對Aβ的清除能力;10 月齡模型鼠腦內自噬體出現(xiàn)異常堆積,自噬流不通暢,腦內Aβ大量生成,電針可調節(jié)10 月齡雙轉基因鼠自噬功能紊亂狀態(tài),降低腦內Aβ水平。因此,通過實驗,本研究可認為AD 不同病理階段的自噬狀態(tài)不同,電針降低其腦內Aβ水平,增強其學習記憶能力的機制存在差異性。
由于Aβ的種類多樣性及其復雜性,再加上自噬流狀態(tài)評估的整體性,本實驗僅通過可溶性Aβ1-42 的酶聯(lián)免疫吸附法檢測Aβ水平。以LC3 和p62 的Western blot 檢測自噬流,存在一定的局限性。對于6 月齡APP/PS1 雙轉鼠腦內自噬水平是否低下,還需要運用多種自噬檢測方法進行研究。電針干預自噬的生物學機制尚待進一步探討。

