鳶尾素在運動改善去勢大鼠骨質(zhì)疏松中的作用研究
胡麗萍,曹 夏,謝菊英,肖 麗
(湘南學院康復學院,湖南 郴州 423000)
骨質(zhì)疏松癥(osteoporosis,OP)是一種全身性骨病,典型特征為骨量低下、骨微結構損壞,從而易發(fā)生骨折。目前,我國約有2億人處于低骨量狀態(tài)[1],60歲及以上人群OP患病率為36%,隨著我國人口老齡化的日趨嚴重,OP已成為威脅中老年人健康的重要公共問題[2]。運動作為一種重要的非藥物治療手段,能提高肌肉力量和改善平衡,在OP的預防中公認應作為首選。Irisin是骨骼肌對運動的應答而產(chǎn)生的激素類的運動因子,是一種由骨骼肌分泌的Ⅲ型纖連蛋白[3]。OP作為骨代謝異常疾病,與irisin密切相關[4]。研究表明,骨骼肌中irisin的前體物質(zhì)FNDC5的表達在經(jīng)過長期耐力運動后顯著提高[3]。10周耐力訓練后,健康人血液中irisin濃度是不運動人群的2倍[5]。絕經(jīng)女性骨折的發(fā)生率與irisin水平有關[6],而irisin可能通過促進成骨細胞的分化與抑制破骨細胞分化來影響骨代謝。但是,irisin對骨髓間充質(zhì)干細胞(BMSCs)骨向分化的影響及其作用機制尚未明確。因此,本研究探討了運動對去勢SD大鼠骨代謝的影響及irisin調(diào)控骨質(zhì)疏松大鼠BMSCs定向分化的機制。
1 材料與方法
1.1 實驗動物及分組
3月齡健康雌性SD大鼠(清潔級),100只,體重180~200g。(湖南斯萊克景達實驗動物有限公司)。按隨機數(shù)字表法隨機,分為空白組、模型組、假手術組、運動組和模型+irisin注射組,每組各20只。
1.2 實驗試劑及儀器
血清骨堿性磷酸酶(BALP)試劑盒(上海碧云天生物),irisin酶聯(lián)免疫吸附測定試劑盒(上海江萊生物科技有限公司),實時熒光定量 PCR 檢測試劑盒、Trizol裂解液、反轉(zhuǎn)錄試劑盒(TAKARA 公司); CM-1000A-5702R 型低速離心機;小動物骨骼強度儀(安徽正華生物儀器設備有限公司);雙能X骨密度檢測儀(佰泰科技有限公司)。
1.3 模型制備
雌性成年大鼠麻醉采用水合氯醛,0.35mL/100g,腹腔注射。麻醉成功后,將大鼠固定,切開皮膚、肌肉,暴露腹腔,在腎臟下約1cm處見到輸卵管和卵巢,先結扎摘除一側(cè)卵巢,再行對側(cè)卵巢切除,完整摘除后縫合切口。假手術組只摘除少許脂肪組織,其余同手術組。手術當天結束后每只動物皮下注射青霉素抗感染,術后禁食6小時。飼養(yǎng)于SPF級環(huán)境中3個月。三個月后測量大鼠腰椎及股骨的骨密度,并和術前的骨密度值比較,去勢前后BMD差異是否具有統(tǒng)計學意義,以確定骨質(zhì)疏松大鼠模型建立。
1.4 干預方法
空白組:正常SD大鼠,喂飼標準飼料,單籠喂養(yǎng),不做任何治療;模型組(PMOP模型):行雙側(cè)卵巢摘除術造大鼠骨質(zhì)疏松癥模型,喂飼標準飼料,單籠喂養(yǎng),不做任何治療;假手術組:SD大鼠只切除少量腸系膜,保留卵巢,喂飼標準飼料,單籠喂養(yǎng),不做任何治療;運動組(PMOP模型+運動4周):大鼠造模成功后,進行運動訓練,訓練方式:20m/min×1h,5°向上坡度,訓練5天,隨后休息2天,連續(xù)運動4周。模型+irisin注射組:行雙側(cè)卵巢摘除術造大鼠骨質(zhì)疏松癥模型,每天一次irisin肌肉注射,每次100 μg/kg,注射4周;每周注射5天,休息2天,在最后一次注射后24小時處死所有大鼠。
1.5 標本采集與檢測
①腰椎和股骨骨密度(BMD):采用雙能X線骨密度儀測定;②血清irisin、Runx2及OPG指標檢測:采用ELISA法檢測大鼠血清中irisin、Runx2及OPG;③ALP、Runx2、OPG蛋白活性測定:對各組股骨下段行測定采用免疫組織化學染色法,光學顯微鏡下觀察ALP、Runx2及OPG蛋白表達水平。采用Image-pro plus 6.0軟件讀取IOD值進行定量分析;④Rt-PCR檢測成骨分化調(diào)控因子Runx2及成骨活性的特異性標志物OPG的基因表達;⑤骨髓間充質(zhì)干細胞(BMSCs):處死大鼠后, 分離大鼠股骨及脛骨,用完全培養(yǎng)液沖洗骨髓腔,同時收集沖洗液。高轉(zhuǎn)速離心獲取細胞沉淀液,置于5%CO2培養(yǎng)箱內(nèi),傳代培養(yǎng)。第14 d時,將融合生長的細胞以2.5 g/L胰蛋白酶消化傳代。當進行第3~4代細胞傳代時,計算得出BMSCs表達量[7]。用ELISA法檢測OC和PINP含量。
1.6 統(tǒng)計方法
2 結果
2.1 干預后各組大鼠骨密度比較
模型組腰椎、股骨BMD水平低于空白組和假手術組(P<0.05);空白組和假手術組腰椎、股骨BMD水平無統(tǒng)計學差異(P>0.05)。連續(xù)干預4周后,與模型組相比,運動組和模型+irisin注射組腰椎及股骨BMD 均有所提高(P<0.05)。詳見表1。
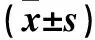
表1 干預后各組大鼠骨密度比較
2.2 干預后各組大鼠血清irisin、Runx2及OPG比較
模型組大鼠血清irisin、Runx2、OPG含量低于空白組和假手術組(P<0.05)。運動組和模型+irisin注射組大鼠血清irisin、Runx2、OPG含量均高于模型組(P<0.05)。運動組和模型+irisin注射組大鼠血清irisin、Runx2、OPG含量無統(tǒng)計學差異(P>0.05)。詳見表2。
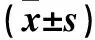
表2 干預后各組大鼠血清irisin、Runx2及OPG比較
2.3 干預后各組大鼠ALP、Runx2及OPG蛋白表達情況
與空白組和假手術組相比,模型組ALP、Runx2、OPG蛋白表達有所降低(P<0.05)。運動組和模型+irisin注射組大鼠ALP、Runx2、OPG蛋白表達均高于模型組(P<0.05)。運動組和模型+irisin注射組大鼠ALP、Runx2、OPG蛋白表達無統(tǒng)計學差異(P>0.05)。詳見表3。
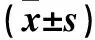
表3 干預后各組大鼠ALP、Runx2及OPG蛋白表達
2.4 干預后各組大鼠Runx2、OPG的基因表達情況
與空白組和假手術組相比,模型組Runx2、OPG mRNA表達水平均降低(P<0.05)。運動組和模型+irisin注射組大鼠Runx2、OPG mRNA表達水平均高于模型組(P<0.05)。運動組和模型+irisin注射組大鼠Runx2、OPG mRNA表達水平無統(tǒng)計學差異(P>0.05)。詳見表4。
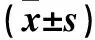
表4 干預后各組大鼠Runx2、OPG mRNA表達
2.5 干預后各組大鼠BMSCs中IC增殖作用情況
與空白組和假手術組相比,模型組BMSCs中OC和PINP有所降低(P<0.05); 運動組和模型+鳶尾素注射組大鼠OC和PINP含量均提高(P<0.05), 運動組和模型+irisin注射組大鼠OC和PINP含量無統(tǒng)計學差異(P>0.05)。詳見表5。
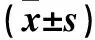
表5 干預后各組大鼠OC、PINP含量比較
3 討論
Bruce等研究發(fā)現(xiàn)irisin是一種新的肌肉因子[3]。作為骨骼肌的使者,irisin傳遞骨骼肌的信號,溝通骨骼肌與外周組織的關系,因而被稱為“運動激素”。研究顯示,irisin能促進Runx2的表達[8],而Runx2是成骨分化的調(diào)控因子。OPG是調(diào)節(jié)骨代謝的關鍵因子,成骨細胞分泌OPG,與RANK競爭性地結合RANKL,抑制破骨前體細胞的分化成熟,以此降低破骨細胞活性,促使骨吸收與骨形成間形成平衡。ALP活性的高低是BMSCs成骨細胞分化的重要指標。BMSCs是骨髓基質(zhì)重要組成成分,在不同誘導條件下,能夠向成骨細胞、脂肪細胞等不同的細胞系分化,是人體內(nèi)成骨分化和骨形成的重要細胞來源[9]。
本研究結果顯示,模型組大鼠BMD、irisin、Runx2、OPG、BMSCs、ALP蛋白水平含量均低于其他4組。干預后, 運動組和模型+irisin注射組大鼠BMD、irisin、Runx2、OPG、BMSCs、ALP 蛋白水平與模型組相比有所提高,推測運動可能通過irisin增加ALP活性,促進BMSCs增殖,上調(diào)Runx2、OPG mRNA表達,對成骨及破骨雙重調(diào)節(jié),進而達到防治骨質(zhì)疏松的目的。
綜上所述,本研究發(fā)現(xiàn)運動能通過調(diào)節(jié)irisin含量,直接或間接影響影響骨量的表達;而irisin能提高成骨細胞分化活性,促進去卵巢大鼠BMSCs定向分化,進而提高骨密度,防治和延緩絕經(jīng)后骨質(zhì)疏松癥的發(fā)生,應用irisin可能是臨床上改善患者骨質(zhì)疏松的一種潛在的治療手段。

