黃瓜枯萎病拮抗芽孢桿菌的篩選、鑒定及其生防潛力
褚睿 李昭軒 張學青 楊東亞 曹行行 張雪艷
(1. 寧夏大學農學院,銀川 750021;2. 銀川市農業技術推廣服務中心,銀川 750016)
黃瓜(cucumber)是一種重要的商業蔬菜作物,目前已成為我國設施蔬菜的主體[1],長期以來,大規模種植、連作等一系列措施導致土傳病害肆虐,土壤生態平衡被破壞,其中黃瓜枯萎病(Cucumber Fusarium wilt)是影響黃瓜產量的主要土傳病害之一。黃瓜枯萎病是由尖鐮孢菌黃瓜專化型(Fusarium oxysporum f. sp. cucumerinum)引起的全球性土傳病害,通常發病率在20%-50%,嚴重時達80%,甚至絕產,造成巨大的經濟損失[2]。黃瓜枯萎病是設施連作蔬菜的直接致死因子,在黃瓜的整個生育期均可發生,在開花結果期黃瓜枯萎病發病率更高,嚴重影響黃瓜的產量和品質[2-4]。因此,解決由尖鐮孢菌黃瓜專化型引起的枯萎病對黃瓜產業可持續發展至關重要。
目前,國內外關于黃瓜枯萎病已研究出多種防控措施,包括嫁接防治、化學防治、物理防治、農業防治等。但部分存在效率低、田間管理難度大、污染環境等缺點[5]。在現有的枯萎病防治方法中,主要依賴化學防治,雖然化學農藥應用在一定程度上能達到防控病害的要求,但殘留的農藥會帶來環境污染以及作物抗藥性[6]。使用植物根際促生菌(plant growth promoting rhizobacteria, PGPR)和生物防治劑(biocontrol agents, BCAs)是防控枯萎病的另一種方法,PGPR能定殖在植物根際,利用有益微生物,通過競爭作用、抗生作用、重寄生作用、溶菌作用及誘導抗病性等多種防病機制拮抗病原菌,有利于促進作物健康生長[7]。芽孢桿菌因其具有遺傳穩定性強、耐高溫、抗逆性強和抑菌范圍廣等特性被廣泛用于土傳病害的防治。冉新炎等[8]分離獲得的貝萊斯芽孢桿菌(Bacillus velezensis)K-19對根腐病和灰霉病病原菌均有一定的拮抗效果。劉雪嬌等[9]研究發現貝萊斯芽孢桿菌3A3-15產生抑菌物質表面活性素,該次生代謝產物對尖孢鐮刀菌的菌絲有較強致畸作用,且對孢子萌發抑制效果達 93.2%。張德鋒等[10]研究發現貝萊斯芽孢桿菌具有廣譜抑菌活性,此外,還表現出促生長的作用。Han等[11]研究發現解淀粉芽孢桿菌(B. amyloliquefaciens)B1408改變了FOC的菌絲形態,引起細胞質畸形、變形和外滲,使枯萎病發病率降低59.0%,并且促進黃瓜植株生長。此外,Liang等[12]研究發現B. velezensis ATR2對多種植物病原真菌表現出優異的拮抗活性,在植物病害方面表現出巨大的應用潛力。
本研究針對寧夏設施蔬菜高度集約化、復種指數高、高投入水肥管理等栽培模式下引起連作障礙,導致土傳病害肆虐、蔬菜產量和品質下降等問題,以實驗室保存的對黃瓜根腐病具有一定抗性的芽孢桿菌為研究材料,通過平板對峙法對50株芽孢桿菌進行初篩,篩選出抑菌率大于69%的芽孢桿菌,利用芽孢桿菌重懸液對抑病效果較好的菌株進行復篩,確定3株抑制尖鐮孢菌生長效果顯著的芽孢桿菌,分別對其進行形態學鑒定、生理生化鑒定、16S rDNA和gyrA雙基因分子鑒定、抗病促生特性鑒定,結合各項鑒定結果,明確其分類地位。選擇抑制病原菌生長效果最為顯著的菌株進行溫室盆栽試驗,評價其防病促生效果,明確一株對黃瓜枯萎病防病效果最為顯著的生防菌,探究其對黃瓜幼苗枯萎病的防控效果及對植株生長特性的影響,以期為研制多功能菌劑或菌肥提供生物原料和理論基礎,為有效防控黃瓜枯萎病提供理論和技術支撐。
1 材料與方法
1.1 材料
供試黃瓜品種為‘博美626’,黃瓜幼苗購買于寧夏天緣種業有限公司。供試50株芽孢桿菌均由寧夏大學園藝實驗室保存。供試尖鐮孢菌黃瓜專化型(Fusarium oxysporum f. sp. cucumerinum, FOC)購買于商城北納創聯生物科技有限公司。
培養基:NA培養基用于拮抗菌的分離和培養[13],PDA培養基用于真菌培養及拮抗細菌的篩選[13],PDB培養基用于病原真菌液體培養,LB肉湯培養基用于拮抗細菌的液體培養[14]。
1.2 方法
1.2.1 高效抗病促生芽孢菌株的篩選 采用平板對峙培養法[15]從50株對茄病鐮刀菌有一定防控效果的芽孢桿菌中篩選出對黃瓜枯萎病病原菌(尖鐮孢菌黃瓜專化型)有抑制作用的菌株進行初篩。選擇出現抑菌圈的菌株,記錄抑菌圈直徑并計算抑菌率。挑選抑制效果明顯的芽孢菌株純化保存,用于后期試驗。
采用以菌液通過平板對峙培養法對初篩抑菌率高于69%的菌株進行復篩。具體操作如下:將直徑為5 mm的病原菌菌餅接入PDA平板中央,然后在距菌餅四周2.5 cm處打孔,并且接種5 μL生防菌菌懸液(挑取一環純菌接種在冷卻的裝10 mL LB液體培養基的50 mL三角瓶中,置于30℃,200 r/min搖床內培養24 h,10000 r/min離心5 min后取上清液待用),以不接種分離菌株作陰性對照,培養箱28℃培養7 d,每個處理重復3次,記錄抑菌半徑,并統計抑菌率。
抑菌率(%)=(對照病原菌菌落直徑-處理病原菌菌落直徑)/(對照病原菌菌落直徑-病原菌菌餅的初始直徑)×100%
1.2.2 高效抗病促生芽孢菌株的鑒定
1.2.2.1 菌株的形態學和生理生化鑒定 將復篩后拮抗效果最好的3個菌株分別在NA平板上劃線,置于30℃恒溫培養箱中培養24-48 h,參照《伯杰細菌鑒定手冊》及《常見細菌系統鑒定手冊》[16]進行菌落形態觀察和生理生化等特征分析。
1.2.2.2 菌株的抗病促生特性測定 固氮能力:將待測菌株接種到阿須貝培養基,培養觀察其有無菌體生長[17]。溶磷能力:將待測菌株接種于固體無機溶磷培養基平板,培養觀察其有無透明溶磷圈出現[18]。解鉀能力:將待測菌株接種到硅酸鹽培養基上,培養觀察其有無透明圈出現[19]。產鐵載體:將待測菌株接種到鉻天青CAS培養基上,培養觀察有無黃綠色暈圈出現[20]。ACC脫氨酶活性:將菌株接種到ADF液體培養基培養,將培養所得菌液涂布于ADF固體平板,30℃培養后觀察ADF平板上有無菌落生長,有菌落生長則具有 ACC脫氨酶活性,反之則無[19]。根據要雅倩等[21]的方法進行蛋白酶、果膠酶、幾丁質酶、纖維素酶活性的檢測。
1.2.2.3 菌株的分子鑒定 菌株16S rDNA:挑取單菌落接種于LB肉湯培養基30℃培養24 h后,采用DNA提取試劑盒(天根生化科技有限公司)提取菌株的總DNA,使用細菌通用引物(27F: 5'-AGAGTTTGATCATGGCTCAG-3'和1492R:5'-CTACGGCTA CCTTGTTACGA-3')擴增各菌株的16S rDNA基因序列。PCR反應體系(40 μL):模板(基因組DNA)2 μL,前后引物(27F和1492R)各2 μL,ddH2O 14 μL,MIX(2×Taq plus Master Mix)20 μL。PCR擴增反應條件:98℃預變性45 s;98℃變性10 s,60℃退火30 s,72℃延伸30 s;終延伸72℃ 5 min,共30個循環。擴增產物經1.2%瓊脂糖凝膠電泳檢測,PCR產物回收后送至生工生物工程(上海)股份有限公司進行測序。將測得的菌株序列在NCBI數據庫中進行BLAST對比,使用MAGA-X軟件構建系統發育樹。
目標菌株靶基因gyrA 分子鑒定:挑取單菌落接種于LB肉湯培養基30℃培養24 h后,采用DNA提取試劑盒(天根生化科技有限公司)提取菌株的總DNA,使用細菌gyrA 基因擴增引物(L100:5'-AAATCTGCCCGTATCGTCG-3'和R836:5'-GCGTCACGGCGRATCTCAA-3')擴增各菌株的靶基因gyrA序列。PCR擴增反應體系(40 μL):模板2 μL前后引物(L100和R836)各2 μL,ddH2O 14 μL,Mix(2×Taq plus Master Mix)20 μL。PCR擴增反應條件:94℃預變性3 min;94℃變性40 s,61.7℃退火40 s,72℃延伸25 s;終延伸72℃ 10 min,共30個循環。
1.2.3 高效抗病促生芽孢菌株的盆栽試驗 選復篩效果較好的3株芽孢菌株進行盆栽實驗,共3種處理。選取長勢一致的健康成苗,長到兩葉一心時移栽定植,分別用20 mL菌株發酵液(108CFU/mL)灌根處理,CK1為清水澆灌,CK2只接種致病菌,N1、N3、N6分別接種復篩效果好的3種芽孢桿菌及致病菌。CK1:清水灌溉,CK2:10 mL 106CFU/mL尖鐮孢菌懸液+10 mL清水,T1:10 mL 106CFU/mL尖鐮孢菌懸液+10 mL菌N1,T2:10 mL 106CFU/mL尖鐮孢菌懸液+10 mL菌N3,T3:10 mL 106CFU/mL尖鐮孢菌懸液+10 mL菌N6。各處理先接種芽孢菌株(108CFU/mL),24 h后接種尖鐮孢菌孢子懸浮液(106CFU/mL),每株10 mL,每個處理15株,接種10、13、15、17 d后調查發病情況,病情分級標準參考[22],計算病情指數和防病效果。第20天時測定株高、莖粗、葉綠素含量、地上部鮮重、地下部鮮重。每個處理選擇代表性植株3株,連續測定3次,株高采用卷尺從生長定點到基部測定,莖粗采用游標卡尺在子葉下1 cm位置測定,相對葉綠素含量采用葉綠素儀(SPAD-520 Plus)對植株最大的葉片進行葉綠素含量測定,植株根系特性用萬深根系掃描儀(EPSON V700)進行測定。
1.2.4 數據處理 采用Execl 2020和SPSS25.0進行數據統計與分析,使用Origin 2018軟件繪圖。利用MAGA-X數據軟件建立系統發育樹。
2 結果
2.1 尖鐮孢菌拮抗菌的分離與篩選
將50株生防菌通過對尖鐮孢菌的抑菌活性測定試驗,篩選出抑菌率在69%及以上的有7株,60%-69%的菌株有19株,抑菌率在50%-60%的有9株(表1),15株菌株對尖鐮孢菌抑菌效果不佳。對抑菌率在69%以上的菌株采用菌懸液進行復篩。
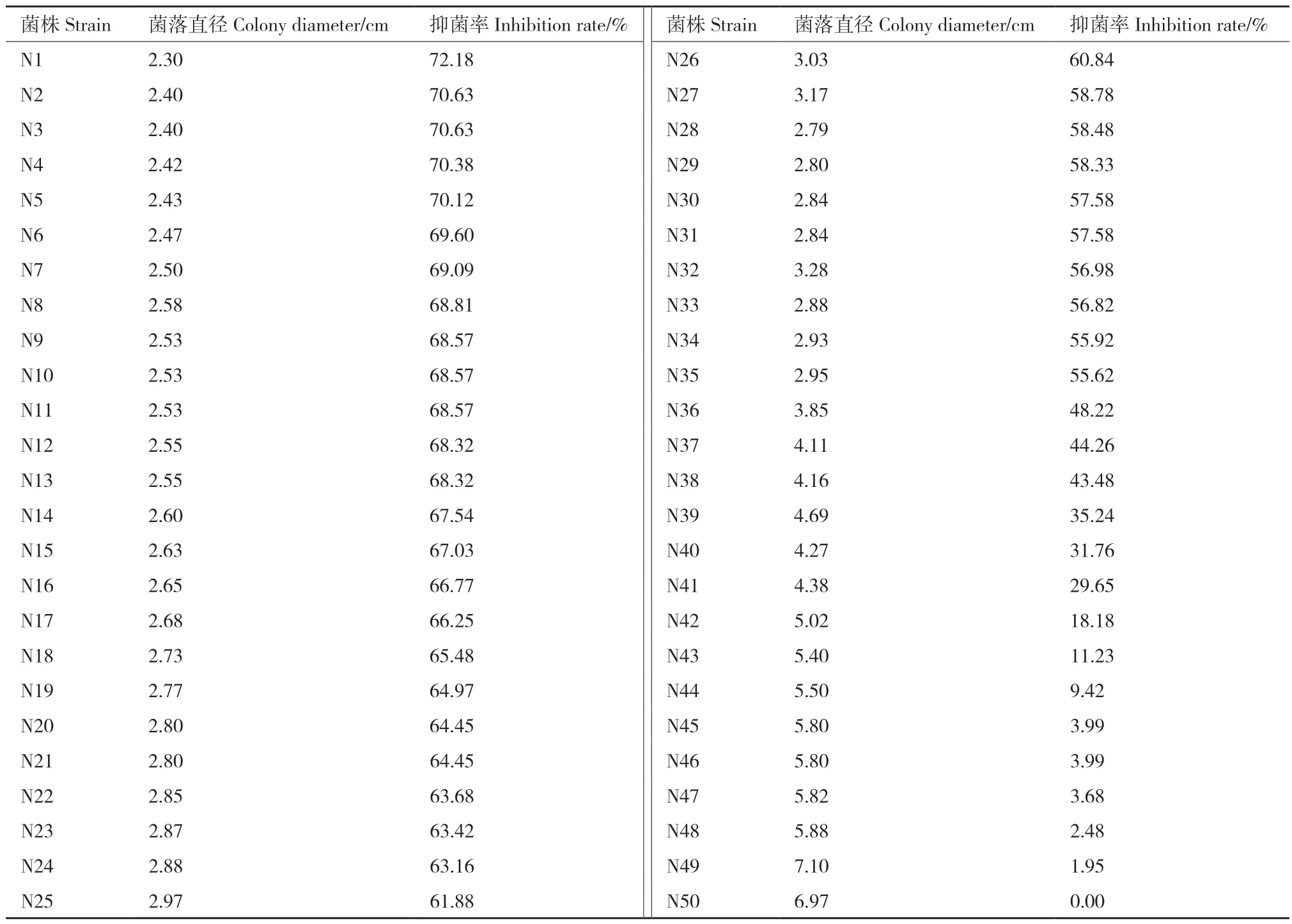
表1 拮抗抗性芽孢桿菌菌株對尖鐮孢菌的抑菌作用Table 1 Inhibition of antagonist Bacillus strain against Fusarium oxysporum f. sp. cucumerinum(FOC)
復篩結果表明,菌株N1、N3和N6對尖鐮孢菌有明顯的拮抗效果(圖1),抑菌率分別為77.71%、75.94%、74.76%(表2)。
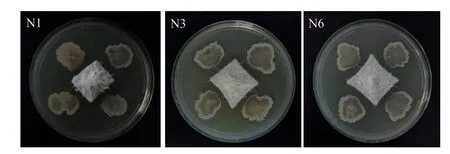
圖1 N1、N3和N6菌株(四周)重懸液對尖鐮孢菌(中心)的抑制效果Fig. 1 Inhibitory effect of N1, N3 and N6 strains(all around)resuspension on FOC
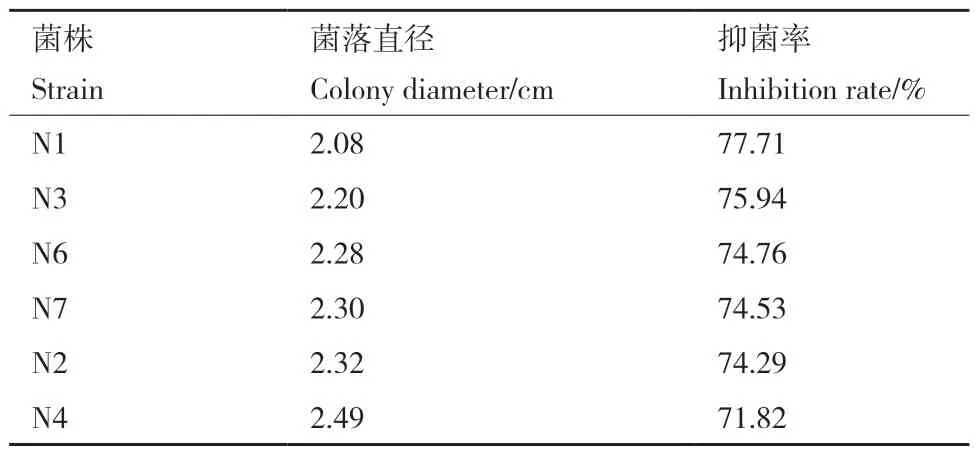
表2 尖鐮孢菌抗性芽孢桿菌復篩抑菌率Table 2 Inhibition rate of Bacillus spp. re-screening on FOC
2.2 尖鐮孢菌拮抗菌菌株的鑒定
復篩得到的3株拮抗效果最好的菌株在NA平板上均長勢良好。培養24 h后,N1菌株的菌落為白色,表面粗糙不規則,隆起有褶皺,邊緣光滑,不透明,干燥,無色素產生;菌株N3的菌落呈白色,表面隆起有褶皺,邊緣光滑,不透明,干燥,無色素產生;菌株N6的菌落表面凸起,邊緣光滑,不透明,濕潤,無色素產生。3株拮抗菌均為革蘭氏陽性菌、桿狀、產橢圓形芽孢(圖2)。
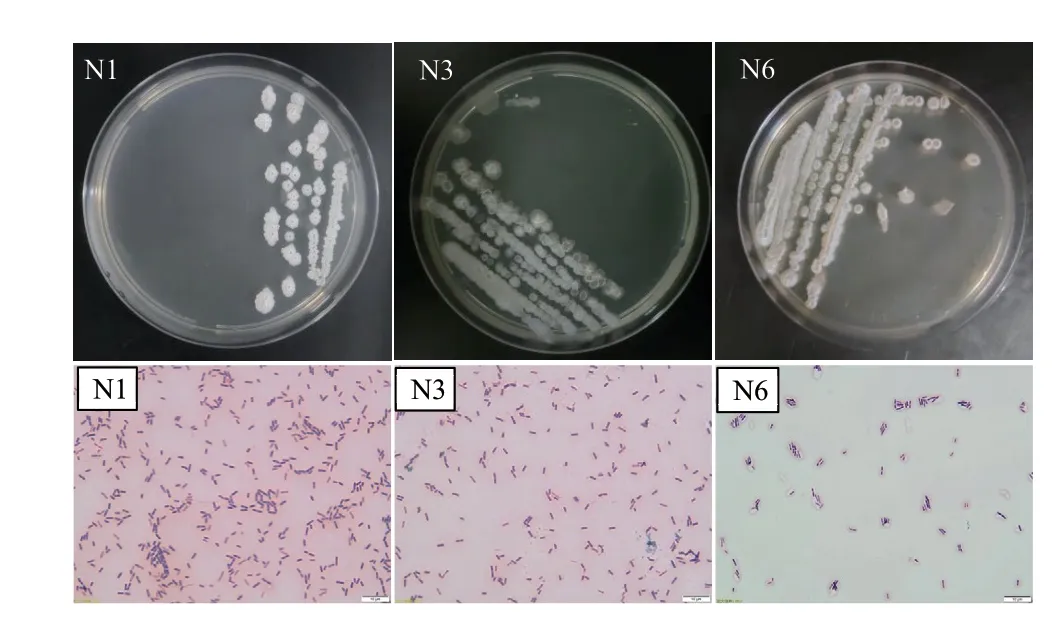
圖2 N1、N3和N6菌株形態(A)及革蘭氏染色圖片(B)Fig. 2 Morphologies(A)of N1, N3, and N6 strains and Gram staining(B)
N1、N3和N6菌株的生理生化試驗結果表明(表3),N1、N6菌株氧化酶試驗、葡萄糖氧化發酵和明膠液化試驗為陽性,其余試驗結果均為陰性。N3菌株氧化酶試驗和葡萄糖氧化發酵試驗為陽性,其余試驗結果均為陰性。
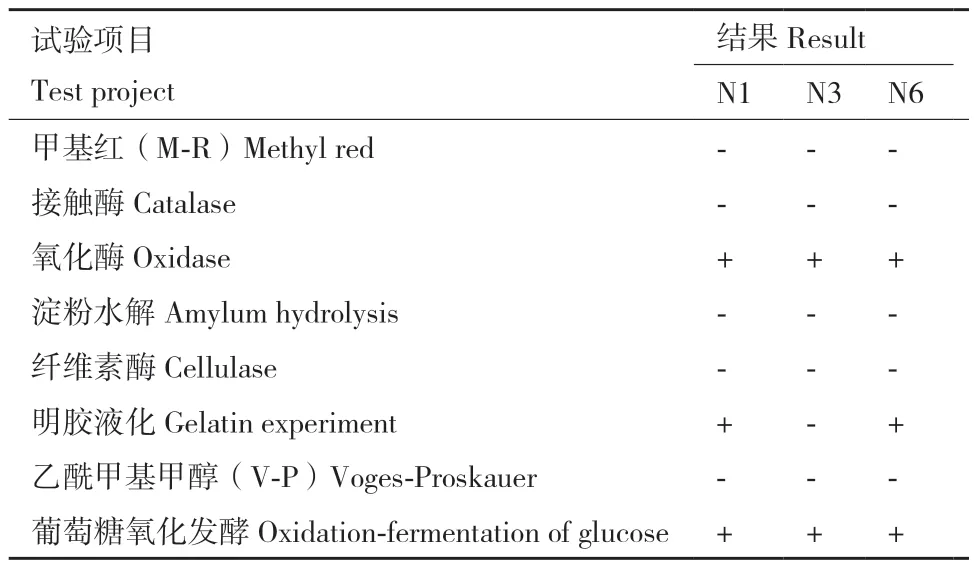
表3 N1、N3和N6菌株的生理生化結果Table 3 Physiological and biochemical results of N1, N3,and N6 strains
N1、N3和N6菌株的抗病促生試驗結果表明(表4,圖3)這3株芽孢桿菌均沒有固氮、溶磷的能力,但其具備解鉀的功能。3株菌均可以分泌鐵載體、蛋白酶、幾丁質酶、果膠酶。3株菌的抗病促生特性較為一致。
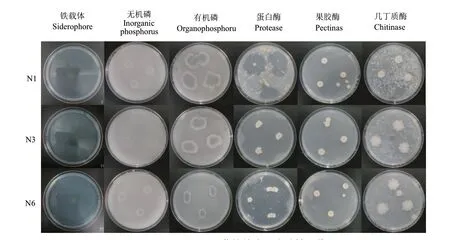
圖3 N1、N3和N6菌株抗病促生特性圖片Fig. 3 Pictures of disease-resistant and growth- proweting properties of N1, N3, and N6 strains

表4 N1、N3和N6菌株的抗病促生特性鑒定Table 4 Identification of disease resistance of N1, N3, and N6 strains and growth- promoting characteristics
根據生防菌N1、N3和N6的16S rDNA基因序列構建系統發育樹(圖4-A)。N1、N3和N6的基因序列與MF375212.1 B. velezensis strain和MW165777.1 B. amyloliquefaciens strain處于同一個分支內,N1、N3和N6可能為貝萊斯芽孢桿菌或解淀粉芽孢桿菌。僅憑16S rDNA分子鑒定試驗無法確定N1、N3和N6菌株所屬菌屬,所以以gyrA基因作特異性引物,基于gyrA基因序列構建系統發育樹。結果(圖4-B)表明,N1、N3、N6菌株與MK775701.1 B. velezensis聚在一支。根據系統進化樹結果推測,N1、N3、N6屬于貝萊斯芽孢桿菌。
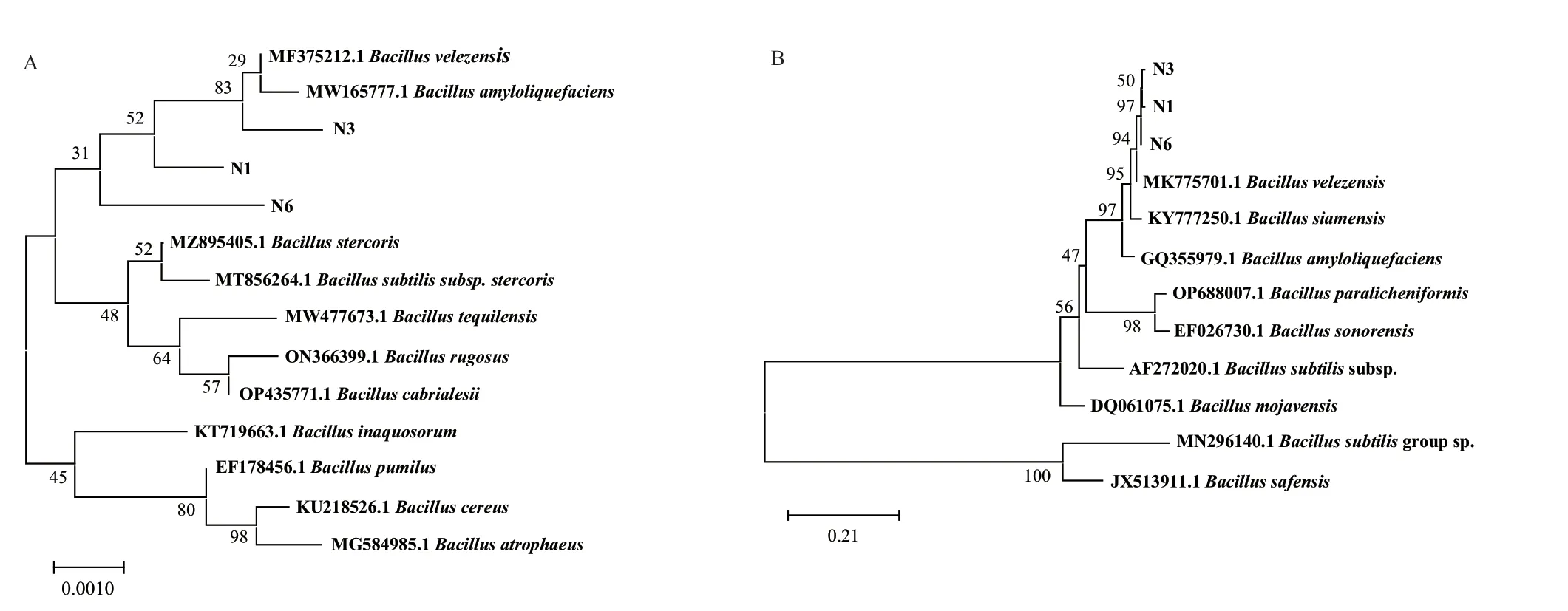
圖4 基于N1、N3和N6菌株16S rDNA(A)和gyrA基因(B)構建的系統發育樹Fig. 4 Phylogenetic trees constructed based on N1, N3, and N6 strains 16S rDNA(A)and gyrA gene(B)
2.3 拮抗性菌株盆栽試驗防病及促生效果
接種生防菌10 d后,各處理均開始發病;接種生防菌14 d后N1、N3和N6處理防病效果逐漸降低并趨于穩定;CK2處理病情指數隨接種時間遞增,于接種后22 d達到86.11。接種菌株懸浮液的處理中N6菌株的防病效果最佳,達到66.13%,N1次之(表5)。
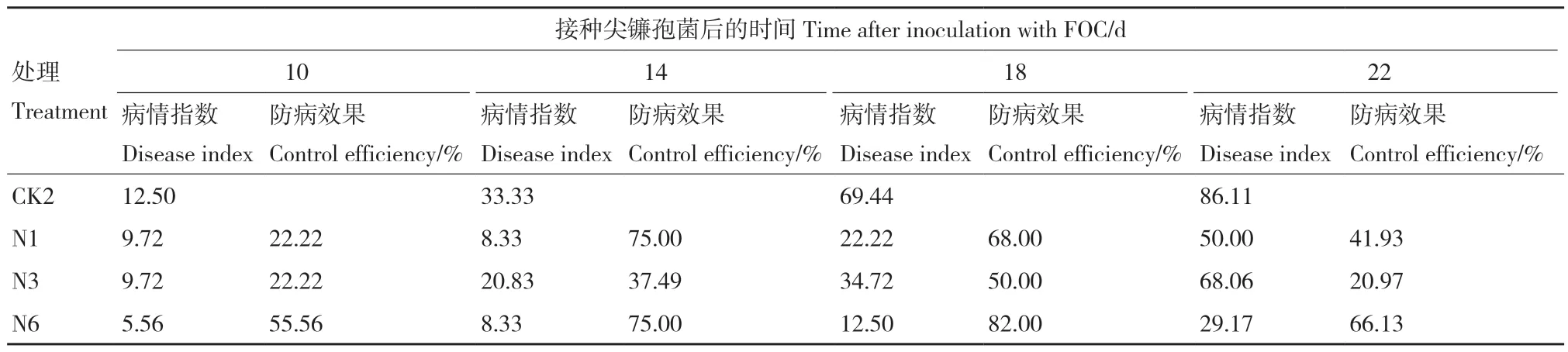
表5 菌株對黃瓜枯萎病的防病效果Table 5 Disease-prevention effect of the strain on cucumber wilt
統計各處理植株長勢(表6)發現,只接種病原菌的處理長勢顯著低于其他處理,該處理葉綠素含量、莖粗、生物量顯著降低,說明尖鐮孢菌侵染會顯著降低葉綠素含量、減少生物量的積累,與N1、N3和N6處理相比,接種生防菌可以最大程度緩解病原菌對植株造成的損傷,提高植株葉綠素含量、生物量并達到增粗的效果。N1和N3處理株高低于對照,莖粗、葉綠素含量顯著高于對照,葉面積、地上部鮮重和地下部鮮重則與對照無顯著性差異。N6處理的莖粗、葉綠素含量及生物量顯著高于對照,株高、葉面積與對照組無顯著性差異。綜合評價可知與CK1相比,N1、N3和N6菌株對黃瓜幼苗均有一定的促生效果,特別是在增粗、提高葉綠素含量方面,3個生防菌處理相比,N6菌株的促生效果最佳,顯著優于N1和N3菌株。
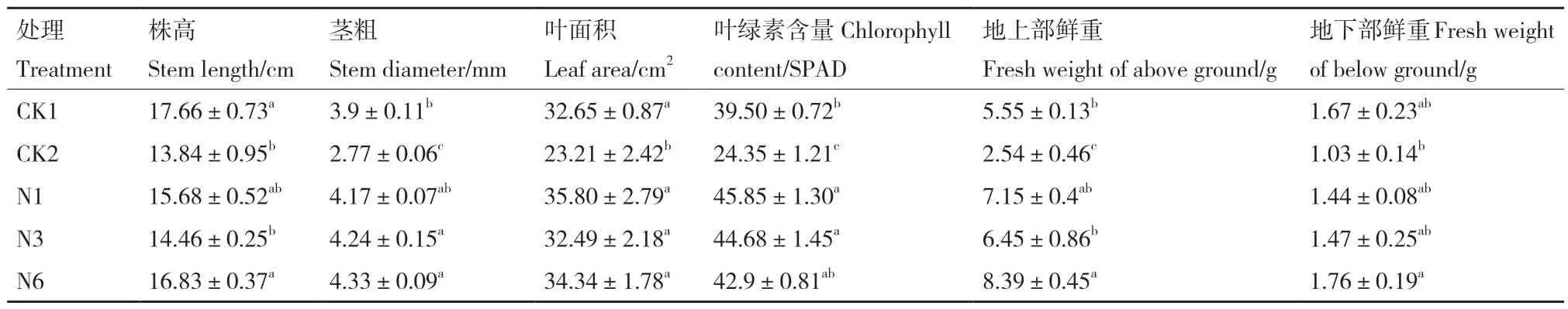
表6 菌株對黃瓜幼苗的促生效果Table 6 Growth-promoting effect of strains on cucumber seedlings
3 討論
黃瓜枯萎病嚴重威脅設施蔬菜生產的產量和品質,傳統的農業防治、化學防治等方法都有一定的弊端,應用微生物防治枯萎病是一條有效的技術途徑[23]。其中生防細菌由于所需營養少、根際定植迅速、繁殖快等優點而具有很大的發展潛力。Banat等[24]研究發現,防治植物病害潛能的生防細菌有假單胞菌(Pseudomonas sp.)、芽孢桿菌、沙雷氏菌(Serratia sp.)等,主要的生防菌是芽孢桿菌和假單胞菌。據報道,從番茄中分離出來的2株丁香假單胞菌(Pseudomonas syringae)對黃瓜枯萎病病原菌具有顯著抑制作用,顯著降低枯萎病的發病率[25],并且可以通過誘導植物的系統抗性(ISR)從而在植物防御機制激活和植物生長促進中起重要作用[26]。
生物防治主要是利用拮抗微生物及其代謝產物防治植物病害。已報道芽孢桿菌可以產生抗生素、降解酶、ACC脫氨酶、揮發性化合物等參與拮抗菌的生物控制間接促進植物生長[27]。馬興[28]發現生防細菌分泌揮發性物質抑制黃瓜枯萎病病原菌菌絲的生長。部分芽孢桿菌通過溶解磷酸鹽、產生鐵載體、生物固氮等方式提高植物根際養分的可利用性。本研究貝萊斯芽孢桿菌N1、N3和N6嚴重抑制了尖鐮孢菌的生長,經抗病促生特性鑒定,3株菌株均可產生幾丁質酶、果膠酶和蛋白酶,分解尖鐮孢菌細胞壁進入細胞,從而抑制病原菌的生長,這與楊茉[29]研究結果一致。此外,3株菌株顯著提高了植株葉綠素含量、促進植株生物量積累的功能,通過溶解鉀幫助根系吸收礦物質元素,并產生鐵載體增加土壤中可被植物吸收的有效態鐵元素含量,促進植株對鐵元素的吸收,達到促生的效果。
生防菌株能否在植物根際或根部有效定殖是決定根部病害防治成功的關鍵一步[26]。PGPR定殖在植物根際,可以促進植株生長。試驗明確了篩選出的3株貝萊斯芽孢桿菌對尖鐮孢菌菌絲生長具有顯著抑制效果,這可能與貝萊斯芽孢桿菌對尖鐮孢菌菌絲具有強致畸能力有關[30],但盆栽效果并不如平板對峙試驗效果顯著,說明N1和N3可能并沒有在植株根際迅速定殖,沒有占據有利生態位點,可能是由于貝萊斯芽孢桿菌在根際定殖效果差或復雜的基質環境導致的。而N6盆栽試驗效果與平板對峙效果一致均具有顯著防病效果,具有很大的生防潛力。探究貝萊斯芽孢桿菌在植株根系的定植機制以及復雜的基質環境對貝萊斯芽孢桿菌繁殖的影響需要進一步探究。
芽孢桿菌N1、N3和N6具有良好的防病促生效果,為黃瓜尖鐮孢菌枯萎病的生物防治提供了理論依據,也為芽孢桿菌的產業化開發提供了菌種資源。但對其防病效果的廣譜性、其在根際定殖的動態規律與代謝產物的研究、發酵工藝優化等均有待進一步明確,以便全面地發掘N1、N3和N6的防治潛力,進而研發出多功能的芽孢桿菌制劑。
4 結論
篩選出3株對尖鐮孢菌拮抗效果顯著的貝萊斯芽孢桿菌N1、N3和N6,抑菌率分別為77.71%、75.94%和74.76%,菌株防病效果分別為41.94%、20.97%、66.13%。接種N1、N3和N6可以顯著促進黃瓜幼苗的株高、莖粗、葉面積、葉綠素含量、地上和地下部鮮重的增加,其中N6處理增加效果最顯著,可作為防控黃瓜苗期尖鐮孢菌枯萎病、促進黃瓜幼苗生長有潛力的生物防治資源。

