馬鈴薯PDS和ZDS基因的克隆與表達特性分析
石源睿 董海濤 常璐 呂運韜 賈小云 張紅梅 唐銳敏


關鍵詞:八氫番茄紅素脫氫酶;ζ-胡蘿卜素脫氫酶;類胡蘿卜素;馬鈴薯;基因表達
馬鈴薯(SolanumtuberosumL.)是僅次于水稻、小麥和玉米的世界第四大糧食作物,最早在南美洲安第斯地區被發現,在秘魯被馴化,是一種與社會經濟發展密切相關的優勢作物[1]。其與谷類作物單位面積的可食用干物質產量幾乎相同,是工業和食品加工原料的重要來源[2]。其含有豐富的類胡蘿卜素,是一類高度不飽和的萜類化合物[3],作為植物光合作用中光吸收的輔助色素,是植物光合膜的重要組成部分[4-5]。類胡蘿卜素可與多種自由基發生拮抗脂質的過氧化反應[6-8],具有延緩衰老的效果;同時還能有效防止心血管、冠狀動脈粥樣硬化以及血栓性等疾病的發生[9]。此外,類胡蘿卜素進入人體被吸收后會轉化成維生素A,以達到保護視力的效果[10]。
在植物體內,異戊烯焦磷酸(IPP)和二甲基丙烯基二磷酸(DMAPP)經過一系列的氧化還原反應合成β-類胡蘿卜素[11]。互為協同作用的八氫番茄紅素脫氫酶(PDS)和ζ-胡蘿卜素脫氫酶(ZDS)是類胡蘿卜素合成途徑中的限速酶[12]。無色的八氫番茄紅素在PDS和ZDS的脫氫作用下轉變為粉色的番茄紅素,進而生成β-類胡蘿卜素[13],共同參與調控植物生長發育過程中類胡蘿卜素的代謝途徑。目前,已有許多研究表明,PDS和ZDS基因屬于同源基因,在系統中可歸為一類[14]。霍培等[15]、TRAVELLA等[16]研究表明,類胡蘿卜在植物體內主要存在于葉綠體及許多花和植物的有色體中,與植物的光合作用及葉、花和果實的顏色形成密不可分。當植株內的PDS被沉默時,其葉片會發生白化,導致其色素含量改變,從而使其光合作用受阻。吳建設等[17]、陳段芬等[18]分別對不同生長時期的觀賞性向日葵和中國水仙內的PDS表達進行研究,證實了PDS表達量的增加與花色的加深有關。在三汁蜜柚果實成熟過程中,隨著果實顏色的加深,其汁胞、囊衣和海綿層中CmZDS的表達量呈現穩定上升的趨勢[19],在芒果中也有類似發現[20]。分析成熟時期番木瓜果實、葉片和花中PDS和ZDS基因的表達量發現,富含類胡蘿卜素的果實中的表達量要顯著高于葉片和花[21-23]。彩色馬鈴薯塊莖中富含類胡蘿卜素和花青素等次生代謝物,使其成為開發功能食品的理想資源[24]。
本研究從黃心馬鈴薯晉薯16號品種中分別克隆PDS和ZDS基因,利用生物信息學工具對這2個基因及其所編碼的蛋白序列進行分析,并對二者在不同組織內的表達模式進行定量檢測,旨在解析馬鈴薯PDS和ZDS在類胡蘿卜素合成途徑中的調控作用,為后續馬鈴薯品種的創新及培育奠定一定分子基礎。
1 材料和方法
1.1 試驗材料
供試黃心馬鈴薯為晉薯16號(Jinshu16),脫毒苗由山西省薯類脫毒中心提供;紅心馬鈴薯紅玫瑰2號(RedRose2)和紫心馬鈴薯為希森8號(Xisen8),脫毒苗均由山東省樂陵市希森薯業有限公司提供。將3個品種4周齡的組織培養苗轉移至Hogellan溶液中煉苗,7d后移至基質中生長,培養于(22±1)℃、14h光照/10h黑暗條件的溫室中生長,100d后收獲新鮮塊莖。轉化所用菌株為大腸桿菌(Escherichiacoli)DH5α,由山西農業大學生命科學學院分子生物學實驗室保存。克隆載體是PMD19-TVector。
1.2 總RNA的提取及cDNA的合成
取每個品種種植100d的馬鈴薯根、莖、葉和塊莖各0.1g,用液氮快速冷凍后進行研磨。每個樣品進行3個生物學重復。使用RNA提取試劑盒(華越洋,北京)對不同品種的馬鈴薯各組織總RNA進行提取。后經瓊脂糖凝膠電泳對所提取RNA的完整性和質量進行檢測,并根據TaKara反轉錄試劑盒說明書(TaKara,大連)對所提取的RNA反轉錄。
1.3 馬鈴薯StPDS和StZDS基因克隆
根據NCBI網站中查到的馬鈴薯StPDS和StZDS預測序列(XM_015306724.1,XM_015308927.1)設計克隆引物(表1)。
以上述反轉錄所得到的cDNA為模板分別對StPDS和StZDS進行PCR克隆(邁維生物,武漢),反應程序為:94℃預變性2min;94℃下變性30s,48℃(StPDS)/43.6℃(StZDS)退火30s,72℃延伸1min,35個循環;72℃終延伸2min。擴增產物通過凝膠回收試劑盒(AxygenScientificInc.,Unioncity,USA)將目的片段回收,并與PMD19-T相連,獲得重組質粒PMD19-T-StPDS和PMD19-T-StZDS。將重組質粒轉入大腸桿菌DH5α,并將其涂布于含有氨芐霉素的LB平板培養基上過夜培養15~17h,挑取單克隆進行菌落PCR,將陽性克隆所提取的質粒(優逸蘭迪,蘇州)送上海生工生物公司測序,陽性克隆的菌液和所提質粒凍于-80℃保存。
1.4 馬鈴薯StPDS和StZDS基因的生物信息學分析
生物信息學分析軟件如表2所示,分別對StPDS和StZDS轉錄起始位點上游1000bp的基因啟動子區順式作用元件進行預測,并對其編碼蛋白的親疏水性、理化性質、跨膜結構、信號肽、二級結構、三級結構及互作蛋白進行分析。利用馬鈴薯StPDS和StZDS的蛋白序列,通過BlastP在NCBI數據庫中搜索其他植物PDS和ZDS的蛋白序列,使用MEGA7.0軟件,構建Neiber-Joing(NJ)系統發育樹,Bootstrap分析重復數為1000。
1.5 馬鈴薯塊莖中類胡蘿卜素含量的測定
取適量的馬鈴薯塊莖用液氮快速冷凍后研磨成粉狀,稱取約0.15g塊莖樣品置于50mL離心管中,加入15mL丙酮,于4℃黑暗處放置1~2h,直至粉末為灰白色,4000r/min離心10min,吸取上清液測定其在454nm處的吸光值。
1.6 馬鈴薯StPDS和StZDS基因的表達模式分析
根據馬鈴薯StPDS和StZDS基因序列設計特異性定量引物(表1),以晉薯16號、紅玫瑰2號和希森8號的根、莖、葉和薯塊的cDNA為模板,EF-1α為內參,根據實時熒光定量PCR試劑盒說明書(Takara,大連),通過BIO-RADCFX96熒光定量儀對馬鈴薯StPDS和StZDS基因進行不同品種不同組織的表達模式分析。每個樣品進行3個重復。根據2-ΔΔCt法分析計算結果,并使用SPSSStatisticsv22對試驗數據進行差異顯著性分析(P<0.05)。
2 結果與分析
2.1 馬鈴薯StPDS和StZDS基因克隆
提取晉薯16號塊莖中RNA經瓊脂糖凝膠電泳,對其進行檢測后反轉錄成cDNA。以StPDSPF/PR和StZDS-PF/PR為克隆引物,PCR擴增產物如圖1-A所示,在2條泳道上各得到了1條特異性條帶,將這2條目的片段割膠回收、連接PMD19-T載體、轉化大腸桿菌后進行菌落PCR,檢測到目的片段(圖1-B、C)。進一步測序結果表明,StPDS和StZDS的cDNA長度分別為1752、1767bp,與NCBI網站中預測的馬鈴薯PDS和ZDS基因進行比對,一致度分別為99.40%和99.35%(圖1-D、E)。
2.2 馬鈴薯StPDS和StZDS的生物信息學分析
2.2.1 馬鈴薯StPDS和StZDS理化性質分析 如圖2、3所示,StPDS基因編碼583個氨基酸,蛋白的分子質量為64.97ku,理論等電點為6.41;StZDS基因編碼588個氨基酸,分子質量約為64.73ku,理論等電點為8.51,二者均為無跨膜結構的親水不穩定蛋白。
2.2.2 馬鈴薯StPDS和StZDS蛋白結構分析和信號肽預測 如圖4所示,在馬鈴薯StPDS的二級結構中α-螺旋和無規則卷曲所占比例較高,分別為38.25%和41.34%;β-片層和β-轉角所占比例較少,分別為16.64%和3.77%;其三級結構預測表明,其蛋白質可能具有5個較為保守的結構域。而StZDS二級結構由40.99%的α-螺旋、16.5%的β-片層、3.57%的β-轉角和38.95%的無規則卷曲構成;其三級結構預測表明,其蛋白質可能具有5個較為保守的結構域。此外,2個蛋白均無信號肽,為非分泌蛋白,這一結果也與其在細胞內發揮的功能相適應。
2.2.3 馬鈴薯StPDS和StZDS的啟動子元件預測 利用Menu網站對StPDS及StZDS的啟動子(取轉錄起始位點上游2000bp)進行預測,結果如圖5所示,二者均具有較多的光響應元件(如TCCCmotif、TCT-motif、Box4、G-box等)和逆境有關的調控元件(如響應低溫脅迫(LTR)和干旱脅迫(MBS))。其中,StPDS還具有抗氧化反應的調控元件(ARE);對StPDS及StZDS的啟動子元件預測的結果進行分析,推測馬鈴薯PDS及ZDS基因的表達可能受到光調節及激素和逆境的誘導與調節。
2.2.4 馬鈴薯StPDS和StZDS的系統進化分析在NCBI數據庫中分別下載二穗短柄草(Brachypo?diumdistachyon)(XP_003558653.1)、玉米(Zeamays)(NP_001338939.1)、木薯(Manihotesculenta)(XP_021613095.1)、擬南芥(Arabidopsisthaliana)(NP_193157.1)、向日葵(Helianthusannuus)(XP_022013639.1)、煙草(Nicotianatabacum)(XP_019244024.1)、辣椒(Capsicumannuum)(XP_016562403.2)、野生番茄(Solanumpennellii)(XP_027771295.1)、番茄(Solanumlycopersicum)(NP_001234095.1)共9個物種PDS的同源序列,以及番木瓜(CaricapapayaLinn)(XP_021891252.1)、小球藻(Chlorellavariabilis)(XP_005843062.1)、木薯(XP_043815084.1)、擬南芥(NP_001319473.1)、玉米(NP_001105609.2)、向日葵(XP_022010060.1)、煙草(NP_001312062.1)、辣椒(NP_001311497.1)、番茄(NP_001234383.2)共9個物種的ZDS蛋白質氨基酸序列。利用MEGA-X對上述序列進行進化樹分析,結果發現(圖6),馬鈴薯PDS及ZDS均與同為茄科植物的番茄和野生番茄的同源關系最近,推測它們可能在馬鈴薯內發揮著與番茄PDS、ZDS相近的功能。
2.3 馬鈴薯StPDS蛋白互作預測
使用String軟件(https://cn.string-db.org/)對馬鈴薯StPDS(Phytoenedehydrogenase)互作蛋白進行預測,結果發現(圖7),StPDS與StZDS(Zeta-Carotenedesaturase)、StLYCe(Lycopeneepsiloncyclase)等酶蛋白存在互作關系。
2.4 馬鈴薯塊莖中類胡蘿卜素含量測定及StPDS和StZDS表達模式分析
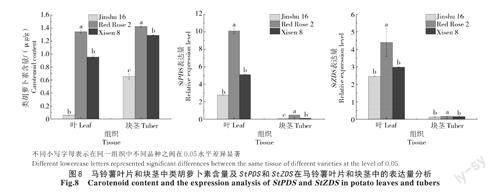
對3個不同品種馬鈴薯葉片及塊莖中類胡蘿卜素的含量進行檢測并分析,結果如圖8所示,類胡蘿卜素在紅玫瑰2號葉片和塊莖中含量較高,顯著高于晉薯16號。
進一步利用qRT-PCR對3種不同顏色馬鈴薯的葉片及薯塊中StPDS和StZDS基因的表達量進行檢測,結果發現,這2個基因均在紅心馬鈴薯紅玫瑰2號中表達量最高,顯著高于另外2個品種(P<0.05);且在葉片中的表達量也遠遠高于塊莖。同一組織中,類胡蘿卜素含量和2個基因表達量的變化趨勢一致,均表現為紅玫瑰2號最高,希森8號次之,晉薯16號最低,說明StPDS和StZDS可能正向調控類胡蘿卜素的積累;而在同一品種中,如紅玫瑰2號,塊莖中類胡蘿卜素含量高于葉片,但是2個基因的表達量卻表現為葉片高于塊莖,這一現象說明StPDS和StZDS可能參與葉片的某些生理活動。
3 結論與討論
類胡蘿卜素是存在于許多花、果實、葉片中的天然色素。PDS和ZDS在植物體類胡蘿卜素合成通路上發揮著至關重要的作用,有研究表明,這2種脫氫酶是類胡蘿卜素合成通路上的重要分支點[25-27],其表達受到抑制時會影響植物體內八氫番茄紅素的積累,進而影響花、葉片和果實中類胡蘿卜素含量,不僅會造成植物體種皮、果肉顏色的變化,而且還會影響植物營養物質的含量,目前已從草莓[28]、番木瓜[22-23]、水仙[20]、穿心蓮[29]、甜瓜[30]等物種體內分離得到PDS或ZDS基因。
本研究成功克隆到馬鈴薯的PDS和ZDS,其片段大小分別為1752、1767bp,分別編碼583、588個氨基酸。利用生物信息學軟件對StPDS和StZDS進行理化性質和結構分析,發現二者均為無跨膜結構域的親水性蛋白,表明二者均不是膜蛋白,這與其在植物體內發揮的功能相適應。在NCBI上搜索不同物種的PDS和ZDS序列并構建發育進化樹,結果顯示,馬鈴薯StPDS和StZDS的氨基酸序列與番茄的PDS和ZDS親緣關系最近,表明馬鈴薯的PDS和ZDS可能與番茄SlPDS和SlZDS具有相似的功能和作用機制。利用String數據庫對馬鈴薯PDS進行互作蛋白預測分析,發現StPDS蛋白與StZDS、StLYCe等酶蛋白相互作用,這一結果與KATO等[27]的研究結果一致,LCYe可以調控紅色的番茄紅素轉變為橙色的β-胡蘿卜素[21],推測這些蛋白可能協同作用,共同正調控植物類胡蘿卜素的合成。
類胡蘿卜素可以吸收光作為碳同化的能源,有研究表明,PDS基因在被沉默后,植物葉片會發生白化,其光合作用受阻[16,31]。本研究對不同品種馬鈴薯的葉和塊莖內StPDS和StZDS的基因表達量進行檢測,結果顯示,這2個基因均在葉片中的表達量最高,這與前人的研究結果相一致[17,28]。對馬鈴薯塊莖類胡蘿卜素含量測定發現,不同顏色薯塊中類胡蘿卜素的含量有所差異,其中紅心馬鈴薯紅玫瑰2號塊莖中類胡蘿卜素的含量最高,且紅玫瑰2號中2個基因的表達量均顯著高于其他2個品種,這與其塊莖中類胡蘿卜素含量的變化趨勢相一致。對果色差異較大的3個芒果品種進行基因表達分析后也得出類似的結果,芒果PDS和ZDS基因表達量在紅色芒果果皮中最高,在青色芒果果皮中最低[20]。
本研究通過克隆獲得StPDS和StZDS的cDNA全長序列,并進行生物信息學分析及表達差異分析,結果表明,在同一組織中,紅玫瑰2號類胡蘿卜素的含量及StPDS和StZDS基因的表達量顯著高于希森8號和晉薯16號,推測其可能正向調控馬鈴薯塊莖中類胡蘿卜素的積累,從而使薯塊的顏色呈現紅色;對不同品種的馬鈴薯類胡蘿卜素及2個基因的表達量分析發現,StPDS和StZDS基因在葉片中的表達量遠遠高于塊莖,這一結果與類胡蘿卜素含量所呈現的趨勢恰好相反。結合前人的研究,推斷StPDS和StZDS可能參與葉片的光合作用。這些結果為進一步研究PDS和ZDS在馬鈴薯生長發育過程調控機制奠定了一定的基礎,同時為改善馬鈴薯的外觀品質提供了一定的參考依據。

