靶向BCMA的嵌合抗原受體T細胞治療三重難治性多發性骨髓瘤的研究進展
陳 瑾,呂鴻雁,劉晗,劉建寧,盧佳配,張金巧
(河北醫科大學第三醫院 血液內科,河北 石家莊 050051)
多發性骨髓瘤(multiple myeloma,MM)是一種以骨髓中漿細胞異常增生并產生克隆性免疫球蛋白,以及骨骼破壞為特征的惡性腫瘤性疾病,其獨特的生物學特性使大多數患者難逃原發耐藥或疾病復發的不良結局。參考Frost &Sullivan報告及國家癌癥中心發布的《2022年全國癌癥報告》[1],中國MM新發患者2020年人數為11.4萬人,到2024年達到16.7萬人。MM的治療往往使用治療線(lines of therapy,LOT)的數量指導預后。有研究[2]表明,與使用LOT相比,難治性藥物/藥物類別的數量更易區分同質患者,三重難治性MM(triple-class refractory multiple myeloma,TCR MM)[3]是對至少1種蛋白酶體抑制劑(proteasome inhibitors,PIs)、免疫調節劑(immunomodulatory drugs,IMiDs)和抗CD38單克隆抗體(monoclonal anti-bodies,MoAbs)難治。嵌合抗原受體T細胞治療(chimeric antigen receptor,CAR-T)是利用T細胞免疫消除MM細胞的新型免疫療法。在這種細胞過繼的免疫治療中,首先將患者或健康人的T細胞在體外通過基因工程技術,插入可識別腫瘤細胞并能激活T細胞的CAR,再將經過體外擴增的CAR-T細胞回輸,攻擊表達相關抗原的腫瘤細胞。目前,CAR-T在治療急性淋巴細胞白血病、彌漫大B細胞瘤等疾病中取得了良好的效果。MM是CAR-T細胞治療研究最多的血液系統腫瘤之一[4]。Meta分析[5]顯示,在接受CAR-T治療(包含CAR靶向的7種抗原)的復發/難治性MM(relapsed/refractory MM,RRMM)患者中,客觀緩解率(ORR)為77%,微小殘留病(minimal residual disease,MRD)陰性率為78%,中位無進展生存期(median survival,mPFS)8個月。3~4級細胞因子釋放綜合征(cytokine release syndrome,CRS)和神經毒性(neurologic toxicities,NT)分別為14%和13%,表明CAR-T治療RRMM的有效性和安全性。CAR-T的出現徹底改變了MM的治療前景。CAR-T治療的靶點包括B細胞成熟抗原(B cell maturation antigen,BCMA)、G蛋白偶聯受體C類5組成員D、信號傳導的淋巴細胞激活分子家族7、CD19、CD38、CD138等[6]。其中,BCMA因其在骨髓瘤細胞中過表達,在其他組織中表達有限,使得其成為MM治療中一個有吸引力的靶點[7]。正在進行中的CAR-T細胞研究概況,見表1。
1 單靶點CAR-T
1.1Idecabtagene vicleucel Idecabtagene vicleucel (ide-cel)于2021年3月被美國食品藥品監督管理局(Food and Drug Administration,FDA)批準、2021年8月被歐洲藥品管理局(European Medicines Agency,EMA)批準。作為全球首款治療MM的靶向BCMA CAR-T細胞藥物,用于治療先前LOT≥4(FDA)、≥3(EMA)(包括PIs、IMiDs和抗CD38 MoAbs)的RRMM,推薦使用劑量為(300-460)×106CAR-T細胞。
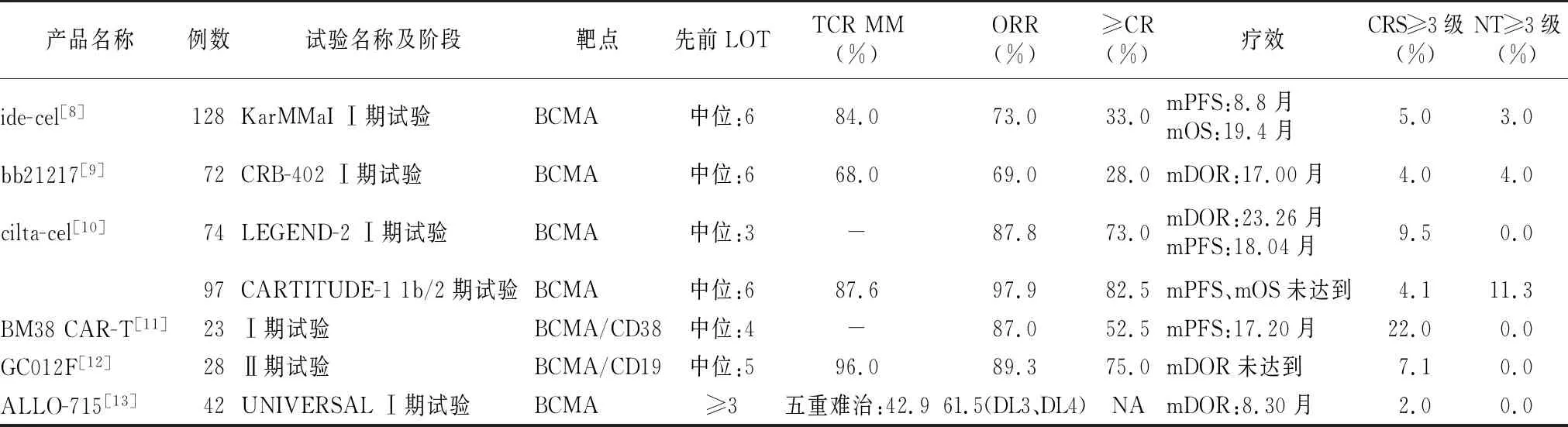
表1 靶向BCMA的CAR-T產品數據匯總
Ide-cel結構包含抗BCMA單鏈可變片段、CD137共刺激基序和CD3-zeta信號域,是一種利用慢病毒載體轉導靶向BCMA CAR基因的T細胞,能持久表達抗BCMA CAR分子,持續作用于骨髓瘤細胞,發揮抗腫瘤活性[14]。在不同的BCMA表達水平下,甚至在BCMA為可溶性的情況下,ide-cel在體外均能有效殺傷腫瘤細胞,且在MM小鼠模型中顯示出快速、持續的消滅腫瘤細胞和100%的存活率。
Ide-cel的Ⅰ期試驗[8](CRB-401)結果顯示,33例患者中,總客觀緩解率(objective response rate,ORR)為85%,完全緩解率(complete response,CR)為45%,≥部分緩解(partial response,PR)患者MRD均為陰性,mPFS為11.8個月。2例(6%)發生3級CRS,1例(3%)發生可逆的4級NT。Ⅱ期試驗[15](KarMMa)結果相似,納入128例患者,先前LOT≥3,84%為TCR MM。ORR為73%,≥CR為33%。MRD達陰性占總體的26%,占≥CR患者的79%,mPFS和中位總生存期(median overall survival,mOS)分別為8.8個月和19.4個月。3~4級CRS發生率為5%,3級NT發生率為3%。細胞動力學分析[8]證實,在輸注后6個月,49例中有29例(59%)發現CAR-T細胞,12個月時,11例中有4例(36%)發現CAR-T細胞,表明持久性良好。
一項研究[16]評估了標準ide-cel在真實世界的臨床結局。108例接受ide-cel 治療,劑量為一次性回輸300~460×106CAR-T細胞,第30 d時,ORR為83%,CR為34%,3~4級CRS發生率為4%。真實世界的研究與Ⅱ期相比較,更多患者為五類藥物耐藥且體能狀態更差,但安全性及30d的總緩解率與臨床試驗人群相當甚至更佳。但因上市時間較短,數據尚不充分,有待展開更大規模的探討。
1.2bb21217 bb21217是在ide-cel基礎上開發的產品,與ide-cel使用相同的CAR分子,但加入PI3K抑制劑-bb007培養,用以富集記憶型T細胞。bb21217顯著富集了記憶型T細胞的同時耗竭了高度分化或衰老的T細胞[9]。對記憶/衰老標志物的表達與臨床結果相關性的研究[9]顯示,與長效記憶型T細胞形成相關的CD127高表達與緩解持續時間(duration of response,DOR)呈正相關,而與DOR呈負相關的是與T細胞分化相關的多種標志物,表明記憶型T細胞的富集可能會改善RRMM患者的臨床結局。
bb21217的Ⅰ期試驗(CRB-402),納入74例RRMM患者。第63屆美國血液年會公布數據[17],顯示,截至2021年2月16日共72例接受治療,中位LOT為6,TCR MM占68%,清淋后接受150×106、300×106或450×106CAR-T細胞的單次輸注。ORR為69%,≥CR為28%,≥非常好的部分緩解(VGPR)為58%,中位DOR(median DOR,mDOR)為17個月。CRS發生率75%,主要為1~2級,NT發生率為15%,僅有3例為3~4級,表明整體安全性良好。
1.3Ciltacabtagene autoleucel Ciltacabtagene autoleucel(cilta-cel,LCAR-B38M,JNJ-4528)是國內研發的靶向BCMA的CAR-T。因結合了具有“雙抗原表位”特異性的單鏈可變片段,所以包含2個BCMA靶向單域抗體。2022年2月獲FDA批準,用于先前LOT≥4的MM患者,成為中國首個自主研發并在美國上市的細胞藥物,也是繼ide-cel之后全球第二款靶向BCMA的CAR-T。在療效方面,cilta-cel通常優于ide-cel[10]。
LEGEND-2[18]是中國多中心的Ⅰ期試驗,首次將cilta-cel應用于人體,對安全性與療效進行了長期的評估,是目前應用CAR-T治療RRMM最長隨訪時間的試驗。共納入74例患者,中位LOT為3,大多數患者既往暴露于PI(73.0%)或IMiD(87.8%),64.9%的患者同時暴露于兩者,自體造血干細胞移植后復發占24.3%,合并髓外病變(extramedullary disease,EMD)占29.7%。輸注后3個月,70例存活以評價疾病狀態,ORR為87.8%,CR為73%,67.6%為MRD陰性。中位隨訪時間為47.8個月,mDOR為23.26個月,mPFS為18.04個月。CRS發生率為91.9%,其中3~4級CRS發生率為9.5%。試驗截止時,仍存活的39例中,16例有持續的CR而無疾病進展,考慮cilta-cel可能會改變骨髓瘤細胞的遺傳學特征或腫瘤微環境,對于CAR-T治療后進展超2年者,可能會促使骨髓瘤細胞對既往治療藥物重新敏感化。
髓外漿母細胞具有高侵入性,對常規治療耐藥,合并EMD者反應持續時間通常明顯縮短,但在該研究[19]中,存在1例無病生存期為60個月的合并廣泛EMD的患者,反映了cilta-cel對耐藥的髓外漿母細胞的強大殺傷力。
CARTITUDE-1[20]是在美國進行的多中心的1b/2期試驗。共納入97例RRMM患者,中位LOT為6,TCR MM 87.6%,五重耐藥42.3%。清淋后單次輸注目標劑量為0.75×106(0.5~1.0×106)CAR-T/kg。截至2022年1月11日,ORR為97.9%,嚴格意義的完全緩解(sCR)為82.5%。61例可進行MRD評估的患者中,56例(91.8%)達到MRD陰性,MRD陰性持續時間≥6個月和≥12個月者分別為68%和55%。中位隨訪時間27.7個月,mPFS、mOS未達到。27個月時PFS率為54.9%,OS率70.4%。最常見的3~4級不良事件為血液學不良事件,但在第60d大多可恢復至2級。CRS發生率為94.8%,其中3~4級CRS發生率為4.1%,3~4級NT發生率為11.3%,風險/獲益情況有利。高危亞組大多數對cilta-cel治療亦有反應,經治療ORR為95.1%~100%。單藥、低劑量即可引起深度且持久的緩解。
cilta-cel具有持續的臨床獲益,因mPFS未達到,許多患者臨床獲益仍在繼續。在單次注入cilta-cel后,從中位隨訪時間為12個月時67%的sCR到27.7個月時82.5%的sCR[21],表明反應深度和持久性相關。
2 雙靶點CAR-T
靶向BCMA的CAR-T療效顯著,但復發率仍高達45%[22],其中4%~33%出現BCMA的抗原丟失或下調,但是其他漿細胞標志物,如CD38、免疫治療靶點,如CS1在即使疾病進展的情況下仍可穩定表達。在單靶點免疫療法存在原發耐藥和復發的情況下,為緩解這些限制,設計了雙特異性CARs[11],成為克服抗原逃逸的有效方法。
2.1BCMA/CD38(BM38 CAR-T) Mei等[23]設計的單中心Ⅰ期試驗,構建了靶向BCMA和CD38的人源化雙特異性BM38 CAR-T。23例RRMM患者接受治療,結果顯示,ORR為87%,sCR為52.2%,VGPR為17.4%,MRD陰性率為87%。在合并EMD患者中,CR為56%,PR為33%,表明對EMD亦有很好緩解。中位隨訪時間為9個月,mPFS為17.2個月。2例復發患者在骨髓瘤細胞上仍存在BCMA和CD38的表達,在9個月時,77.8%的患者體內可檢測到BM38 CAR-T細胞,12個月時,62.2%的患者可檢測到。CRS發生率為87%,其中大部分為1~2級(65%),未觀察到NT。
BM38 CAR-T可分別識別BCMA和CD38,與CD38結合可能有助于抗BCMA單鏈抗體與骨髓瘤細胞上的BCMA結合,同時BCMA的結合可以反向增強CD38的結合,這種協同結合可能有助于增強BM38 CAR-T對BCMA+、CD38+的腫瘤細胞的細胞毒性。同時,BM38 CAR-T在異種移植小鼠模型中也表現出很強的抗骨髓瘤活性。
Feng 等[24]研究的國內首創的利用逆病毒載體技術構建雙特異性CAR-T。BCMA-OR-CD38-Tan-CAR或CD38-OR-BCMA-Tan- CAR的抗原結合域由抗BCMA單鏈抗體和抗CD38單鏈抗體組成,通過連接肽4串聯連接。雙抗原CAR修飾的靶向性并不影響這種CAR的轉導效率,且與單個靶向CAR-T細胞或CD38-OR-BCMA-Tan-CAR細胞相比,BCMA-OR-CD38-Tan-CAR細胞表現出更強的細胞毒性。這些BCMA-OR-CD38 Tan-CAR-T細胞可以在骨髓瘤小鼠中實現完全的腫瘤清除,并且未觀察到復發,為BCMA CAR-T細胞療法中抗原逃逸的挑戰提供了有效的解決方案。
2.2BCMA/CD19(GC012F) 部分RRMM患者在治療后無反應,可能因小部分骨髓瘤細胞克隆后可表達CD19(分化較差的骨髓瘤細胞或骨髓瘤樣干細胞)導致[12]。GC012F是全球首個基于FasT CAR技術且同時靶向BCMA和CD19的CAR-T產品,其制備時間大大縮短,僅需22~36 h。
我國Ⅱ期臨床研究[13]顯示,納入28例RRMM患者,在清淋后分為3個劑量組(DL1、DL2、DL3)接受GC012F的單次輸注治療,分別為1×105、2×105、3×105CAR-T細胞/kg。中位診斷時間4年,中位LOT為5,TCR MM患者96%。截至2022年1月26日,3組ORR分別為100%、80%和93.8%,在27例可進行MRD評估的患者中,陰性率為100%。所有患者中≥VGPR為85.7%,MRD陰性同時達sCR的患者75%。中位隨訪時間6.3個月,mDOR未達到。CRS主要為低級別,3級CRS僅有2例(7.1%),未觀察到NT。GC012F治療可獲得深度且持久的緩解,且具有良好安全性,MRD陰性率非常高,其高效的制備工藝對高危RRMM患者尤為有利。
3 通用型CAR-T(ALLO-715)
通用型CAR-T對于疾病進展快的患者,有效避免了因制備時間過長而無法使用的情況。部分患者受放化療或自身免疫抑制的影響,導致T細胞耗竭、衰老并發生功能缺陷,最終影響制備CAR-T細胞的質量,且自體CAR-T制備時易被腫瘤細胞污染,因腫瘤細胞經轉導后也可表達CAR,其表面抗原可與自體的CAR結合,從而逃避靶向攻擊,最后導致療效不佳,通用型CAR-T作為同種異體CAR-T可有效規避,亦可進行針對不同靶點的CAR-T聯合治療以提高療效,減少耐藥。
ALLO-715是一款靶向BCMA的同種異體通用型CAR-T,去除了TCRα和CD52。2021年4月,FDA授予ALLO-715再生醫學先進療法的資格認定,用于治療RRMM患者。
ALLO-715多中心的Ⅰ期臨床試驗[25]納入47例RRMM患者,LOT≥3,五重難治42.9%。清淋后分為4個劑量組(DL1、DL2、DL3、DL4),分別為40×106、160×106、320×106和480×106CAR-T細胞。對26例DL3和DL4組的患者進行療效分析顯示,ORR為61.5%,≥VGPR為38.5%,≥VGPR的患者中,MRD陰性率為80%,中位隨訪時間7.4個月,mDOR為8.3個月。在該研究中,較高劑量組(320、480×106CAR-T)表現為較高的VGPR率和MRD陰性率。CRS發生率為52.4%,主要為低級別,僅有1例為3級CRS,3級以上感染的發生率為12.8%。顯示了良好的安全性和療效,但較其他自體CAR-T而言仍有待進一步提高。
4 聯合γ分泌酶抑制劑
BCMA可被γ分泌酶從腫瘤細胞表面裂解,使得用于CAR-T細胞識別的配體密度降低,并釋放可溶性的BCMA,從而抑制CAR-T的功能。靶向BCMA的CAR-T聯合γ分泌酶抑制劑(gamma secretase inhibitor,GSI)治療RRMM患者的Ⅰ期首次試驗[26]顯示,GSI可提高漿細胞表面BCMA密度[27]。在14例可評估療效的患者中,13/14例獲得緩解,8/14例療效≥CR。在既往未接受BCMA治療的患者中,中位PFS未達到,既往接受BCMA治療的患者中,中位PFS為2個月(P<0.01)。
5 CAR-T治療后復發
Chen 等[28]回顧性分析了49例經CAR-T治療后復發的患者,在整合了既往的治療情況、疾病復發情況、合并癥及并發癥等多種因素的基礎上,制定了后續抗骨髓瘤治療(subsequent anti-myeloma therapies,sAMT),該治療包括基于抗CD38 MoAbs、泊馬度胺、二次CAR-T方案等,結果顯示,在可評估的患者中,sAMT的ORR達35%,臨床獲益率為65%。在接受二次CAR-T患者中,尤其是人源性CAR-T患者的mPFS可達14.3個月。可見,二次CAR-T治療的意義重大。
6 小結與展望
CAR-T治療TCR MM療效顯著,在臨床試驗和真實世界中均顯示了強大的抗TCR MM活性,且通過一次回輸就可實現長期的疾病控制和緩解,有利于提高MM患者的生活質量甚至回歸到正常生活。BCMA成為當下最熱門的靶點,GPRC5D作為另一個有競爭力的靶點。盡管CAR-T為TCR MM患者的治療提供了更多選擇,但仍應基于疾病的相關因素進行個體化篩選。TCR MM患者仍面臨諸多挑戰,如治療后的復發,復發的機制是什么,復發后的治療方案如何選擇,不同作用靶點如何選擇最優。隨著正在進行和未來進行的更多臨床試驗的不斷完善,這些問題將得到解答,且CAR-T聯合其他療法的綜合治療有望成為治愈MM的新策略,為TCR MM患者帶來臨床獲益。

