銀杏素調節NF-κB/NLRP3/Caspase-1信號通路對高糖誘導腎小球內皮細胞焦亡的影響
溫潔 高穎穎
糖尿病腎病是糖尿病中最常見的微血管并發癥,也是終末期腎病的主要原因[1]。腎小球是糖尿病腎臟損傷的主要部位,進行性糖尿病腎病導致腎小球高濾過以及細胞外基質產生和組成改變,進而導致系膜基質擴張和腎小球基底膜厚度增加,從而減少腎小球濾過表面積[2]。腎小球內皮細胞是腎小球濾過屏障的一個重要組成部分,高糖條件下腎小球內皮細胞的功能障礙是引起糖尿病腎病的關鍵因素[3]。因此減輕高糖條件下腎小球內皮細胞損傷可作為治療糖尿病腎病的一個有潛力的方法。銀杏素是從銀杏葉中提取的一種常見的天然無毒雙黃酮物質,已被證實具有多種生物功能,如抗癌、抗肥胖、抗炎、氧化應激和神經保護的功效[4]。Zhang等[5]研究發現銀杏素可通過抑制體內炎性反應,腎損傷以及腎小管凋亡減輕LPS誘導的小鼠急性腎損傷。另外,已有研究發現銀杏素可通過抑制高糖誘導的腎小球系膜細胞增殖和氧化應激,減少細胞外基質沉淀,并通過激活AMPk/mTOR介導的自噬途徑減輕腎小球系膜細胞功能障礙而緩解糖尿病腎病的進展,提示其可作為一種有前途的糖尿病腎病治療劑[6]。焦亡是一種半胱天冬酶-1(caspase-1)依賴的程序性細胞死亡,由炎癥小體啟動[7]。核轉錄因子кB/Nod樣受體蛋白3/半胱天冬酶-1(NF-κB/NLRP3/Caspase-1)信號通路在焦亡過程中起重要作用,NF-κB通過誘導NLRP3表達來引發炎癥小體的激活[8]。活化的NLRP3誘導caspase-1裂解為活化的caspase-1,進而驅動促炎細胞因子IL-1β和IL-18的產生,然后誘發焦亡[9]。Duan等[10]也發現Swietenine可抑制NF-κB/NLRP3/ caspase-1信號通路介導的焦亡減輕糖尿病腎病小鼠炎癥和氧化應激,從而改善糖尿病腎病,提示NF-κB/NLRP3/ caspase-1信號通路參與糖尿病腎病的發生發展。在高糖條件模擬糖尿病腎病體外環境,觀察銀杏素減輕腎小球內皮細胞損傷和焦亡的作用機制。
1 材料與方法
1.1 材料 人腎小球內皮細胞(HRGECs)購自武漢普諾賽生命科技有限公司。銀杏素(CFN90173)購自武漢中標科技有限公司;NF-κB抑制劑BAY 11-7085(HY-10257)、NLRP3抑制劑(HY-12815)、Caspase-1抑制劑VX-765(HY-13205)購自MCE公司;FAM FLICATMCaspase-1 Kit(ICT098)購自Bio-Rad公司;抗體NF-κB p65(ab16502)、Caspase-1(ab207802)、GSDMD(ab209845)、NLRP3(ab263899)、GAPDH(ab8245)、HRP偶聯的二抗(ab6721)購自英國abcam公司。
1.2 細胞培養與分組 將HRGECs細胞生長在含10%胎牛血清和1%雙抗的內皮生長培養基中,在37℃含5%CO2細胞培養箱中培養,傳3代后進行實驗。將傳代后的細胞分為正常組(正常5 mmol/L葡萄糖)、高糖組[11](30 mmol/L葡萄糖)、銀杏素低劑量組[6](30 mmol/L葡萄糖+5 μmol/L銀杏素)、銀杏素中劑量組(30 mmol/L葡萄糖+10 μmol/L銀杏素)、銀杏素高劑量組(30 mmol/L葡萄糖+20 μmol/L銀杏素)、BAY組[12](30 mmol/L葡萄糖+20 μmol/L銀杏素+2.5 μmol/L NF-κB的特異性抑制劑BAY 11-7085(BAY))、MCC950組[13](30 mmol/L葡萄糖+20 μmol/L銀杏素+10 μmol/L NLRP3抑制劑MCC950)、VX-765組[12](30 mmol/L葡萄糖+20 μmol/L銀杏素+20 μmol/L Caspase-1抑制劑VX-765),8組細胞加入相應試劑后共培養24 h。
1.3 MTT法檢測細胞存活率 將HRGECs細胞以1×104個/孔的密度接種到96孔細胞板培養24 h后,加入8組細胞培養液培養24 h后,向每個孔中加入20 μl MTT溶液(5 mg/ml),并繼續孵育4 h。然后除去培養基,向每個孔中加入150 μl DMSO以充分溶解紫色結晶,使用酶標儀記錄490 nm波長下的吸光度值(OD值),計算細胞存活率。
1.4 流式細胞術檢測細胞焦亡情況 收集8組細胞,PBS洗滌細胞后,根據試劑盒說明書,加入5 μl Caspase-1-FLICA避光孵育1 h,然后加入5 μl PI染液避光孵育15 min,流式細胞儀檢測細胞焦亡。
1.5 試劑盒法測定細胞上清IL-1β、IL-18、LDH水平 通過ELISA試劑盒檢測細胞上清IL-1β、IL-18水平,使用LDH試劑盒檢測LDH釋放水平,所有具體操作步驟嚴格按照各自試劑盒進行。
1.6 qRT-PCR法檢測細胞NF-κB、NLRP3、Caspase-1 mRNA的表達 收集8組細胞,加入TRIzol試劑從細胞中提取總RNA,檢測總RNA濃度和純度。使用逆轉錄試劑盒將總RNA逆轉錄成cDNA,然后進行PCR反應。GAPDH為內參基因,PCR條件為:95℃ 30 s, 95℃ 5 s,60℃ 30 s共40個循環。最后,采用2-ΔΔCt法分析NF-κB p65、NLRP3、Caspase-1基因相對表達水平。見表1。
1.7 Western blot檢測細胞蛋白表達情況 收集8組細胞,用PBS洗滌3次后加入RIPA裂解緩沖液提取細胞總蛋白,使用BCA蛋白質測定試劑盒測定蛋白質濃度。蛋白質上樣后由10%SDS-PAGE凝膠電泳分離,隨后轉移到PVDF膜上,用5%脫脂牛奶封閉2 h后加入一抗p-NF-κB p65、NF-κB p65、Cleaved caspase-1、Caspase-1、GSDMD、NLRP3和GAPDH在4℃下孵育過夜,隨后,將膜與二抗在室溫下孵育1 h,加入ECL試劑顯影, Image J軟件量化蛋白條帶。

2 結果
2.1 銀杏素對高糖誘導的HRGECs細胞存活率的影響 與正常組比較,高糖組細胞存活率明顯下降(P<0.05);與高糖組比較,銀杏素低、中、高劑量組細胞存活率明顯升高(P<0.05);與銀杏素高劑量組比較,BAY組、MCC950組、VX-765組細胞存活率進一步升高(P<0.05)。見表2。
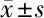
表2 銀杏素對高糖誘導的HRGECs細胞存活率的影響 n=6,%,
2.2 銀杏素對高糖誘導的HRGECs細胞焦亡的影響 與正常組比較,高糖組細胞PI+ Caspase-1陽性細胞比例明顯升高(P<0.05);與高糖組比較,銀杏素低、中、高劑量組細胞PI+ Caspase-1陽性細胞比例明顯降低(P<0.05);與銀杏素高劑量組比較,BAY組、MCC950組、VX-765組細胞PI+ Caspase-1陽性細胞比例進一步降低(P<0.05)。見表3,圖1。
圖1 銀杏素對高糖誘導的HRGECs細胞焦亡的影響

表3 銀杏素對高糖誘導的HRGECs細胞焦亡的影響
2.3 銀杏素對高糖誘導的HRGECs細胞上清IL-1β、IL-18、LDH水平的影響 與正常組比較,高糖組細胞上清IL-1β、IL-18、LDH水平明顯升高(P<0.05);與高糖組比較,銀杏素低、中、高劑量組細胞上清IL-1β、IL-18、LDH水平明顯降低,差異均有統計學意義(P<0.05);與銀杏素高劑量組比較,BAY組、MCC950組、VX-765組細胞上清IL-1β、IL-18、LDH水平進一步降低(P<0.05)。見表4。
表4 銀杏素對高糖誘導的HRGECs細胞上清IL-1β、IL-18、LDH水平的影響
2.4 銀杏素對高糖誘導的HRGECs細胞NF-κB p65、NLRP3、Caspase-1 mRNA的表達影響 與正常組比較,高糖組細胞NF-κB p65、NLRP3、Caspase-1 mRNA表達水平明顯升高,差異均有統計學意義(P<0.05);與高糖組比較,銀杏素低、中、高劑量組細胞NF-κB p65、NLRP3、Caspase-1 mRNA表達水平明顯降低,差異均有統計學意義(P<0.05);與銀杏素高劑量組比較,BAY組、MCC950組和VX-765組細胞Caspase-1 mRNA表達水平進一步降低,差異均有統計學意義(P<0.05)。見表5。
表5 銀杏素對高糖誘導的HRGECs細胞NF-κB p65、NLRP3、Caspase-1 mRNA的表達影響
2.5 銀杏素對高糖誘導的HRGECs細胞NF-κB p65、NLRP3、Caspase-1 蛋白表達影響 與正常組比較,高糖組細胞p-NF-κB p65、NLRP3、Cleaved caspase-1、 GSDMD蛋白表達水平明顯升高(P<0.05);與高糖組比較,銀杏素低、中、高劑量組細胞p-NF-κB p65、NLRP3、Cleaved caspase-1、GSDMD蛋白表達水平明顯降低(P<0.05);與銀杏素高劑量組比較,BAY組細胞p-NF-κB p65、NLRP3、Cleaved caspase-1、GSDMD蛋白表達水平進一步降低(P<0.05),MCC950組細胞NLRP3、Cleaved caspase-1、GSDMD蛋白表達水平進一步降低(P<0.05),VX-765組細胞Cleaved caspase-1、GSDMD蛋白表達水平進一步降低(P<0.05)。見圖2,表6。

圖2 銀杏素對高糖誘導的HRGECs細胞NF-κB p65、NLRP3、Caspase-1 蛋白表達
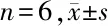
表6 銀杏素對高糖誘導的HRGECs細胞NF-κB p65、NLRP3、Caspase-1 蛋白表達影響
3 討論
腎小球內皮細胞位于腎小球毛細血管的最內層,易受血糖、血脂、炎癥刺激等因素的損傷[14]。高糖環境中腎小球內皮細胞功能障礙與糖尿病腎病發生發展密切相關[15]。多項研究已表明,高糖條件下會抑制腎小球內皮細胞的增殖并誘導促炎因子的釋放進而加重內皮損傷[16,17]。高糖誘導的體外腎小球內皮細胞損傷方法已被大多數研究人員證實可模擬糖尿病腎病環境[18]。本研究結果同樣顯示高糖條件下明顯抑制腎小球內皮細胞增殖情況,促炎因子IL-1β、IL-18水平明顯升高,表明高糖誘導的腎小球內皮細胞模型構建成功。
細胞焦亡是一種程序性細胞死亡,并伴隨著促炎因子的釋放[19]。NF-κB是炎癥、應激反應以及細胞生長和存活的關鍵轉錄因子,高糖條件下增強細胞中氧化應激,誘導NF-κB介導的炎性級聯反應[20]。有研究發現,NF-κB途徑激活誘導NLRP3的產生,NLRP3反過來觸發Caspase-1的募集,形成激活Caspase-1發生裂解,并促進GSDMD的活化以及IL-1β和IL-18的產生[21]。值得注意的是,IL-1β和IL-18是有效的促炎細胞因子,通過誘導其他促炎細胞因子和粘附分子的表達來加重炎性反應[22]。Gu等[19]也研究發現丁酸鈉可通過抑制NF-κB/Caspase-1信號通路降低高糖誘導的腎小球內皮細胞炎性因子表達,抑制細胞焦亡。另有研究報道稱NLRP3 炎癥小體激活可誘發腎小球炎癥和腎小球內皮細胞損傷,從而引發腎小球損傷[23]。Jiang等[24]也研究發現維生素D可下調NF-κB p65、NLRP3、Cleaved Caspase-1蛋白表達,通過抑制NF-κB/NLRP3/Caspase-1信號通路介導的焦亡緩解腎小球內皮細胞損傷。本研究結果發現經高糖誘導后,腎小球內皮細胞PI+Caspase-1陽性細胞比例、p-NF-κB p65、NLRP3、Cleaved Caspase-1以及GSDMD蛋白表達明顯升高,表明高糖會誘導腎小球內皮細胞發生焦亡,此研究結果與Song等[25]研究一致。另外,使用銀杏素干預后,增加了處于高糖條件下腎小球內皮細胞的存活率,抑制細胞IL-1β、IL-18和LDH的釋放、PI+ Caspase-1陽性細胞比例以及p-NF-κB p65、NLRP3、Cleaved Caspase-1和GSDMD的蛋白表達,提示銀杏素可通過抑制NF-κB/NLRP3/Caspase-1信號通路抑制高糖誘導的腎小球內皮細胞焦亡。分別使用NF-κB、NLRP3、Caspase-1特性性抑制劑BAY、MCC950、VX-765,結果發現BAY、MCC950、VX-765進一步抑制腎小球內皮細胞發生焦亡,證實銀杏素可通過抑制NF-κB/NLRP3/Caspase-1信號通路抑制高糖誘導的腎小球內皮細胞焦亡。
綜上所述,本研究發現銀杏素促進高糖條件下腎小球內皮細胞增殖,通過抑制NF-κB/NLRP3/Caspase-1信號通路介導的細胞焦亡減輕腎小球內皮細胞損傷。本研究僅從體外細胞層面研究發現銀杏素可通過NF-κB/NLRP3/Caspase-1信號通路介導的細胞焦亡發揮抗炎作用,后續本研究將進一步通過體內動物實驗進一步驗證銀杏素作用機制,為銀杏素治療糖尿病腎病提供有力的實驗基礎和理論依據。

