DNA甲基化探討中藥干預骨質疏松癥的研究進展
姚鵬程 關永林 馬斌祥 李振豪 張洋 鄧夢 常斌 張思源
1.甘肅中醫藥大學,甘肅 蘭州 730000
2.甘肅省中醫院,甘肅 蘭州 730050
骨質疏松癥(osteoporosis,OP)是一種以體內骨代謝平衡失調導致成骨細胞減少、破骨細胞增加而形成的一種骨小梁退化、骨結構脆性增加,易引發全身性骨折的中老年人常見疾病。骨質疏松的發生多由基因及生活環境、生活方式的影響,導致成骨細胞(osteoblast,OB)、破骨細胞(osteoclast,OC)活化和凋亡受到影響使骨骼重塑失調,造成骨穩態失衡[1]。全基因組關聯研究(genome wide association studies,GWAS)研究發現骨質疏松及骨質疏松性骨折(osteoporotic fracture,OPF)的發病機制與DNA甲基化改變關系密切[2]。中醫遵循人與自然相統一的觀念,重視外部環境對人體的影響,通過藥物調理使機體陰陽平衡,與表觀遺傳學關注的重點相似。中醫認為骨質疏松屬于“骨萎”的范疇,經臨床實踐及基礎研究證實補益肝腎類中藥治療OP療效顯著[3]。筆者通過整理近期相關文獻進行綜述。
1 DNA甲基化介紹
DNA甲基化(DNA methylation)是目前研究最深入的表觀遺傳調控機制,作為一種對穩定的修飾狀態,在特定DNA甲基轉移酶的催化下,基因組CpG二核苷酸的胞嘧啶5號碳位通過共價鍵結合化學修飾獲得甲基基團[4-5]。外環境對機體刺激,引起DNA甲基化修飾分子細胞調控基因表達,隨DNA的復制遺傳給子代[6],人體基因啟動子區多數存在于富含雙核苷酸“CG”周邊區域,稱其為“CPG島”;CPG島在染色質結構的組成及基因調控表達方面起著關鍵作用,DNA甲基化主要在CPG島啟動子區完成[7-8]。通過基礎研究及實驗發現[9]DNA甲基化異常可引發多種疾病,尤其是CPG島啟動子區的DNA甲基化,DNA的穩定性、不同染色質的構形改變調控基因的表達。目前,研究DNA甲基化對不同疾病的影響已成為全球生命科學探索的焦點,被稱為研究后基因時代的引領者。
2 DNA甲基化在骨質疏松發生發展中的作用
DNA甲基化在研究OB和OC兩方面,OB與OC代謝失調導致骨量減少,骨脆性增加、逐漸加重骨質疏松的發病進程。Delgado[10]在全基因組骨組織中分析骨質疏松和骨關節炎(osteoarthritis,OA)的甲基化區域差異,對23 367個CPG位點中13 463個基因進行甲基化分析,發現甲基化與基因表達在全基因組范圍內呈負相關關系。DNA甲基化參與調節骨相關細胞的基因表達,如雌激素受體α(estrogen receptor alpha,EAα)、堿性磷酸酶(alkaline phosphatase,ALP)、骨保護素(osteoprotegerin,OPG)、核因子kB受體活化因子配體(receptor activator of NF-Kb ligand,RANKL)等[11]。OPG、RNAKL兩細胞在調節骨吸收起到關鍵作用[12]。DNA甲基轉移酶(DNA methyltransferase,DNMT)由DNMT3A和DNMT3B組成介導DNA甲基化抑制基因轉錄[13]。Nishikawa等[14]研究DNMT3A在骨穩態中占有重要地位、通過DNMT3A缺陷的OC前體細胞不能有效分化為OC,發現DNMT3A介導SAM介導的DNA甲基化通過表觀遺傳抑制OC生成基因來調節OC生成。Liu等[15]在研究胸苷磷酸化酶(thymidine phosphorylase,TP)對骨髓瘤骨吸收和骨形成的影響,發現在OB祖細胞中,TP上調RUNX2和osterix的甲基化,導致骨形成減少;在OC祖細胞中,TP上調IRF8甲基化,進而上調NFATc1(活化T細胞核因子,包漿1蛋白)表達,導致骨吸收增加。因此,在骨代謝過程中DNMT起到關鍵的調控作用。同時,研究發現DNA甲基化通過改變個體表觀遺傳及對骨穩態影響隨DNA復制遺傳給子代。Laurent等[16]研究人類分化過程中甲基組動態變化,證實DNA甲基化后DNA復制的基因組可以遺傳給下代。因此,需更深入研究DNA甲基化對骨代謝的影響,闡明表觀遺傳機制,防治骨質疏松的發生發展。
2.1 DNA甲基化與成骨細胞
OB主要由骨膜和骨髓中的間充質干細胞(mesenchymal stem cells,MSCs)分化而來。Zhang等[17]研究多分化潛能骨髓(bone mesenchymal stem cells,BMSC)和脂肪組織(Adipose tissue,AT)人基質細胞中基因表達與過渡CPG甲基化的關系,發現BMSC中RUNX2及ATSC中PPARgamma2基因表達出現CPG的低甲基化和強表達,且MSCs向OB分化伴隨基因啟動子甲基化改變,得出OB在分化的過程中DNA甲基化起著重要的調控作用。在OB分化過程中RUNX2和OSX是必不可少的轉錄因子,且OSX也是RUNX2下游作用靶點[18]。同時,RUNX2和OSX相互作用參與骨細胞的分化與基因的相關表達[19-20]。
骨形態發生蛋白通過影像骨中多種細胞類型(MSCs、OB、OC等)具有骨形成和分解代謝的作用。其中BMP2具有骨誘導性,誘導RUNX2和OSX的表達促進OB分化、骨生長,已批準用于骨折愈合和脊柱手術等方面[21]。研究表明,DNA甲基化(上調)與BMP2子區甲基化(下調)對骨形成的表達起相反結果[22-23]。Raje等[23]發現OP患者骨密度與位于CpG島甲基化程度相關,BMP2轉錄起于CpG位點,此位點的甲基化水平較高,造成BMP2轉錄活性、基因表達降低,得出BMP2在OB分化中具有重要的調控作用。
β-catenin信號分子在通過Wnt/β-catenin通路起著關鍵作用。Wnt可抑制細胞漿內β-catenin降解,調節基因轉錄,加速OB分化和成熟[24]。在對Wnt/β-catenin信號通路及MSCs研究,發現MSCs向OB轉化中Wnt/β-catenin信號通路中甲基化分子發生相應改變[25]。García-Ibarbia等[26]從853例患者血液中提取DNA,對OPF和OA差異表達基因的24個單核苷酸多態性分析,得出OP患者的Wnt活性降低。以上研究表明,DNA甲基化可通過調控MSCs、BMP2、Wnt/β-catenin通路等分子的轉錄表達,參與OB的分化與成熟,影響骨質疏松的發生發展。
2.2 DNA甲基化與破骨細胞
核因子kB受體活化因子(receptor activator of NF-Kb,RANK)、配體(RANKL和OPG)位于OC表面,兩配體由OB和骨髓基質細胞合成分泌[27-28]。RANK、OPG、RANKL在骨代謝過程中占據重要的地位,有效調控OC活性及分化[29]。研究ST2小鼠的MSCs發現,誘導分化后MSCs中的RANKL基因周圍出現CPG甲基化,抑制RANKL表達,降低OB分化,表明誘導RANKL基因轉錄可調節CpG位點甲基化改變,影響OC分化[30]。Delgado-Calle等[31]探討CPG甲基化對調節OC生成的RANKL和OPG轉錄水平的影響,發現DNA甲基化與RANKL和OPG表達抑制之間關聯強烈,表明甲基化影響這些基因的轉錄,而其在OC生成中起關鍵作用。雖然Husain等[32]在人體研究中未發現OP患者與常人RANKL基因甲基化無明顯差異。但Wang等[33]在對比非OP與OPF兩組患者OPG與RANKL中CPG甲基化狀態的差異,發現OP組RANKL基因的表達遠高于非OP組,但RANKL基因甲基化水平卻低于非OP組。分析得出,RANKL基因甲基化水平降低,促使RANKL和OPG降低可增加OC活性,加速骨量的丟失,促進骨質疏松的發生。因此,RANK、RANKL、OPG在骨穩態平衡過程中具有重要調控作用[34]。見圖1。
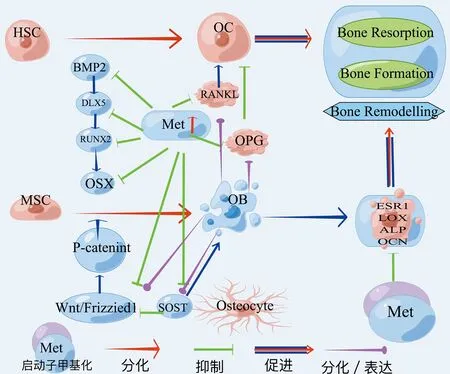
圖1 DNA甲基化對成骨、破骨細胞平衡過程的調節作用
3 中醫理論與DNA甲基化
祖國醫學在診療時注重整體觀念,強調人與自然相統一,通過改善患者飲食起居、舒暢情志配合藥物調理使機體內陰陽平衡,促使疾病治愈;研究發現表觀遺傳學也將外界環境與自身遺傳兩因素相結合,使基因組具有較高的穩定性,更加適用于外界環境改變機體做出準確的反應[35]。因此,表觀遺傳學與中醫整體觀念、人與自然相統一的理念相符合。對于骨質疏松的發病進程,中醫認為與臟腑功能密切相關,脾腎為先后天之本,可因外界環境、飲食結構的改變導致脾腎功能失調,誘發骨質疏松的發生[36]。現經表觀遺傳學研究發現,飲食結構改變通過影響宿主腸道菌群的穩態可參與骨質疏松的發病過程[37]。另有研究發現多種疾病都同時包含高、低不同的異常甲基化狀態,這與中醫對體內陰陽失衡而導致疾病的發生觀點相一致[38]。因此,應用表觀遺傳學方式對骨質疏松的發病機制進行研究,具有深遠的研究意義。
4 中藥干預DNA甲基化防治骨質疏松
近年來,隨著我國對中醫藥事業的大力發展、生命科學及人類疾病譜系的深入研究,認識到中藥多靶點、多成分的特性,難以產生耐藥性,且副作用較少,尤其在治療OP方面具有獨特優勢[39]。目前中藥調控DNA甲基化的研究集中在全基因組、單一化合物和中藥復方的異常甲基化狀態[40],發現補益肝腎類藥物(如淫羊藿、骨碎補、補骨脂、續斷等中藥及復方)具有強筋健骨、促進骨量吸收、調節骨代謝等作用,對DNA甲基化有較強的調控作用[41],能夠防治骨質疏松的發展。觀察葛根素對骨質疏松的影響,發現能有效抑制雌激素受體α(estrogen receptor α,ERα)甲基化,增強ERα mRNA表達促進OB成熟分化[42]。趙剛等[43]通過CCK-8法驗證葛根素和柚皮苷對小鼠OB增值效應的影響,發現葛根素與柚皮苷均刺激堿性磷酸酶的分泌促進OB的合成。中藥在對疾病相關靶點進行干預時,具有多成分、多環節、多基因相互作用的特點,中藥復方治療疾病時更具有相互協同作用,增強臨床療效。王劍等[44]通過在骨質疏松大鼠上給予補腎健骨中藥復方(鹿茸、續斷、牡蠣等),觀察對骨組織leptin啟動子甲基化的影響,發現有效降低Runx2、Osterix啟動子甲基化及下丘腦leptin蛋白水平,同時上調其骨組織蛋白的表達,有效防治骨質疏松的發生[45]。同實驗觀察鹿茸中藥復方對骨質疏松大鼠療效機制的研究,其復方可降低Runx2、Osterix啟動子甲基化,防治骨質疏松發生[46],可見多成分的中藥復方對基因甲基化的影響具有雙向調節的作用。金匱腎氣丸干預去勢大鼠觀察大鼠組織中ERα基因甲基化水平,發現去勢大鼠其基因表達與雌激素受體甲基化水平呈負相關,表明金匱腎氣丸對去勢骨質疏松大鼠雌激素受體甲基化水平有抑制作用[47]。另有研究,補腎藥方(左歸丸、右歸丸)在不同節點干預成骨、成脂不同誘導環境中的MSCs,通過檢測PPARy、β-catenin甲基化及基因的表達,探討補腎藥物對表觀遺傳學機制的影響,發現補益肝腎類藥可調節控制MSCs基因的表達,促進成骨抑制成脂分化,調控骨脂分化平衡[48]。由此可見,單味中藥及復方治療疾病可通過表觀遺傳學作用機制改變人體微環境、調控疾病DNA甲基化整體水平及疾病發展中關鍵基因的DNA甲基化狀態,干預疾病的發展,從而實現對疾病的防治。
綜上所述,補益肝腎類藥物在防治OP的發展具有良好的臨床療效,其藥物作用機制是通過影響OB、OC及MSCs等DNA甲基化轉錄表達,促進OB分化和抑制OC活性、增加骨量,進而防治骨質疏松的發病進程。
5 總結
骨質疏松是一種由多因素引發的骨代謝性疾病,其發病涉及多種機制,目前對其發病機制尚不清晰,因此,對于OP的治療還未有根治的手段。隨著表觀遺傳學對骨質疏松進行深入研究,人們對其發病機制的認知到達了微觀層面,DNA甲基化可通過調控OB、OC、MSCs、BMP2、RANK、RANKL、OPG、Wnt/β-catenin通路等分子的轉錄與表達,參與到OB和OC的分化,影響骨質疏松的發病進程。通過網絡藥理學分析發現,中藥治療疾病具有多靶點、多途徑等特點,與病變相關基因、蛋白進行多位點結合;通過DNA甲基化對關聯基因轉錄表達影響骨質疏松的病理變化。目前對于中藥干預骨質疏松基因變化還未進行深入研究,相關研究報道較少。從中醫整體觀來看,與表觀遺傳學關注重點相似,因此,可從DNA甲基化的角度來探討OP的防治,更好地服務于骨質疏松患者。
目前對于骨質疏松中藥干預其DNA甲基化的研究存在以下問題:骨質疏松是一個逐漸發展、演變的過程,中藥對骨質疏松的干預機制未能明確闡述;且現有的基礎實驗研究籠統地闡述中藥對引發骨質疏松相關基因、細胞、DNA甲基化的影響,未能明確點明對某一環節或途徑產生影響、進而改變基因表達,研究深度不夠;其次,中藥干預臨床觀察研究納入樣本量較少,不能完成大樣本量的隨機對照觀察和客觀的系統評價。

