基于高通量測序分析玉米浸泡液細菌菌群結構及多樣性
陳麗,王敬敬,賀明君,黎銘軒,劉陽,2*
(1.佛山科學技術學院 食品科學與工程學院,廣東 佛山 528225;2.全國名特優新農產品全程質量控制技術佛山中心,廣東 佛山 528000)
玉米淀粉生產工藝包括濕法工藝和干法工藝,干法工藝中的脂肪和蛋白質含量高,但淀粉純度較低,所以大部分工廠普遍采用濕法工藝制備玉米淀粉[1]。濕法工藝又分為靜止浸泡法和逆流浸泡法,靜止浸泡法操作簡單,但隨著浸泡時間的延長,浸泡液中的滲透作用逐漸達到平衡,玉米粒中的可溶性物質不再析出,導致玉米淀粉提取率較低,所以此方法不適用于工廠。逆流浸泡法又稱擴散法,由若干個浸泡罐、管道和泵組成,多個浸泡罐利用管道串聯在一起,形成浸泡罐裝置,通過裝置的連接作用,使浸泡液沿著裝玉米相反的方向流動[2]。逆流浸泡法可以使新鮮的玉米籽粒中所包含的可溶性物質與浸泡液溶液的濃度差始終保持在一個恒定的狀態,充分提取玉米中的可溶性物質[3],相比于靜止浸泡法,逆流浸泡法能提高玉米淀粉的提取率。因此,逆流浸泡法被大多數工廠采用[4]。
玉米浸泡液是玉米粒在玉米淀粉生產過程中,通過濕法工藝得到的玉米加工副產物[5]。在浸泡過程中玉米浸泡液會產生大量微生物,特定的浸泡環境會使微生物大量繁殖,主要包括乳桿菌、短粗桿菌、芽孢桿菌、酵母菌等。其中乳酸菌在玉米淀粉提取階段起主要作用,乳酸菌產生的乳酸,在浸泡過程中也起著重要的作用。玉米顆粒中的蛋白質,在維持浸泡過程中的Ca 和Mg 金屬離子濃度的同時,還能促進乳酸引起的玉米粒的膨脹和轉換,減少不溶性物質沉淀[6]。劉慶艾等[7]從玉米浸泡液篩選乳酸菌再加入到玉米浸泡液中,使得玉米淀粉提取率從59.22%提高到63.23%,浸泡周期從傳統的20 h 減少為10 h。叢澤峰等[8]的研究表明人為添加乳酸菌到玉米浸泡液中,既會提高玉米浸泡液的質量,同時也會縮短浸泡周期。可見玉米浸泡液中的微生物多樣性和菌群結構對于改善玉米淀粉提取工藝幫助較大。
本研究利用Illumina MiSeq 高通量測序技術對玉米浸泡副產物中的新、老酸玉米浸泡液進行細菌16S rRNA V3~V4 測序,獲得玉米浸泡液新酸、老酸中細菌菌群結構的組成及微生物多樣性,為玉米逆流浸泡階段的研究和提取玉米淀粉工藝改進和優化提供參考。
1 材料與方法
1.1 材料與試劑
隨機采集市售的不同批次老酸玉米浸泡液和新酸玉米浸泡液,新酸的SO2含量為1 300~1 500 mg/L,固形物少,老酸中SO2含量為80~120 mg/L,固形物多,浸泡溫度均為49~52 ℃。X 代表老酸,L 代表新酸,每個樣品取3 個生物學重復,樣品信息見表1。

表1 樣品名稱及分組信息Table 1 Sample names and group assignment
E.Z.N.A.?Soil DNA Kit 試劑盒:美國Omega Bio-tek 公司;瓊脂糖:西班牙biowest 公司;AxyPrep DNA凝膠回收試劑盒:美國Axygen 公司;建庫試劑盒:美國Bioo Scientific 公司;MiSeq Reagent Kit 測序試劑盒:美國Illumina 公司。
1.2 儀器與設備
5430 R 小型離心機、5424R 高速臺式冷凍離心機:德國Eppendorf 公司;NanoDrop2000 超微量分光光度計:美國Thermo Fisher Scientific 公司;DYY-6C 電泳儀:北京市六一儀器廠;BioTek ELx800 酶標儀:美國Biotek 公司;ABI GeneAmp?9700 型聚合酶鏈反應核酸擴增儀:美國ABI 公司;Illumina Miseq 測序儀:美國Illumina 公司。
1.3 試驗方法
1.3.1 樣品前處理
將玉米浸泡液灌裝至500 mL 無菌藍蓋瓶中,低溫條件下運送至實驗室,于-80 ℃冰箱保存,備用。
1.3.2 DNA 提取
玉米浸泡液中微生物總DNA 的提取按照E.Z.N.A.?SoilDNAKit 試劑盒操作指導書進行。吸取3μL DNA利用超微量分光光度計測定樣品OD 值,計算DNA純度,以電泳儀檢測核酸樣本的完整性,將檢測合格的DNA 提取物置于-20 ℃備用。
1.3.3 聚合酶鏈反應核酸擴增
參考鄧高文等[9]的方法進行樣品細菌16S rRNA聚合酶鏈式反應擴增及高通量測序Illumina MiSeq,使用338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')通用引物進行聚合酶鏈式反應(polymerase chain reaction,PCR)擴增。將PCR 產物合格的樣品送至上海美吉生物技術有限公司進行高通量測序。
1.4 數據分析
采用Illumina Miseq 的Miseq PE300 平臺測序,將測序得到的序列進行拼接和過濾,按照97%的相似度進行操作分類,使用OTU 分類單位(operational taxonomic units,OTU)[10]。
2 結果與分析
2.1 玉米浸泡液菌群α 多樣性分析
玉米浸泡液細菌α 多樣性指數測定結果見表2。
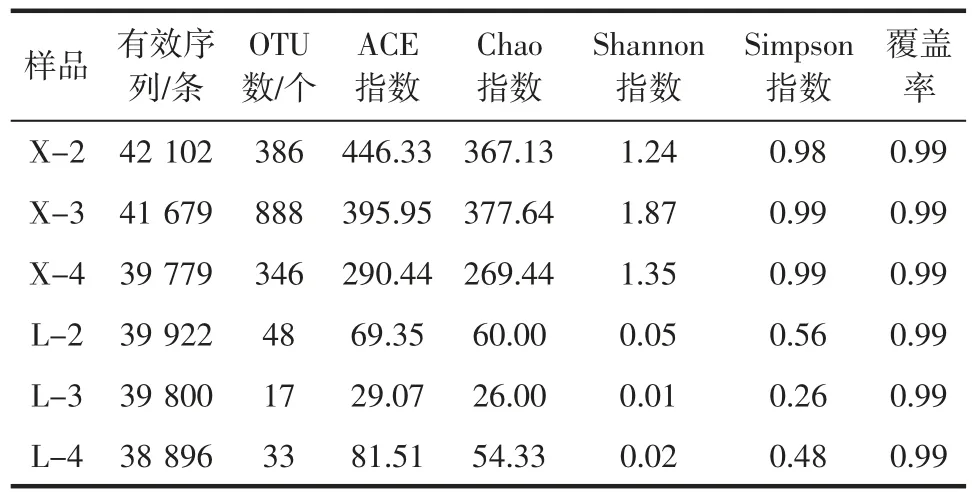
表2 玉米浸泡液細菌α 多樣性指數測定結果Table 2 Bacterial α-diversity indexes in corn soaking solution
由表2 可知,在不同的玉米浸泡液樣本中進行測序,得到的有效序列242 178 條,其中覆蓋率均達到了0.99,試驗數據表明覆蓋率高,測序深度可靠,所測序結果能夠真實反映玉米浸泡液中新酸、老酸樣品的細菌群落組成。
α 多樣性通常用以下指數來評估[11],一是樣品物種的豐度(包括Chao 指數和ACE 指數),二是物種的多樣性(包括Shannon 指數和Simpson 指數),老酸中的Chao 指數比新酸更高,可能是因為隨著浸泡時間的延長,浸泡液中的pH 值不斷升高,浸泡環境呈酸性,導致不耐受酸性的細菌逐漸消失,所以新酸樣品中細菌的群落豐度和多樣性降低。
另外Shannon 指數和Simpson 指數反映了樣本物種的多樣性,Shannon 指數逐漸增大,代表樣本指數多樣性越高。由測序結果可見,玉米浸泡液老酸中的Shannon 指數高于新酸,可見玉米浸泡液樣品老酸中的菌群多樣性大于新酸。
2.2 菌群結構分析
2.2.1 基于門水平玉米浸泡液中群落結構分析
在門水平上,圖1 顯示了根據豐度水平排名前10的物種,其他物種均被合并為其他。
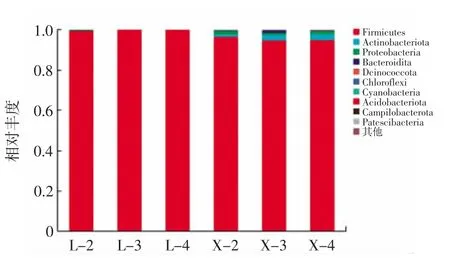
圖1 基于門水平玉米浸泡液的細菌群落結構Fig.1 Bacterial community structure in corn soaking solution at the phylum level
從圖1 可以看出,優勢菌門有厚壁菌門(Firmicutes)、放線菌門(Actinobacteriota)、變形菌門(Proteobacteria)、擬桿菌門(Bacteroidota)。在樣品中均檢測出厚壁菌門(Firmicutes),相對豐度均大于50%,表明在玉米浸泡液的浸泡過程中,厚壁菌門占主導地位,這也是因為厚壁菌門的部分厭氧菌可以在低氧、酸性和高酒精的環境中可以生存[12],其中屬于厚壁菌門中的乳酸菌也可以在低氧、低酸的環境下生長,由此可見,厚壁菌門在玉米浸泡的第一階段起著重要作用。
2.2.2 基于目水平玉米浸泡液中群落結構分析
基于目水平玉米浸泡液的細菌群落結構見圖2。

圖2 基于目水平玉米浸泡液的細菌群落結構Fig.2 Bacterial community structure in corn soaking solution at the order level
如圖2 所示,在目水平上,根據物種注釋結果,采用最大值排序法,選取在目水平最大豐度排名前10 的物種,老酸中有乳酸桿菌目(Lactobacillales)、芽孢桿菌目(Bacillales)、棒狀桿菌目(Corynebacteriales)、伯克霍爾德菌目(Burkholderiales)、類芽孢桿菌目(Paenibacillales)、梭菌目(Clostridiales)等,新酸中主要以乳酸桿菌目(Lactobacillales)為主。可見在玉米逆流浸泡的過程,新酸、老酸中主要以乳酸桿菌目為主。研究表明,在逆流浸泡階段,乳酸菌占主導地位,乳酸菌在生產過程中產乳酸,乳酸可以破壞玉米籽粒中的蛋白質結構,使得可溶性物質析出,從而提高玉米淀粉的產率[13]。在浸泡過程中,乳酸桿菌目這類菌種與亞硫酸共同作用,能改善浸泡周期過長的缺點,促進淀粉與蛋白質分離,提高玉米淀粉產量。此外,也有研究證明,破壞蛋白質與淀粉顆粒的結合,從而使蛋白能更好地溶出[14]。
2.2.3 基于屬水平玉米浸泡液中群落結構分析
基于屬水平玉米浸泡液的細菌群落結構見圖3。

圖3 基于屬水平玉米浸泡液的細菌群落結構Fig.3 Bacterial community structure in corn soaking solution at the genus level
從圖3 可以看出,老酸樣品中相對豐度最高的屬為乳酸桿菌屬(Lactobacillus)、芽孢桿菌屬(Bacillus)、海洋芽孢桿菌屬(Oceanobacillus)。新酸中主要測到了乳酸桿菌屬(Lactobacillus),可見玉米浸泡液主要優勢菌為乳酸桿菌屬。乳酸菌在玉米浸泡過程中發揮著重要作用,乳酸菌大多是厭氧菌或是部分厭氧的細菌[15],在浸泡期間可以在厭氧條件下生長和繁殖,它在發酵過程中具有重要的生物結構調節功能[16],隨著玉米浸泡發酵期延長,在發酵體系中乙醇的濃度和酸度不斷地上升,含氧量逐漸下降,幾乎所有無法承受高酸度、高乙醇濃度和厭氧條件的微生物均逐漸減少,乳酸菌成為絕對優勢菌。優勢乳酸菌從糖類中產生乳酸和乙酸,造成浸泡液中的pH 值升高,高濃度的酸性環境會抑制其他細菌的生長繁殖,同時,乳酸菌可以產生細菌素等拮抗物質,通過與其他微生物競爭底物來影響其他微生物的生長[17-19],乳酸菌還能降解其中的蛋白質,使浸泡液中的不可溶性物質轉變為可溶物質,更利于后續的清洗工作[20]。因此,乳酸菌在浸泡過程中占有絕對優勢。
3 結論
本試驗利用Illumina MiSeq 高通量測序技術對玉米淀粉逆流浸泡階段中的新酸、老酸玉米浸泡液樣品中的微生物多樣性進行分析,發現乳酸菌(Lactobacillus)在兩種樣品中均存在,說明在玉米浸泡這個重要階段乳酸菌(Lactobacillus)占據主導地位。研究表明,乳酸菌(Lactobacillus)影響玉米浸泡液的質量從而影響玉米淀粉的提取質量。本研究為玉米淀粉生產工藝優化提供了參考,同時為篩選玉米浸泡液中的優勢菌群奠定基礎。
試驗結果表明,老酸浸泡液的細菌含量比新酸更豐富。原因可能為老酸浸泡液中營養物質豐富,細菌在此條件下不斷生長繁殖;隨著浸泡時間的延長,浸泡環境逐漸呈酸性,酸性條件會抑制雜菌的生長,細菌豐度降低。因此,與老酸相比,新酸中的細菌群落降低。
SO2濃度隨著浸泡時間的延長而增加,亞硫酸濃度增加,首先通過胚芽作用于玉米皮,使胚芽變鈍,表皮由半滲透膜變為滲透膜,便于谷物中可溶性物質浸出到玉米浸泡液中。添加亞硫酸被用來作為減少玉米浸泡中的可溶性物質的手段,其作用是將玉米粒中的一些不溶性蛋白質轉化為可溶性蛋白質,從而提高玉米淀粉的提取率。同時浸泡玉米的最佳溫度為50 ℃左右,一些細菌不能在高溫下生長,因此可以通過減少在50 ℃環境下不能生長的致病和有害細菌,提高玉米淀粉的質量。

