運用OD值對常見畜禽腹瀉病原菌計數的研究
王佳 張莉 豆思遠 高軍軍 李勇生

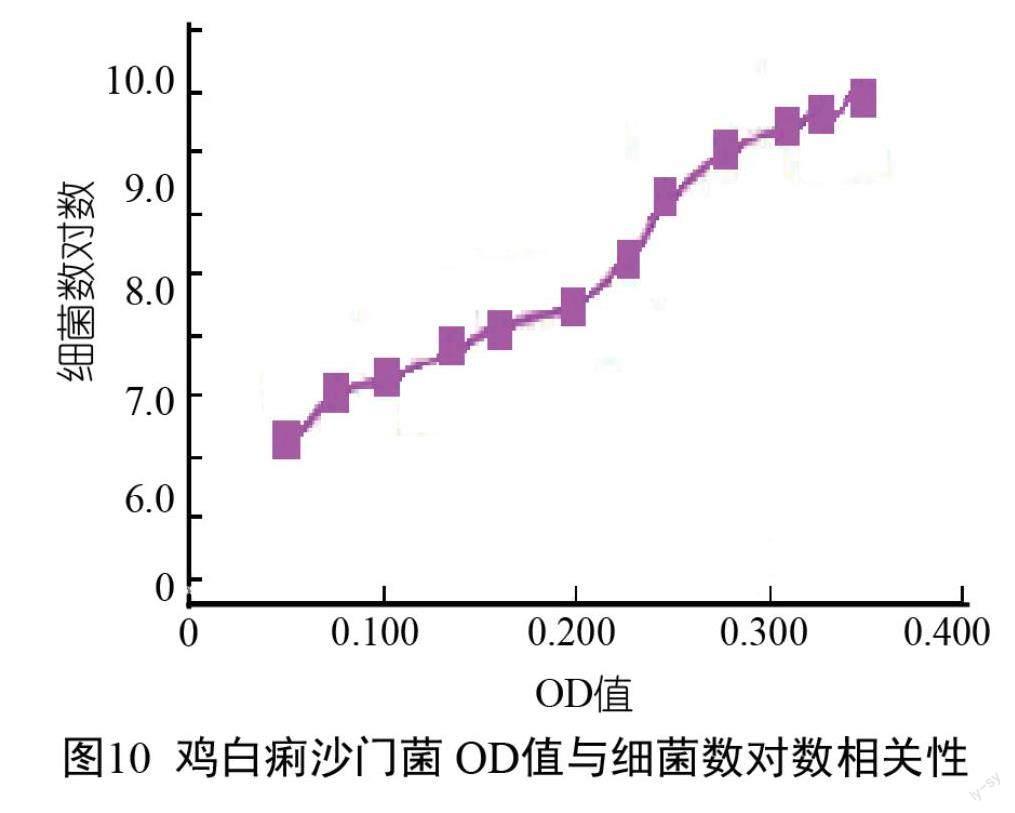
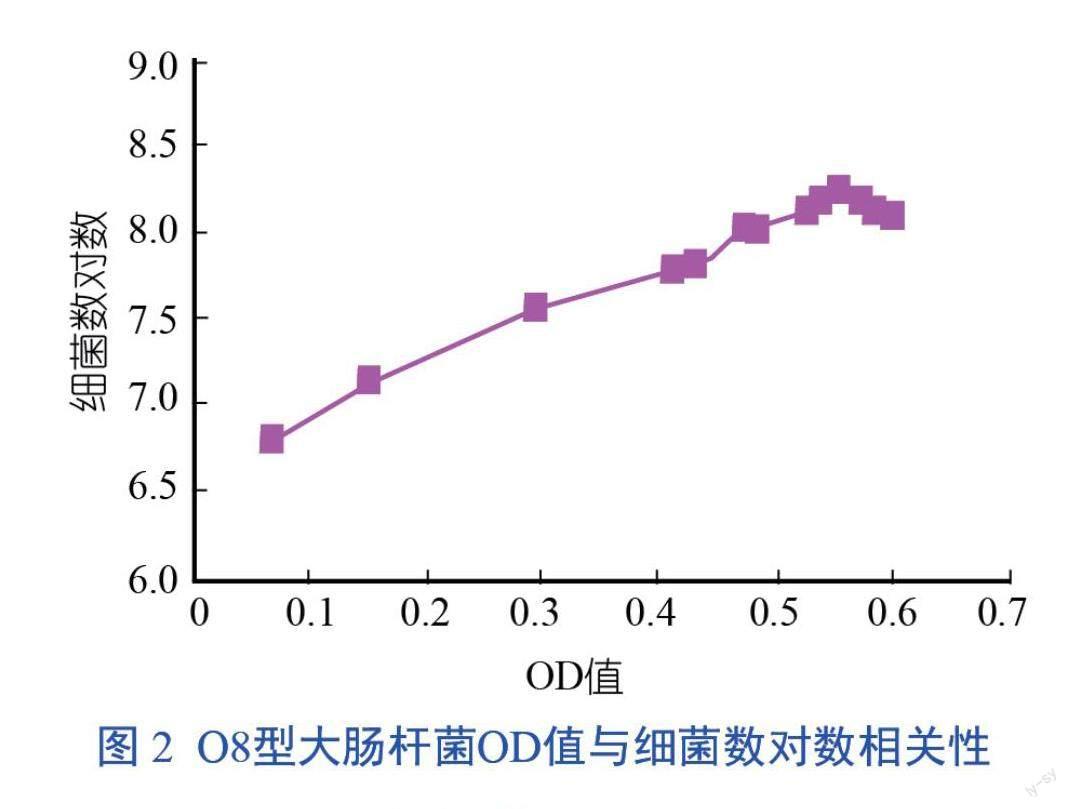
摘? 要:本研究就畜禽常見腹瀉病原菌的生長特性、細菌懸液濁度和細菌計數之間的關系進行探討,通過對常見畜禽腹瀉病原菌大腸桿菌(O8型和O139型)、雞白痢沙門菌、鼠傷寒沙門菌和雞傷寒沙門菌不同培養時間段吸光度(optical density,OD)值的測定,結合平板活菌計數法來確定這5種細菌的生長曲線,并對細菌濁度和細菌計數相關性進行統計分析,發現極顯著相關(P<0.01),建立了5種細菌在生長期和穩定期的OD值-細菌數對數的曲線回歸方程,O8型大腸桿菌:y=2.55x+6.72(r2=0.96);O139型大腸桿菌:y=1.45x+8.77(r2=0.95);雞傷寒沙門菌:y=4.50x+7.02(r2=0.95);鼠傷寒沙門菌:y=5.59x+7.67(r2=0.97);雞白痢沙門菌:y=9.72x+6.60(r2=0.98)。利用該回歸方程可快速準確地確定菌液濃度,為探討細菌的培養特性、致病機制及動物實驗中攻毒劑量的確定等相關實驗提供參考依據。
關鍵詞:生長曲線;紫外分光光度法;活菌計數
中圖分類號:S852.6 文獻標志碼:A ? ? ? ?文章編號:1001-0769(2023)04-00101-06
在微生物實驗中,在細菌毒力的測定和動物攻毒實驗時,菌液濃度是重要指標之一,常需要進行準確的細菌計數。細菌生長的測定方法分為直接法和間接法[1-2],比較常見的是平板計數法和比濁法。平板計數法結果相對準確,但操作復雜且時間較長;比濁法相對簡單,但結果易受環境溫度、培養基色澤等因素的影響,易發生偶然誤差。研究表明,細菌懸液的吸光度與其濃度呈正相關性[3-5]。本研究采用分光光度計,對大腸桿菌(O8型和O139型)、雞白痢沙門菌、鼠傷寒沙門菌、雞傷寒沙門菌等細菌懸液進行吸光度(optical density,OD)值的測定,結合平板活菌計數的結果,擬建立一種快速準確的方法,為動物實驗中攻毒劑量的濃度確定提供科學參數。
1 材料與方法
1.1 菌種
大腸桿菌(Escherichia coli:O8型和O139型)、雞傷寒沙門菌(Salmonella gallinarum)、雞白痢沙門菌(Salmonella pullorum)、鼠傷寒沙門菌(Salmonella typhimurium)由甘肅農業大學動物醫學院微生物實驗室提供。
1.2 儀器與試劑
722s可見分光光度計購自上海精密科學儀器有限公司,TD25-WS低速多管架自動平衡離心機購自長沙湘儀離心機儀器有限公司,麥氏比濁管(0.5-5 McFarland)購自北京中西遠大科技有限公司,L棒、蛋白胨、牛肉膏、瓊脂粉等購于北京奧博星生物技術有限責任公司,NaOH購于西安化學試劑廠,K2HPO4購于成都化學試劑廠,NaCL購于天津市標準科技有限公司。
1.3 菌種活化及種子液的培養
試驗前將保存的5種菌種接種于普通瓊脂斜面培養基上活化,然后接種于無菌新鮮肉湯10 mL中,37 ℃培養18 h后,將培養物倒入無菌離心管內離心10 min(3 000 r/min),用無菌生理鹽水洗滌三次后,將菌種配制成1.8×109 CFU/mL的菌懸液,一般情況下每100 mL培養18 h的大腸桿菌或沙門菌培養液,離心10 min(3 000 r/min)后制成20 mL細菌懸液,作為種子液,以備擴大培養用。
1.4 種子液擴大培養
按5%的接種量,將備用種子液接種于200 mL無菌新鮮肉湯中,充分搖勻后置于? 37 ℃培養。從培養起每隔1 h/2 h吸取菌液用分光光度計測吸光度值,并結合活菌計數法測細菌濃度,每隔1 h/2 h重復以上步驟(培養10 h及以前的菌液每隔1 h重復以上步驟,培養10 h后的菌液每隔2 h重復以上步驟)。
1.5 吸光度值測定
定時取樣,用分光光度計于460 nm/600 nm波長(O8型大腸桿菌和O139型選用460 nm,雞白痢沙門菌、鼠傷寒沙門菌、雞傷寒沙門菌選用600 nm)測OD值,以無菌肉湯作為對照[6-8]。以時間為橫坐標,不同時間段OD值為縱坐標,作圖,繪制生長曲線。
1.6 活菌計數
菌液取樣后,進行活菌計數。對培養的各菌液進行倍比稀釋(培養0~10 h的菌液取10-2~10-9稀釋度,培養超過10 h的菌液取10-4~10-10稀釋度),分別取100 μL細菌懸液均勻涂布于直徑90 mm的平板上,每個稀釋度涂3塊平板。37 ℃培養箱內培養18 h后,可見菌落形成,選取菌落數在30~300的平板進行計數,取平均值作為菌落數,計算出菌懸液的濃度(CFU/mL)。以細菌菌數的對數為縱坐標,生長時間為橫坐標,構建生長曲線。
1.7 細菌濁度與活菌計數的相關性分析
用統計方法對5種細菌的OD值與活菌計數之間的相關性進行分析,根據它們之間是否存在顯著的相關性,確定是否可以建立數學模型定量的描述細菌濁度和細菌計數的相關性,從而根據建立的曲線回歸方程進行相關指標的評估,建立OD值-細菌數對數的曲線回歸方程[9]。
2? 結果與分析
在培養條件不變的情況下,定時取樣測定其在460 nm/600 nm處的OD值(大腸桿菌測定波長采用600 nm,沙門菌的采用460 nm),以生長時間為橫坐標,OD值或細菌數對數為縱坐標,構建生長曲線。5條曲線分別包含適應期、對數生長期、穩定期和衰亡期[10]。
對5種菌的OD值與細菌數的相關性進行統計學分析,結果表明它們均存在極顯著的相關性(P<0.01),這表明可以通過建立數學模型定量描述細菌濁度和細菌計數的關系。因此可以根據建立的5種菌曲線回歸方程來進行相關指標的評估。
2.1 O8型大腸桿菌
測定O8型大腸桿菌生長曲線,其初始接種菌懸液濃度為3.7×106 CFU/mL。從圖1可以看出,該菌生長大致分為4個時期。其中0~ 1 h為適應期,在這個時期內,細菌生長遲緩。2~6 h為對數期,此時細菌數的對數值與時間呈線性關系,細菌數以幾何級數增加。6~20 h為穩定期,細菌增加和死亡的數量趨向平衡。20~24 h為衰亡期,表現“負增長”現象,即細菌死亡的數量多于細菌增加的數量。
對O8型大腸桿菌OD600 nm值與細菌數的相關性進行統計分析,結果表明存在極顯著的相關性(P<0.01),在生長期和穩定期細菌菌液的OD值與細菌數之間呈顯著相關性,O8型大腸桿菌的OD值與細菌數對數的曲線回歸方程是y=2.55x+6.72(r2=0.96)。該曲線的回歸相關指數r2=0.96,說明曲線回歸方程的擬合度比較高(圖2)。
2.2 O139型大腸桿菌
從細菌生長周期中菌懸液OD600 nm值和活菌計數的動態變化中發現,O139型大腸桿菌整個生長階段有4個時期[11]。其接種初始濃度為3.168×107 CFU/mL,接種后0~3 h,處于適應期,隨后進入對數生長期(3~6 h),并持續約3 h,6~16 h為穩定期,這一時期的活菌數最高且維持穩定;16 h后曲線呈下滑趨勢,處于衰亡期(圖3)。
對O139型大腸桿菌與細菌數的相關性分析,結果表明它們存在極顯著的相關性? ? ? ? ?(P<0.01),因此在生長期和穩定期時,O139型大腸桿菌OD600 nm值與細菌數對數的曲線回歸方程是y=1.45x+8.77(r2=0.95),該曲線的回歸相關指數r2=0.95(圖4)。
2.3 雞傷寒沙門菌
從菌株的生長曲線可以看出(圖5),菌株的適應性很強,初始接種濃度為1.52×? ? ?107 CFU/mL,生長迅速,培養2 h后進入對數期,2~6 h為對數期,生長穩定期為6~? ? ? ?16 h,16 h后出現菌體生物量減少的現象,處于衰亡期。
用統計學方法對雞傷寒沙門菌OD460 nm值與細菌數之間的相關性進行分析,結果表明它們有極顯著的相關性(P<0.01),在生長期和穩定期雞傷寒沙門菌OD值—細菌數對數的曲線回歸方程是y=4.50x+7.02(r2=0.95),曲線的回歸相關指數r2=0.95(圖6)。
2.4 鼠傷寒沙門菌
鼠傷寒沙門菌生長的適應期為0~2 h,對數生長期為2~8 h,8 h~16 h進入穩定期,16 h后進入衰亡期(圖7)。
對鼠傷寒沙門菌OD460 nm值與活菌計數之間的相關性進行統計分析,結果表明它們之間有極顯著的相關性(P<0.01),在生長期和穩定期鼠傷寒沙門氏菌OD值與細菌數對數曲線回歸方程是y=5.59x+7.67 (r2=0.97)。曲線的回歸相關指數r2=0.97(圖8)。
2.5 雞白痢沙門菌
從細菌生長周期中細菌懸液OD460值和活菌計數的動態變化中發現,雞白痢沙門菌整個生長階段有4個時期。其接種初始濃度為1.18×107 CFU/mL,0~1 h為適應期,1~ 10 h處于對數生長期,10~16 h為穩定期,16 h后為衰亡期(圖9)。
對雞白痢沙門菌OD值與活菌計數之間的相關性進行統計分析,結果表明它們有極顯著的相關性(P<0.01),在生長期和穩定期雞白痢沙門菌OD值與細菌數對數曲線回歸方程為y=9.72x+6.60(r2=0.98),曲線的回歸相關指數r2=0.98(圖10)。
3? 討論
在細菌培養過程中不斷有培養液營養消耗和細菌代謝產物增加,同時死亡細菌的消融產物也會對菌液的OD值產生影響。本試驗研究表明,菌液隨時間延長OD值不斷增加。試驗也發現,菌液顏色隨培養時間延長變化明顯,由棕黃色逐步變為淺黃色。
生長曲線體現了細菌在培養過程中的生長和繁殖規律,不同細菌在相同培養條件下生長曲線不同,相同細菌在不同的培養條件下其生長曲線也存在差異。本研究以O8型大腸桿菌、O139型大腸桿菌、雞傷寒沙門菌、雞白痢沙門菌、鼠傷寒沙門菌等為研究對象,通過24 h連續培養,對OD值、細菌數的變化規律和相關性進行分析和探討。運用統計軟件構建OD值和細菌數的直觀圖,結果表明其與理論圖形是一致的。從生長曲線圖形中發現整個生長階段有4個時期,這與相關文獻一致[7-9]。
細菌懸液的濃度和細菌菌液的混濁度呈正相關,因此檢測OD值能夠反映出菌液的濃度,濃度越高,說明生長的細菌越多。從試驗中可以看出,隨著培養時間的延長,OD值先增大,后逐漸趨于穩定,說明菌液中的菌數也經歷了一個先增多、后趨于穩定的過程。試驗設立的陰性對照組的OD值為0,從而消除干擾因素。
OD值和活菌計數,兩種測定方法在穩定期和衰亡期出現差異,這是因為OD值反映的是總菌濃度,在對數生長期細菌數呈指數增加,死亡菌數很少可忽落不計,而在穩定期尤其是衰亡期,有大量細菌死亡,活菌數逐漸減少而總菌數基本穩定,這就造成了兩種測定方法繪制的生長曲線反映的穩定期、衰亡期時間階段不同。因此在計算世代時間時,應以活菌計數法為準。細菌總數雖然是在穩定期最多,但是在對數生長期細菌形態、生物活性都很典型,對外界環境因素的作用敏感,因此研究細菌性狀、藥物抗菌作用等選擇此對數生長期最好[11-15]。
根據朗伯—比耳(Lambert-Beer)定律,溶液的濃度太高或太低,均能影響測量結果的準確性,因此OD值選擇在0.2~1的范圍。結合測量的數據,運用Excel軟件繪制散點圖。由于繪制的散點圖的分布情況類似對數函數圖形,故選擇用y=a+blgx進行擬合。令X′= lgx可將其化為y=a+bX′,其中X′是OD值,y是菌數的對數值,結果表明5種試驗菌回歸相關指數都不小于0.95,從而說明在這個吸光度的范疇內,細菌菌液的吸光度和細菌菌數具有顯著相關性。運用統計學方法對細菌濁度與活菌計數之間的相關性進行分析,結果表明它們之間存在著極顯著的相關性(P<0.01),通過構建細菌濁度與細菌計數的數學模型,可以有效彌補傳統計數方法的缺陷。
參考文獻
[1] 周杰.動物醫學實驗教程(預防獸醫學分冊 第2 版)[M].北京:中國農業大學出版社,2017.
[2] 李穎,關國華.微生物生理學[M].北京:科學出版社,2013.
[3] 張裕民.可見分光光度法對3種細菌計數的研究[J].中國藥事,2015,29(10):1066-1068.
[4] 李恪梅,魏東,王秉翔,等.人用布氏菌疫苗濃度測定分光光度法的建立[J].中國藥事,2011,25(3):233-235.
[5] 陳士運,沈旭,苗立中,等.應用紫外分光光度法進行禽多殺性巴氏桿菌(C48-1)細菌計數的研? ?究[J].山東畜牧獸醫,2009,30:12-13.
[6] 姚火春.獸醫微學實驗指導(第二版)[M].北京:中國農業出版社,2003.
[7] 中華人民共和國獸藥典2020版三部[S].附錄.
[8] 周德慶.微生物學教程(第四版)[M].北京:高等教育出版社,2020.
[9] 明道緒,劉永健.生物統計附試驗設計(第六版)[M].北京:中國農業出版社,2019.
[10] 楊廣.液體培養條件下細菌濃度兩種測定方法比 較[J].微生物學雜志,2005,25(4):71-72.
[11] 劉麗英,劉濤,畢文超,等.白色念珠菌的生長曲線和世代時間測定[J].武警醫學院學報,2009,18(3):230-231.
[12] 王升智,高波,周智慧,等.重組大腸桿菌DH5ɑ生長曲線的測定[J].獸醫科技,2010,11:96-98.
[13] 羅如松,郭愛珍,林荔雯,等.豬胸膜肺炎放線桿菌濁度與細菌計數的關系[J].畜牧與獸醫,2005(10):10-12.
[14] 張莉,吳潤,劉磊.22種中草藥對畜禽常見腸道病原菌的體外抑菌作用[J].甘肅農業大學學報,2012,47(5):7-11.
[15] 潘婷婷,肖治均,張特,等.連翹葉提取物和殼聚糖不同配比復配保鮮劑對冷藏豬肉的保鮮作用研究[J].安徽農業科學,2023,51(2):188-191.

