合并胸腺瘤的副腫瘤性天皰瘡1例并文獻回顧
何 佳 雷 霞
1 川北醫學院附屬醫院皮膚科,四川省南充市 637000; 2 陸軍特色醫學中心
副腫瘤性天皰瘡(Paraneoplastic pemphigus,PNP)是一種罕見嚴重的多器官自身免疫性疾病,它的發生和在潛在的腫瘤有關。其主要臨床特征是疼痛性口腔炎和多形性皮疹,皮疹可表現為:天皰瘡、類天皰瘡樣水皰、多形紅斑、中毒性表皮壞死松解癥(TEN)、苔蘚樣皮炎[1]。副腫瘤性天皰瘡死亡率很高,需要臨床早期發現早期治療。本文報道了1例胸腺瘤合并副腫瘤性天皰瘡患者的病例,并進行了文獻回顧。
1 病例資料
本例患者因“口腔潰瘍7年,全身紅斑、水皰2年”于2018年12月入院,患者為47歲女性,7年前患者出現口腔潰瘍,伴明顯疼痛,于當地醫院就診,診斷為“扁平苔蘚”(未行活檢),未予治療,此后患者口腔潰瘍長期存在。2年前,患者出現全身散在紅斑、水皰,于當地醫院就診,診斷為“天皰瘡”,并于激素治療(具體用量不詳)后,患者水皰干涸,口腔潰瘍好轉,并逐漸減量激素,2個月前患者無明顯誘因再次出現水皰,口腔潰瘍加重,遂來我院就診。
查體:生命體征平穩,心、肺、腹無明顯特殊。專科查體:口腔及唇部見糜爛及潰瘍,全身見散在大小不等紅斑、水皰及少量結痂,皰壁薄,尼氏征陽性,以軀干為重(見圖1)。入院后行背部水皰處病理活檢:表皮內皰,皰內中性粒細胞為主浸潤;真皮淺層血管周圍中性粒細胞、淋巴細胞為主浸潤(見圖2)。唇部糜爛處病理活檢:淺表糜爛,大部分表皮脫落,見基底層上裂隙,部分區域見棘層松解現象;真皮淺層密集淋巴細胞為主浸潤。背部直接免疫熒光陰性。唇部直接免疫熒光:基底膜帶見IgG可見熒光細顆粒呈線狀沉積,基底膜帶見C3、IgM可疑熒光細顆粒呈線狀沉積。間接免疫熒光為陰性。胸部增強CT檢查:發現左前縱隔占滿腫塊,并傾向于是胸腺瘤,雙側胸腔積液,心包積液(見圖3)。血常規、肝腎功、凝血等未見明顯異常。
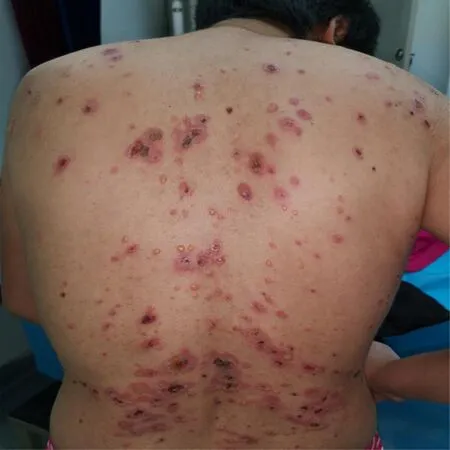
圖1 軀干大小不等紅斑、水皰及結痂照片
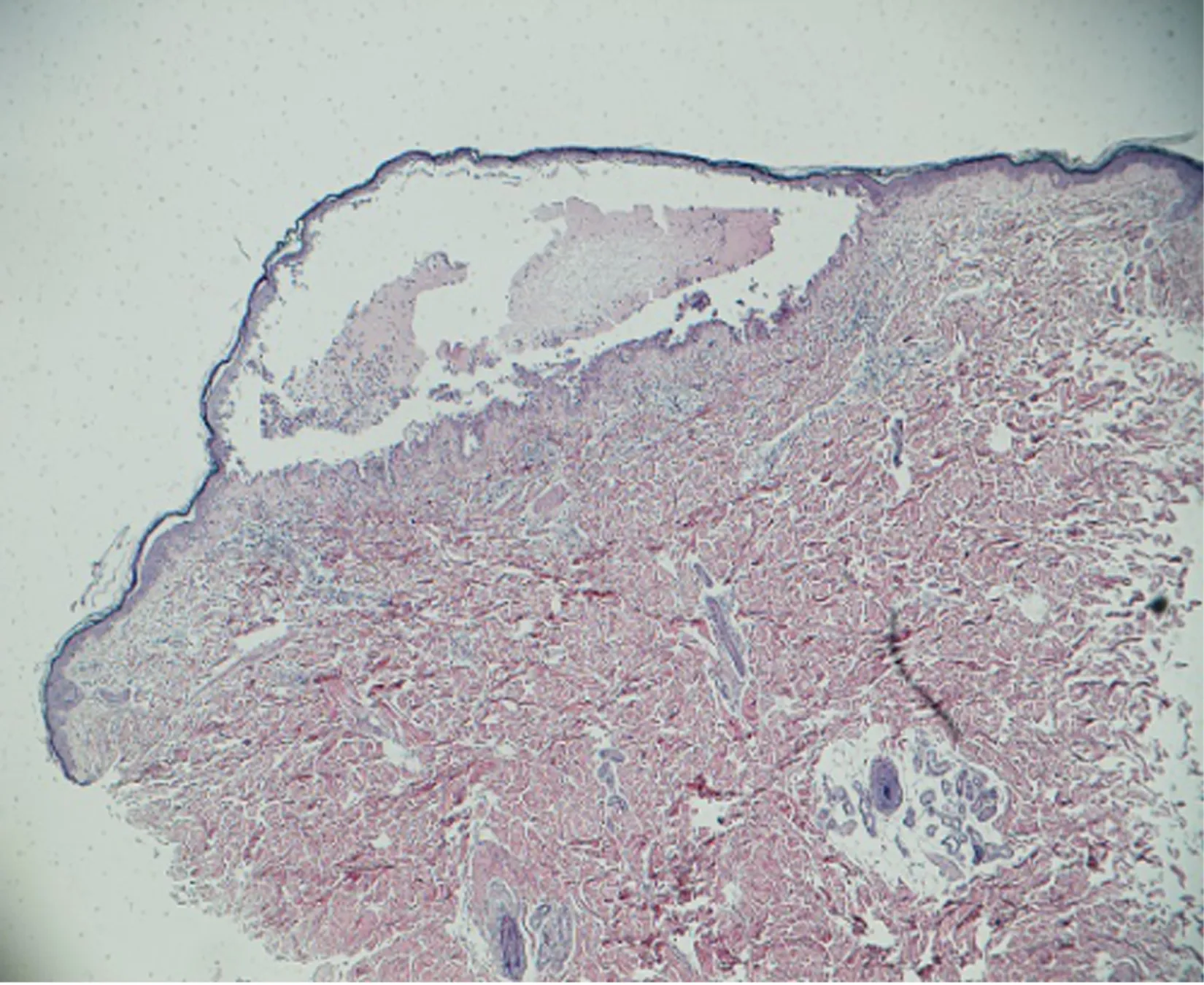
圖2 病理活檢
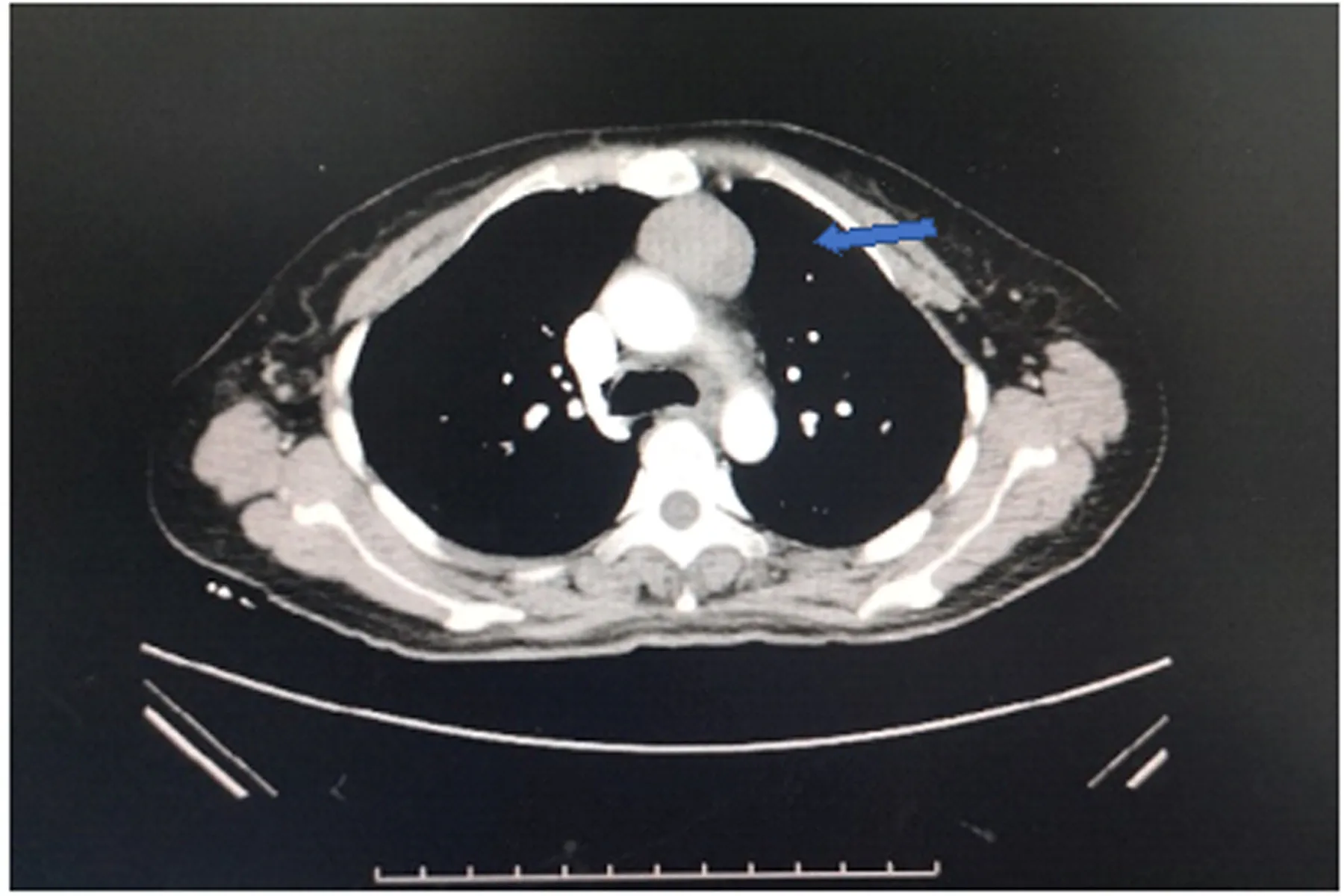
圖3 胸部增強CT
患者診斷為副腫瘤性天皰瘡(PNP)合并胸腺瘤。治療方法采用糖皮質激素持續治療,并使用“達芬奇”機器人系統進行手術。術前、術中和術后給予免疫球蛋白20g,持續5d。術后病理活檢診斷為A型胸腺瘤。經過相應治療,患者的軀干水皰明顯改善,但仍然存在口腔黏膜損傷,出院后繼續口服激素治療,并于門診隨訪,于術后3個月左右再次出現全身再次紅斑、水皰,再次住院治療,再次給予免疫球蛋白沖擊治療后好轉出院,隨后患者并未繼續于我院門診隨訪,于外院就診,此后電話隨訪患者家屬,患者已死亡。
2 討論
腫瘤性天皰瘡的病因現仍未完全清楚,現主要認為PNP患者的抗體主要屬于IgG類[2]。它可以針對多種抗原,包括橋粒芯蛋白3、橋粒芯蛋白1或兩者,α2-巨球蛋白樣蛋白-1,以及plakin家族:包斑蛋白(envoplakin)、周斑蛋白(periplakin)、橋粒斑蛋白Ⅰ/Ⅱ(desmoplakinⅠ/Ⅱ)、plectin、epiplakin[3]。epiplakin是主要的PNP自身抗原之一,與PNP的閉塞性細支氣管炎有關[4]。近年來,PNP發病被認為與基因相關,主要是DRB1*03等位基因和HLA-Cw*14相關等位基因,它們被認為是PNP的易感基因,這些遺傳特征在高加索人和中國人中更常見[2]。
PNP的臨床表現通常口腔和皮膚病變是最早的表現,PNP通常在水皰及大皰之前出現口腔糜爛,這種損害主要表現為唇部邊緣呈朱紅色,潰瘍可能涉及整個口腔黏膜表面,并可能是這種疾病的唯一表現。在兒童中,由PNP引起的口腔炎可能經常被誤認為是皰疹性口炎或TEN從而導致診斷延遲[2]。皮膚病變在一般黏膜病變發作后出現。大多數PNP患者表現為廣泛的皮膚受累,尤其是軀干、頭部,頸部和四肢近端。PNP起始變化很大。患者可能出現彌漫性紅斑、水皰—大皰性病變、丘疹、鱗屑、剝脫性紅皮病、糜爛或潰瘍。一例患者可能同時存在幾種皮損,也有可能從一種皮損演變成另一種皮損,此外也有膿皰及牛皮癬樣皮損被報道。多形性病變常見于兒童,主要部位是軀干和四肢。兒童患者通常表現出苔蘚樣PNP病變,而不是大皰性皮膚病變[2]。有報道統計相應病例發現有92.8%的PNP患者存在呼吸道上皮細胞受損,從而導致呼吸困難、阻塞性肺疾病、閉塞性細支氣管炎,均是致PNP患者死亡的主要原因,肺部受累在兒童及患有Castelman病的中國患者中常見,有學者報道了71%的PNP患者盡管已經治療了潛在的惡性腫瘤,但仍然受到閉塞性細支氣管炎的影響,從而導致預后差[2]。
PNP不同的臨床特征具有不同的病理學改變,如果體液免疫介導的細胞毒性占主導作用,那么它可能出現類似經典天皰瘡樣的水皰、糜爛,病理上表現為基底上和(或)表皮內水皰,如果細胞免疫介導的細胞毒性占主導作用,那么它可能表現苔蘚樣皮炎,病理上表現為淋巴細胞性界面皮炎和角質形成細胞角化不良[5]。此外,臨床上同時具有上述特征的可以表現為棘層松解及苔蘚樣界面皮炎同時存在,伴有基底上棘層松解角化不良是診斷PNP的重要指征[2]。直接免疫光對診斷PNP是很重要的,它在PNP患者中主要有3個表現:(1) IgG和(或)它的補體在表皮細胞間沉積;(2)顆粒/線性IgG和(或)它的補體沿基底膜帶沉積;(3)以上2種均有[5]。間接免疫熒光對診斷PNP也是一種重要手段,現認為大鼠膀胱上的間接免疫熒光具有高特異性,因此,大鼠膀胱的間接免疫熒光現在被認為是PNP的有用篩查試驗[2]。
PNP治療效果不佳,針對PNP治療目前認為切除腫瘤或有效的控制腫瘤是治療該病的重要措施,切除可切除的腫瘤可使一半的患者得到緩解[6],建議在手術前、手術間、手術后使用免疫球蛋白治療,以阻斷腫瘤釋放的循環自身抗體[7],但是如果已經發生肺部損害,手術治療并不該改善它[6]。藥物治療方面大劑量皮質類固醇仍被視為一線治療,但是,皮質類固醇只改善皮膚病變,而黏膜通常不受類固醇的影響,實際上,黏膜治療抵抗是PNP最重要的臨床特征之一,盡管如此,仍建議使用高劑量潑尼松龍作為第一線治療[2]。據報道,潑尼松龍與其他藥物聯用,包括硫唑嘌呤、環孢菌素、霉酚酸酯、環磷酰胺,靜脈注射免疫球蛋白(IVIG)和血漿置換術顯示出良好的功效和安全性。然而,黏膜病變通常也對聯合治療有抵抗力[2]。現在生物制劑在治療PNP上也有較為廣泛的報道,抗CD20單克隆抗體利妥昔單抗在由B細胞淋巴瘤引起PNP患者中有效[2], 利妥昔單抗可以減少抗表皮滴度對臨床癥狀產生影響,但它不會阻止閉塞性細支氣管炎的進展[8]。它通常耐受性良好,但有明顯的輸液和過敏反應,嚴重的可危及生命,因此,利妥昔單抗建議是在監測下輸注[9]。除利妥昔單抗外,其他抗CD20單克隆抗體和抗B細胞激活因子已被證明與利妥昔單抗一樣具有益處[3]。阿侖單抗是一種結合CD52的人源化單克隆抗體,可以誘導慢性B細胞淋巴細胞白血病患者的長期緩解,這種可用于許多既往治療(包括皮質類固醇、環孢菌素和IVIG)抵抗的患者[2]。達克珠單抗,一種針對IL-2受體α亞基的人源化單克隆抗體T細胞被認為是PNP的一種有前景的療法[2]。
PNP的預后通常較差,未正規治療情況下有90%的死亡率[2],平均生存期少于1年。PNP和潛在的惡性腫瘤沒有平行關系,實際上,PNP病變通常在消除惡性腫瘤后及惡性腫瘤得到控制后進一步進展[2]。雖然PNP的早期診斷較難,但必須努力盡早診斷PNP,以提高患者的預后及生存率。

