結腸癌特異性抗原-3、結腸癌特異性抗原-4在結腸良惡性腫瘤組織中表達及臨床意義
陳成輝, 張鐵民, 蔡親平, 王 丹, 鄭華山, 王綏群, 王石堅
海南醫學院第二附屬醫院1.胃腸外科;2.病理科;3.心血管外科,海南 海口 570311;4.海南省人民醫院 肝膽胰外科,海南 海口 570311
結腸腫瘤是指發生于結腸部位的消化道占位性病變,好發于直腸和乙狀結腸交界處,受黏膜上皮菌群環境變化、飲食和遺傳因素的影響[1-3]。結腸腫瘤難以在早期被發現,多數患者確診時已屬晚期,錯過最佳治療時機,近期和遠期預后均不理想[2,4-5]。雖然結腸腫瘤治療取得了一定進展,但5年存活率仍<50%[4]。早發現、早診斷、早治療是提高結腸癌患者存活率的重要途徑之一。目前,許多血清腫瘤標志物應用于結腸癌的輔助診斷,其表達水平與腫瘤臨床分期相關,但缺乏特異性與敏感性,不適合單獨用于早期結腸腫瘤的大規模臨床篩查。結腸癌特異性抗原(colon cancer-specific antigen,CCSA)是通過對結腸腫瘤組織細胞核內結構蛋白的聚焦蛋白組分析的特異性標志物之一[6-7]。有研究報道,CCSA蛋白的表達量與直腸腫瘤的發生、發展密切相關[8]。但CCSA與結腸腫瘤發生、發展和轉移相關性的文獻少見報道。本研究旨在探討CCSA-3、CCSA-4在結腸良惡性腫瘤組織中的表達及臨床意義。現報道如下。
1 資料與方法
1.1 一般資料 選取自2019年10月至2022年10月海南醫學院第二附屬醫院收治的150例結腸腫瘤患者為研究對象。納入標準:年齡18~70歲;經腸鏡病理檢查,確診為結腸良性腫瘤或惡性腫瘤;接受手術切除腫瘤治療;術前和術后病歷資料完整;所有患者均知情同意并簽署知情同意書。排除標準:結直腸癌復發;曾接受過化療、放療及相關抗腫瘤治療;伴其他臟器惡性腫瘤。根據腫瘤良惡性及分期,將患者分為A組(良性腫瘤;n=50)、B組(惡性腫瘤Dukes-A、B期;Dukes-A期腫瘤侵犯結腸內壁,且無淋巴轉移;Dukes-B期腫瘤侵犯漿膜層或侵入周圍組織,且無淋巴轉移;n=50)和C組(惡性腫瘤Dukes-C、D期;Dukes-C期侵犯腸壁全層且無淋巴轉移,或未侵犯全層但存在淋巴轉移;Dukes-D期伴遠處器官轉移,或廣泛浸潤及淋巴轉移;n=50)。各組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。見表1。
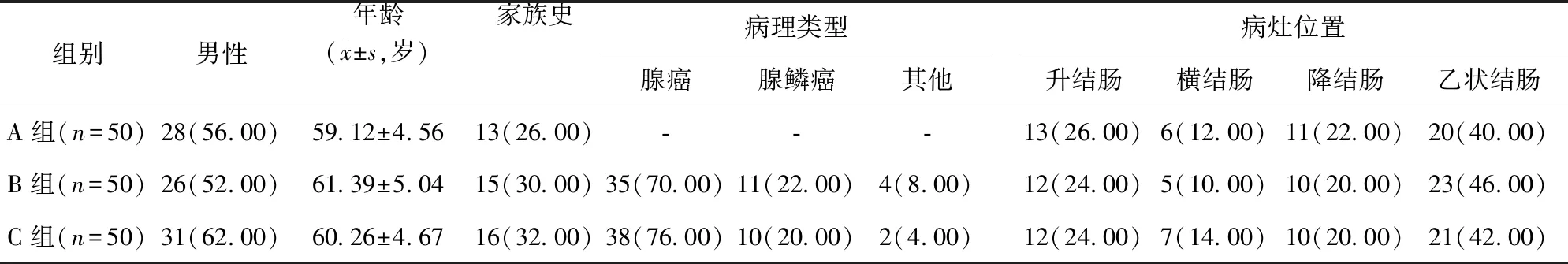
表1 各組患者一般資料比較/例(百分率/%)
1.2 研究方法 收集各組患者禁食后的新鮮結腸癌組織、癌旁組織、正常結腸組織、良性腫瘤組織,10%甲醛溶液固定,石蠟包埋,制成組織石蠟塊,做好編碼標記,常溫存放,待用。在術前和術后檢測日清晨空腹抽取患者外周靜脈血,離心后-20℃低溫保存備用。待受試標本收集工作完成后,將所有收集好的組織石蠟標本使用切片機切厚度為4 μm的石蠟組織切片、烤片。血液樣本離心取上清液。采用酶聯免疫吸附(enzyme-linked immunosorbent assay,ELISA)法檢測組織樣本及血液樣本中的CCSA-3、CCSA-4表達水平,嚴格按照ELISA試劑盒說明書操作說明進行試驗操作。做好相關實驗數據記錄。結果由2位以上副主任職稱以上的病理學專家雙盲閱片判定。
2 結果
2.1 各組患者血液、組織中CCSA-3及CCSA-4水平比較 各組患者血液、組織中CCSA-3、CCSA-4水平比較,差異均有統計學意義(P<0.05)。術后各組血液CCSA-3、CCSA-4均降低,且A組、B組低于C組,A組低于B組,差異有統計學意義(P<0.05)。各組組織中CCSA-3、CCSA-4水平均高于血液,差異均有統計學意義(P<0.05)。見表2。
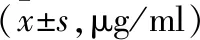
表2 各組患者血液、組織中CCSA-3、CCSA-4表達水平比較
2.2 CCSA-3、CCSA-4對結腸腫瘤良惡性診斷效能 CCSA-3診斷結腸惡性腫瘤的ROC曲線下面積為0.921,取約登指數最大時的截斷(cut-off)值為2.05 μg/ml,敏感度為89.00%,特異度為85.40%。CCSA-4診斷結腸惡性腫瘤的ROC曲線下面積為0.859,取約登指數最大時的cut-off值為0.25 μg/ml,敏感度為94.00%,特異度為84.30%。CCSA-3和CCSA-4聯合診斷結腸惡性腫瘤的ROC曲線下面積為0.957,敏感度為100.00%,特異度為96.20%。見表3、圖1。
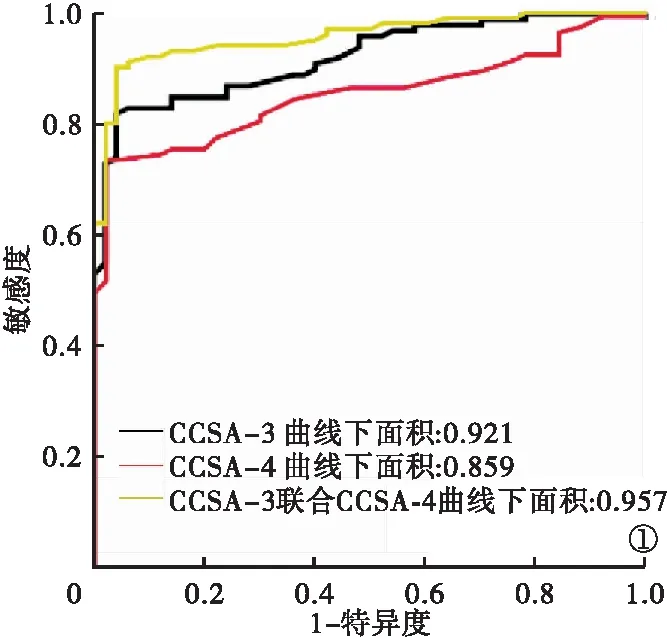
圖1 CCSA-3、CCSA-4檢測結腸惡性腫瘤的ROC曲線
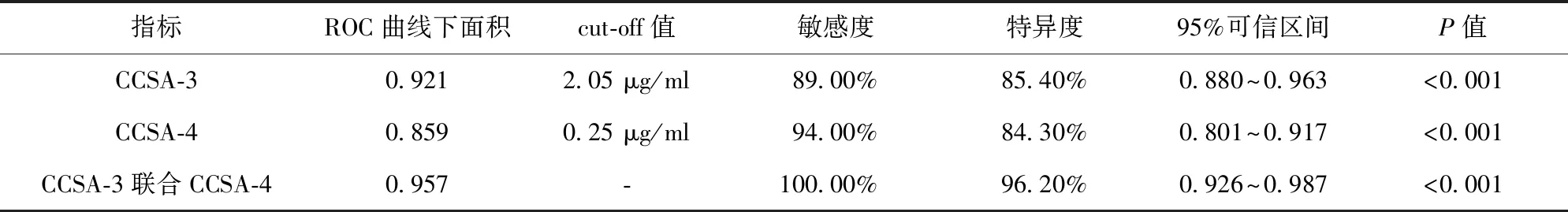
表3 ROC曲線分析結果
2.3 CCSA-3、CCSA-4對結腸癌分期診斷效能 CCSA-3診斷結腸癌分期的ROC曲線下面積為0.831,敏感度為79.10%,特異度為72.20%。CCSA-4診斷結腸癌分期的ROC曲線下面積為0.795,敏感度為74.80%,特異度為61.10%。CCSA-3和CCSA-4聯合診斷結腸癌分期的ROC曲線下面積為0.874,敏感度為81.30%,特異度為77.80%。見表4、圖2。
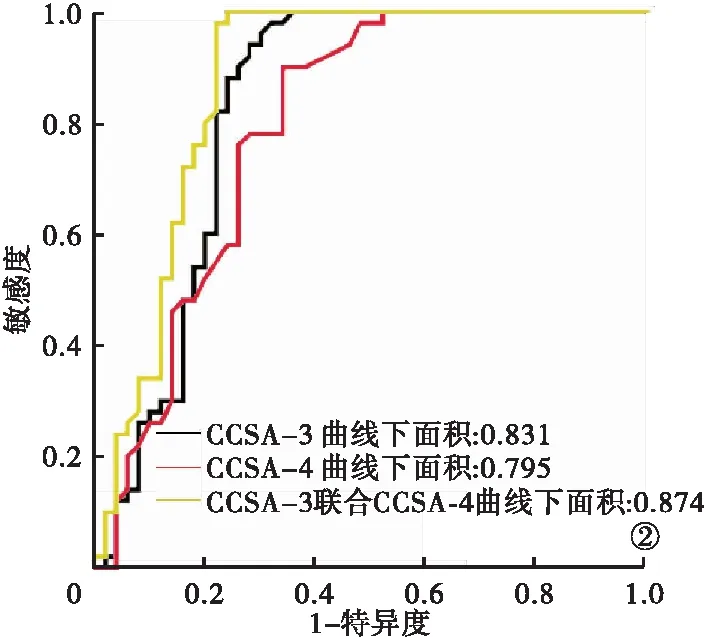
圖2 CCSA-3、CCSA-4檢測結腸癌分期的ROC曲線
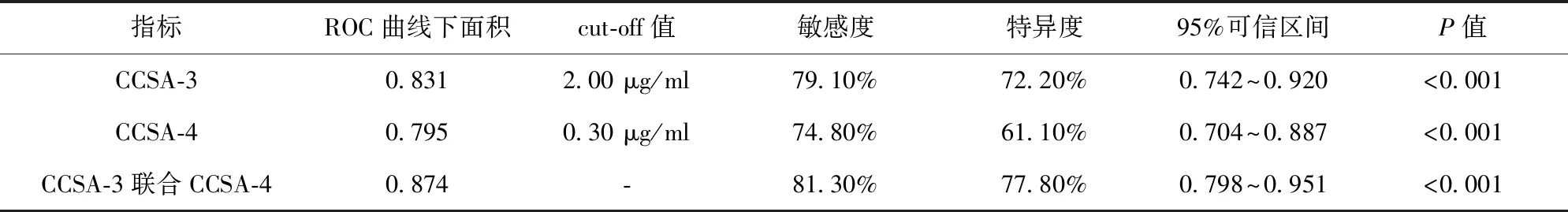
表4 ROC曲線分析結果
3 討論
腫瘤標志物是能夠反映腫瘤發生、發展的一類指標,可在一定程度上指導臨床治療,監測治療效果[9-10]。腫瘤標志物存在于腫瘤組織、血液(或其他體液)和排泄物中,可通過免疫檢測反映其水平變化[11]。血清癌胚抗原(carcinoembryonic antigen,CEA)、癌抗原19-9(cancer antigen,CA19-9)等標志物已被應用于臨床,在部分腫瘤的診斷和治療中具有特異性[12-14]。核基質蛋白包括CCSA-3和CCSA-4,在細胞內為遺傳物質復制提供場所,是膀胱癌、前列腺癌等的特異性標志物[15-16]。與健康人群相比,結直腸腫瘤/病變中核基質蛋白表達水平明顯異常,但無法區分良性腫瘤和惡性腫瘤。本研究結果顯示,術前結腸惡性腫瘤Dukes-C、D期患者血液、組織中的CCSA-3和CCSA-4水平均最高,而良性腫瘤最低;與術前比較,患者術后CCSA-3和CCSA-4水平均明顯下降。這提示,患者組織和血液中CCSA-3、CCSA-4水平可作為結腸良惡性腫瘤的鑒別診斷指標。
血液檢測具有低創、重復性佳、操作簡單等優點[17]。血液CEA、CA19-9是結腸癌常用的標志物,但其敏感度和特異度均較低,無法滿足高敏感度和特異度、操作簡便、適用度高等需求[18-19]。CCSA-3、CCSA-4可通過細胞分解或凋亡釋放到體液中,在體液中保持穩定[20]。本研究使用ROC曲線評估CCSA-3和CCSA-4檢測結腸腫瘤良惡性及其分期的效能,結果顯示,CCSA-3和CCSA-4同時診斷結腸惡性腫瘤及其分期的曲線下面積分別為0.957和0.874。這提示,CCSA-3、CCSA-4聯合檢測用于分辨結腸腫瘤良惡性具有較高的特異性。
CCSA-3和CCSA-4的分子量相似但等電聚焦點略有不同。盡管這兩種蛋白質可能密切相關或同類不同亞型,但cut-off值不同。這提示,與CCSA-4比較,CCSA-3在血清/組織中可能更豐富,這種差異可能因蛋白合成部位不同造成。因此,需要進一步實驗確認CCSA-3和CCSA-4的基因編碼方式或蛋白序列。
綜上所述,結腸惡性腫瘤患者組織、血液中的CCSA-3、CCSA-4均呈高表達,檢測血液中這兩種蛋白的敏感度較高,CCSA-3和CCSA-4有可能成為結腸癌診斷、分級和評估的特異性標志物。

