宮頸癌患者免疫功能、腸道微生物與放射性腸炎的相關性研究
景文江?陳嘉琦?羅若楠?馬武
【摘要】 目的 探討宮頸癌患者免疫功能、腸道微生物與放射性腸炎(RE)的關系。方法 回顧性分析80例宮頸癌患者的臨床資料,根據放射治療后3個月內是否發(fā)生RE將患者分為RE組(29例)和非RE組(51例),根據常見不良反應標準5.0版將RE組患者分為低癥狀級別組(1級,18例)和高癥狀級別組(≥2級,11例)。流式細胞儀檢測血漿T淋巴細胞亞群、B淋巴細胞;使用16S核糖體RNA(16S rRNA)基因擴增測序對腸道微生物進行測序及生物信息學分析。結果 無論是放射治療前還是放射治療后,RE組患者的CD4+/CD8+比值、B淋巴細胞比例均低于非RE組(P均< 0.05);RE組中,低癥狀級別組患者的CD4+/CD8+比值、B淋巴細胞比例均高于高癥狀級別組(P均<0.05)。放射治療前后,非RE組患者腸道微生物α多樣性高于RE組(P < 0.05)。2組腸道微生物組成具有明顯差異的菌屬主要為硬壁菌門和互養(yǎng)菌門;放射治療前后,RE組Acidaminococcus、Dialister相對豐度高于非RE組,Pyramidobacter相對豐度低于非RE組(P < 0.05)。結論 宮頸癌患者CD4+/CD8+比值、B淋巴細胞比例和腸道微生物特征與RE密切相關,治療期間CD4+/CD8+比值、B淋巴細胞比例下降和腸道微生態(tài)失衡的患者更容易發(fā)生RE。
【關鍵詞】 宮頸癌;放射治療;放射性腸炎;免疫功能;腸道微生物
Correlation of immune function: gut microbiota and radiation enteritis in patients with cervical cancer Jing Wenjiang, Chen Jiaqi, Luo Ruonan, Ma Wu. Cancer Radiotherapy Department, 3201 Hospital, Hanzhong 723000, China
Corresponding author, Ma Wu, E-mail: 13992690936@139.com
【Abstract】 Objective To investigate the relationship of immune function and gut microbiota with radiation enteritis (RE) in patients with cervical cancer. Methods Clinical data of 80 patients with cervical cancer were retrospectively analyzed. All patients were divided into the RE group (n=29) or non-RE group (n=51) according to the incidence of RE within 3 months after radiotherapy. According to the CTCAE5.0 adverse reaction evaluation criteria, patients in the RE group were divided into the low-symptom grade subgroup (grade 1, n=18) and high-symptom grade subgroup (≥ grade 2, n=11). Plasma T lymphocyte subsets and B lymphocytes were detected by flow cytometry. 16S rRNA gene amplification and sequencing were used for sequencing and bioinformatic analysis of gut microbiota. Results The levels of CD4+/CD8+ and B lymphocytes in the RE group were significantly lower than those in the non-RE group before and after radiotherapy (all P < 0.05). In the RE group, the levels of CD4+/CD8+ and B lymphocytes in the low-symptom grade subgroup were significantly higher than those in the high-symptom grade subgroup (all P < 0.05). The α-diversity of gut microbiota in the non-RE group was higher than that in the RE group before and after radiotherapy (both P < 0.05). The major bacterial genera with significant differences between two groups were Firmicutes and Synergistetes. The relative abundance of Acidaminococcus and Dialister in the RE group was significantly higher than that in the non-RE group, and the relative abundance of Pyramidobacter was significantly lower than that in the non-RE group before and after radiotherapy (all P < 0.05). Conclusions CD4+/CD8+, proportion of B lymphocyte and characteristics of gut microbiota are closely correlated with RE in patients with cervical cancer. The decreases in CD4+/CD8+ and proportion of B lymphocyte, and intestinal microecological imbalance during treatment may increase the risk of RE.
【Key words】 Cervical cancer; Radiotherapy; Radiation enteritis; Immune function; Gut microbiota
宮頸癌是一種原發(fā)于子宮頸部位的惡性腫瘤,是女性生殖系統常見的惡性腫瘤之一[1]。以手術、放射治療為主的綜合治療是進展期宮頸癌的主要治療手段,其中放射治療除根治性治療作用外,還可作為手術后的輔助治療,預防腫瘤的局部復發(fā)[2]。然而,超過50%的宮頸癌患者在放射治療后會發(fā)生放射性腸炎(RE),出現腹痛、急性腹瀉、惡心、食欲不振等腸道損傷癥狀,嚴重影響患者生活質量[3]。對RE發(fā)生的機制研究發(fā)現,除電離輻射造成的上皮損傷外,腸道免疫系統、腸道微生物等多種因素的相互作用,也是誘發(fā)RE的重要原因[4],但有關進展期宮頸癌放射治療患者免疫功能、腸道微生物與RE的關系有待進一步研究。本研究通過分析進展期宮頸癌放射治療患者免疫功能、腸道微生物特征與RE的關聯性,旨在為臨床RE的防治提供參考依據。
對象與方法
一、研究對象
收集2020年3月至2022年3月在本科行放射治療的80例進展期宮頸癌患者臨床資料。納入標準:①臨床檢查符合宮頸癌的相關診斷標準,進展期為Ⅱb~Ⅳa期;②年齡> 18歲;③均接受根治性放射治療或術后放射治療[5]。排除標準:①有腸道疾病、代謝疾病或免疫缺陷病史患者;②合并其他惡性腫瘤患者;③長期使用糖皮質激素或免疫抑制劑患者;④有消化道手術史患者。根據放射治療后3個月內是否發(fā)生RE將患者分為RE組(29例)和非RE組(51例)。本研究經醫(yī)院倫理委員會批準(批件號:院倫理審〔2023〕006號),入組患者均已簽署知情同意書。
二、方 法
1. RE評估與分級標準
治療期間每周監(jiān)測患者的不良反應,患者出現便血,同時合并便頻、便秘、黏液糞便等癥狀時,可確診為RE。根據常見不良反應標準5.0版(CTCAE5.0)對RE的嚴重程度進行分級[6]。RE組中,1級RE患者18例(低癥狀級別組),2~3級RE患者11例(高癥狀級別組),無4級及以上RE發(fā)生。
2. 免疫功能評估
所有患者均于放射治療前1周內、放射治療第2周結束次日取空腹靜脈血5 mL,采用美國貝克曼庫爾特有限公司CytoFLEX型流式細胞儀檢測T淋巴細胞亞群(CD3+、CD4+/CD8+)和B淋巴細胞比例。
3. 腸道微生物特征分析
3.1 樣本收集與16S rDNA測序
于放射治療前1周內、放射治療第2周結束次日采集患者糞便。采用DNA提取試劑盒(QIAamp Power Fecal DNA Kit)提取糞便樣本中的細菌基因組DNA。根據細菌的16S核糖體RNA(16S rRNA)基因序列設計V4區(qū)通用引物,對微生物核糖體RNA的V4基因片段進行PCR擴增,擴增產物行磁珠純化回收后熒光定量,使用Illumina Miseq平臺進行雙端測序。
3.2 生物信息學分析
使用QIIME軟件完成生物信息學分析,所得結果用于操作分類單元(OTU)的聚類分析和物種分類注釋。基于OTU分析結果進行α多樣性分析,獲得Observed species指數、Chao1指數、Shannon指數和Simpson指數;采用Bray-curtis、unweighted unifrac和weighted unifrac三種距離矩陣PCoA分析法進行β多樣性分析。
三、統計學處理
采用SPSS 20.0對數據進行分析。計量資料采用Kolmogorov-Smirnov法進行正態(tài)性檢驗,符合正態(tài)分布的計量資料以表示,組間比較行獨立樣本t檢驗,組內治療前后比較行配對t檢驗;計數資料以例(%)表示,組間比較行χ 2檢驗或Fisher確切概率法。α=0.05。
結 果
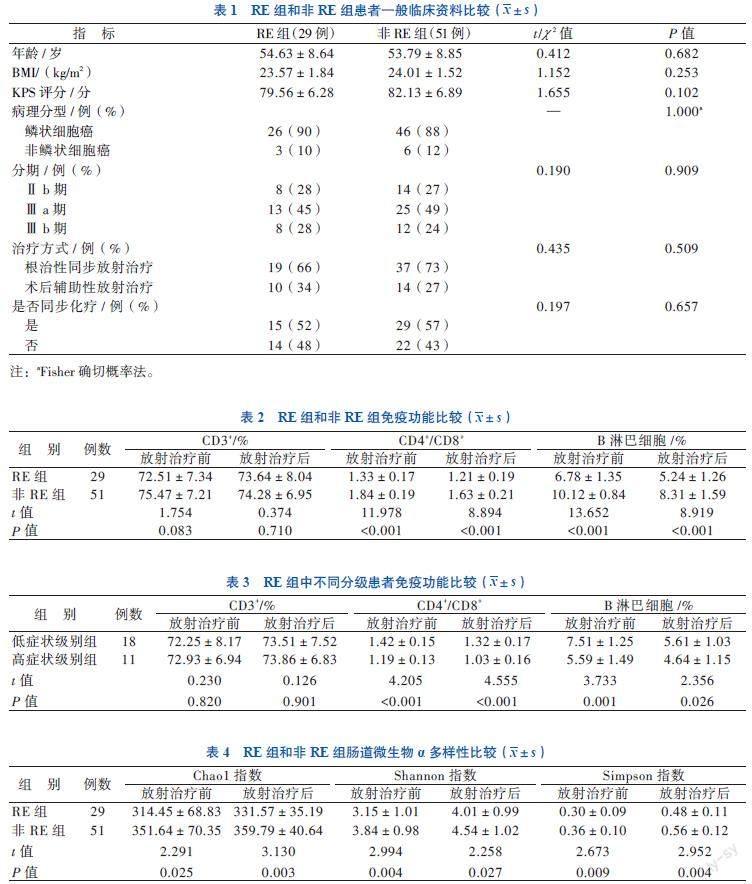
一、RE組和非RE組患者的一般臨床資料分析
RE組和非RE組的一般臨床資料比較差異均無統計學意義(P均> 0.05)。見表1。
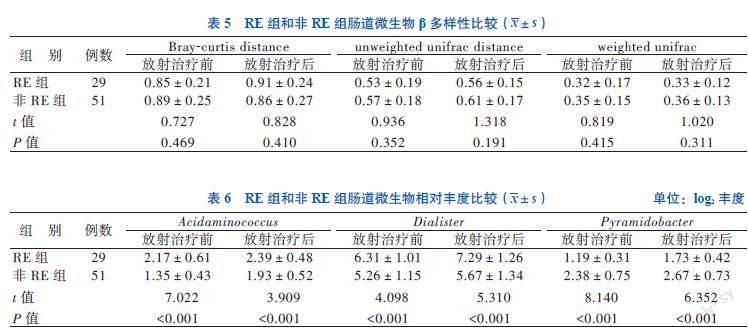
二、RE組和非RE組的免疫功能比較
放射治療前后,RE組患者的CD4+/CD8+比值、B淋巴細胞比例低于非RE組(P < 0.05)。見表2。
三、RE組中不同分級患者的免疫功能比較
無論是放射治療前還是放射治療后,RE組中的低癥狀級別組患者CD4+/CD8+、B淋巴細胞比例均高于高癥狀級別組(P < 0.05)。見表3。
四、RE組和非RE組的腸道微生物α多樣性比較
無論是放射治療前還是放射治療后,非RE組患者的Chao1指數、Shannon指數和Simpson指數均高于RE組(P < 0.05)。見表4。
五、RE組和非RE組腸道微生物β多樣性比較
無論是放射治療前還是放射治療后,放射治療前后,RE組和非RE組患者的腸道微生物的β多樣性比較差異均無統計學意義(P > 0.05)。見表5。
六、RE組和非RE組腸道微生物組成及差異分析
2組的腸道微生物組成中具有明顯差異的菌屬主要為硬壁菌門和互養(yǎng)菌門。放射治療前及放射治療后,RE組氨基酸球菌屬(Acidaminococcus)、戴阿利斯特桿菌屬(Dialister)相對豐度高于非RE組,錐形桿菌屬(Pyramidobacter)相對豐度低于非RE組(P < 0.05)。見表6。
討 論
放射治療作為惡性腫瘤的主要治療手段,在控制疾病進展、改善患者預后方面,具有重要意義。臨床研究證實,放射治療的療效主要取決于照射劑量的準確性,但由于腸道的可耐受劑量遠遠低于靶病灶的治療劑量,放射治療期間RE仍是困擾宮頸癌患者的一大問題[7]。盡管三維適形放射治療、調強適形放射治療等技術逐漸成熟,但RE的發(fā)生率仍無明顯改善。提前預測RE的發(fā)生并采取支持性的治療,是降低RE發(fā)生風險、提高患者生活質量的關鍵。
本研究顯示,與非RE組相比,RE組放射治療前后的CD4+/CD8+比值、B淋巴細胞比例均下降,提示細胞免疫功能失衡與宮頸癌放射治療患者RE的發(fā)生有關。B淋巴細胞具有更高的輻射敏感性,在放射治療期間更易受到輻射線影響[8]。輻射一方面會殺滅腫瘤細胞,另一方面會導致腸黏膜免疫調節(jié)功能失調,增加放射治療后RE的發(fā)生風險[9]。胡格等[10]的研究也發(fā)現,宮頸癌患者CD4+/CD8+比值越低、B淋巴細胞比例下降越明顯,患者放射治療后出現RE的概率越高。本研究顯示,免疫功能失衡越嚴重,患者更易發(fā)生較為嚴重的RE,考慮與腸黏膜免疫系統失衡誘導的過度炎癥反應會損害腸屏障功能,導致吸收障礙和血管損傷,使腸壁黏膜蒼白、脆弱,最終壞死有關[11]。
王中秋等[12]研究發(fā)現,特定菌群豐度的改變,會使機體處于慢性炎癥反應狀態(tài),影響屏障完整性與免疫功能,從而促進腸道疾病的發(fā)生發(fā)展。本研究顯示,發(fā)生RE的宮頸癌患者,其腸道微生物多樣性較低。分析原因可能為輻射使腸壁萎縮、腸黏膜損傷,導致腸道分泌功能減退,使腸道菌群分布發(fā)生改變,引起腸道微生態(tài)失衡,最終導致腸道微生物多樣性降低[13]。本研究中,2組患者的腸道微生物β多樣性比較無明顯差異,這與既往研究結果不同,考慮與患者個體差異、輻射時長不同等有關[14]。在腸道微生物組成方面,本研究顯示,發(fā)生RE的宮頸癌患者腸道微生物Acidaminococcus、Dialster和Pyramidobacter豐度水平發(fā)生明顯改變。Acidaminococcus、Dialister是定植于人類腸道的正常菌群,均屬于機會致病菌,二者的富集與腸道功能障礙密切相關[15]。Pyramidobacter多數為厭氧菌,其代謝產物丁酸鹽可誘導結腸癌細胞凋亡,并能通過影響結腸上皮細胞的新陳代謝,發(fā)揮維持腸道微生態(tài)平衡的作用[16]。據此可推測,RE患者在Acidaminococcus、Dialister和Pyramidobacter等屬水平上豐度的改變,可能會誘發(fā)腸黏膜炎癥反應,導致大量炎性因子釋放的釋放,從而激活炎癥通路,使黏膜屏障被破壞,從而出現腹痛、腹瀉、便血等臨床癥狀。
綜上所述,進展期宮頸癌放射治療患者CD4+/CD8+比值、B淋巴細胞比例和腸道微生物特征與RE密切相關,治療期間CD4+/CD8+比值、B淋巴細胞比例下降和腸道微生態(tài)失衡的患者更容易發(fā)生RE。
參 考 文 獻
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin, 2018, 68(6): 394-424.
[2] Aishanjiang D, Han L, Niyazi M, et al. Clinical analysis of uterine arterial interventional chemoembolization combined with radiotherapy in mid-advanced cervical cancer. J BUON, 2021, 26(3): 656-662.
[3] 羅丹, 孔為民, 陳姝寧. 宮頸癌放療后放射性直腸炎發(fā)生情況及其相關因素分析. 醫(yī)學綜述, 2021, 27(2): 400-403, 408.
[4] Hauer-Jensen M, Denham J W, Andreyev H J. Radiation enteropathy: pathogenesis, treatment and prevention. Nat Rev Gastroenterol Hepatol, 2014, 11(8): 470-479.
[5] 中華人民共和國國家衛(wèi)生健康委員會. 宮頸癌診療規(guī)范(2018年版). 腫瘤綜合治療電子雜志, 2020, 6(3): 33-43.
[6] 中國醫(yī)師協會外科醫(yī)師分會, 中華醫(yī)學會外科學分會結直腸外科學組. 中國放射性直腸炎診治專家共識(2018版). 中華胃腸外科雜志, 2018, 21(12): 1321-1336.
[7] Yang L, Yuan J, Zeng X, et al. The outcomes and quality of life of young patients undergoing adjuvant radiotherapy versus non-radiotherapy following surgery treating early FIGO stage cervical squamous cell cancer in southwestern China. Sci Rep, 2020, 10(1): 9583.
[8] Gupta N, Kainthola A, Tiwari M, et al. Gut microbiota response to ionizing radiation and its modulation by HDAC inhibitor TSA. Int J Radiat Biol, 2020, 96(12): 1560-1570.
[9] 曹新平. 精確放療時代下的放射性腸損傷. 中華胃腸外科雜志, 2020, 23(8): 734-736.
[10] 胡格, 徐秀理, 王丹, 等. CD4+/CD8+、B淋巴細胞與抑制/細胞毒性T細胞預測宮頸癌放療患者放射性腸炎的價值. 中國臨床研究, 2022, 35(6): 779-783.
[11] 丁彤晶, 念家云, 于明薇, 等. 放射性腸炎發(fā)生機制的研究進展. 腫瘤研究與臨床, 2021, 33(11): 867-870.
[12] 王中秋, 王清鑫, 鞏琳琳, 等. 放射性腸炎患者腸道菌群的變化及其與炎癥反應的關系. 中國腫瘤臨床, 2021, 48(6): 275-282.
[13] Mitra A, Grossman Biegert G W, Delgado A Y, et al. Microbial diversity and composition is associated with patient-reported toxicity during chemoradiation therapy for cervical cancer. Int J Radiat Oncol Biol Phys, 2020, 107(1): 163-171.
[14] 盛翔, 朱瑞娟, 李蘇宜. 腸道微生態(tài)與宮頸癌合并放射性腸損傷的臨床研究. 腸外與腸內營養(yǎng), 2020, 27(2): 78-83.
[15] Lopetuso L R, Petito V, Graziani C, et al. Gut microbiota in health, diverticular disease, irritable bowel syndrome, and inflammatory bowel diseases: time for microbial marker of gastrointestinal disorders. Dig Dis, 2018, 36(1): 56-65.
[16] Litvak Y, Byndloss M X, B?umler A J. Colonocyte metabolism shapes the gut microbiota. Science, 2018, 362(6418): eaat9076.
(收稿日期:2022-09-07)
(本文編輯:林燕薇)

